非洲猪瘟病毒环介导恒温扩增快速检测技术的建立及应用
2011-08-21杨吉飞关贵全刘志杰汪月凤李有全马米玲刘爱红任巧云苟惠天杜鹏飞罗建勋
杨吉飞,关贵全,刘志杰,汪月凤,李有全,马米玲,刘爱红,任巧云,苟惠天,杜鹏飞,罗建勋,殷 宏
(中国农业科学院兰州兽医研究所 家畜疫病病原生物学国家重点实验室 甘肃省动物寄生虫病重点实验室农业部草食动物疫病重点实验室,兰州 730046)
非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒科的唯一成员非洲猪瘟病毒(African swine fever virus,ASFV)引起的一种急性、发热、传染性很高的疾病[1]。家猪和欧洲野猪普遍易感,呈现复杂的临床症状,在家猪中是一种高度接触性传播疫病[2-4]。该病发病过程短,潜伏期5~15 d,有很高的发病率和死亡率,死亡率甚至可高达100%。目前,发生非洲猪瘟疫情必须上报世界动物卫生组织 (OIE), 该病是引起感染国家和地区巨大经济损失的动物疫病之一。目前,中国尚无该病的报道,但是一旦该病进入将会引起巨大的经济损失。ASF没有相应的治疗措施和有效的疫苗,对于该病的控制主要依赖快速可靠的实验室诊断和严格的防控措施。因此,建立ASF快速、准确的诊断方法尤为重要。
1921年,非洲猪瘟最早在肯尼亚报道,引起家猪100% 的死亡[5]。此后,该病一直在非洲流行,直到1957年,由于给猪饲喂航班上的垃圾和剩余食物引起该病在葡萄牙的爆发[6]。非洲猪瘟随后在欧洲的其他一些国家蔓延,包括马耳他 (1978)、意大利 (1967、1980)、法国 (1964、1967、1977)、比利时(1985)和荷兰(1986)。但是随后,除撒丁岛外,该病在这些国家相继被消灭[7]。从2005年到2010年,全世界共有25个国家报道有非洲猪瘟的爆发,主要包括非洲国家以及意大利、俄罗斯等欧洲国家[8]。
2007年,非洲猪瘟传入高加索地区的格鲁吉亚,并且迅速蔓延到相邻的国家,包括亚美尼亚、阿塞拜疆和俄罗斯[9]。野猪的感染以及传播媒介的存在使得该病的防控变得比较复杂[10]。目前,非洲猪瘟在俄罗斯持续存在和蔓延,从2007年1月到2010年11月,俄罗斯共爆发非洲猪瘟173起,2010年1月~11月共爆发73起,其爆发呈现上升的趋势[11]。中国与俄罗斯存在4300多千米的边境线,使得中国防范非洲猪瘟的传入面临严峻的挑战。
非洲猪瘟感染显示不同的临床表现型,急性和亚急型病例与其他猪的出血性疾病相似,因此对于该病的实验室诊断尤为重要。到目前为止, 非洲猪瘟病毒的分子检测方法包括常规PCR检测技术、实时荧光定量PCR检测技术、古典猪瘟-非洲猪瘟多重PCR检测技术等方法[12-14],由于中国尚无该病的报道,对于该病的研究相对比较少。为有效防控该病进入我国,建立一种敏感性高,特异性好、易操作的检测技术尤为重要。2000年, 日本科学家Notomi等发明了一种敏感性很高的DNA扩增技术——环介导的恒温扩增技术 (loop-mediated Isothermal Amplification, LAMP)[15],该方法操作简单,反应的特异性较高,所需反应时间较短。根据LAMP反应的这些特点,本实验应用该技术,基于非洲猪瘟病毒结构蛋白vp72基因建立非洲猪瘟病毒的LAMP检测技术。
1 材料和方法
1.1 主要仪器和试剂 PCR仪 购于BIO-RAD公司;凝胶成像仪购于上海培清科技有限公司;恒温水浴锅购于上海精宏实验设备有限公司;基因组提取试剂盒、dNTP购于Roche Diagnostics公司;Taq Gold DNA 聚合酶、10倍PCR Buffer II以及MgCl2购于 Applied Biosystems公司;Bst DNA聚合酶为NEB公司产品;甜菜碱为Sigma公司产品;pGEM-Teasy载体为Promega公司产品;分子量标记为TaKaRa公司产品。
1.2 样品及基因组 非洲猪瘟病毒17个毒株的基因组由西班牙食品与农业技术研究院动物健康研究中心(CISA-INIA)、欧盟非洲猪瘟参考实验室馈赠;猪细小病毒、猪圆环病毒2型、口蹄疫病毒、猪瘟病毒、猪繁殖与呼吸综合症病毒、猪水泡病病毒基因组以及cDNA由中国农业科学院兰州兽医研究所病毒病研究室提供;伪狂犬病毒基因组由购买的活疫苗提取;副猪嗜血杆菌、猪传染性胸膜肺炎放线杆菌、猪链球菌的基因组由中国农业科学院兰州兽医研究所传染病研究室提供;猪衣原体基因组由中国农业科学院兰州兽医研究所人兽共患病研究室提供;猪野外样品及蜱的基因组由本研究室保存。
1.3 引物设计及序列 根据NCBI公布的序列及DNAStar软件分析的结果,基于非洲猪瘟病毒vp72基因,应用序列“AY578689”,使用PrimerExploerV4软 件(http://primerexplorer.jp/elamp4.0.0/index.html)设计LAMP特异性引物。本研究中所使用的PCR引物序列为OIE参考PCR方法中的引物[13],引物序列由Invitrogen公司合成,引物序列见表1。

表1 LAMP和PCR引物序列表Table 1 Sequences of primers for LAMP and PCR
1.4 重组质粒的构建 本研究中所使用的重组质粒由本实验室构建保存。应用设计的引物,从非洲猪瘟病毒E70分离株基因组扩增含有vp72基因的目的片段,连接至pGEM-T Easy载体,转化到JM109感受态细胞后测序。
1.5 LAMP及OIE-PCR反应体系 LAMP及PCR扩增反应均在25 μL体系中进行。LAMP反应体系中包括: 12.5 μL LAMP反应缓冲液(40 mmol/L Tris-HCl(pH 8.8)、20 mmol/L KCl、16 mmol/L MgSO4、20 mmol/L (NH4)2SO4、0.2% Tween 20、1.6 mol/L甜菜碱、2.8 mmol/L dNTPs)、0.9 μL引物混合液(40 pmol FIP、BIP、20 pmol LF、LB、5 pmol F3、B3)、2.0 μL DNA 样 品、1.0 μL (8U) Bst DNA聚合酶(New England Biolabs, M0275L)和8.2 μ L灭菌水。OIE-PCR反应体系包括:17.375μ L灭菌水、 2.5μ L 10 × PCR Buffer II、2 μ L MgCl2(25 mmol/L)、0.5 μ L dNTP 混 合 液 (10mmol/L)、0.25 μ L 引 物 PPA-1 和 PPA-2(20 pmol/μ L)、2.0 μ L DNA样品、0.125 μ L Taq Gold DNA聚合酶(5 U/μ L)。
1.6 LAMP反应条件测定 LAMP反应的条件一般选择在60°C~65°C条件下进行,扩增的时间大约在30~60 min范围内。根据所设计的LAMP特异性引物, 选择可以将非洲猪瘟病毒基因组扩增的最佳反应条件。
1.7 OIE-PCR反应条件 PCR扩增反应程序为:95°C 预变性10 min;95°C 变性15 s,62°C 退火30 s,72°C 延伸 30 s,40 个循环;72°C 再延伸 7 min。
1.8 扩增产物的测序鉴定 将非洲猪瘟病毒LAMP特异性引物的F2:5'-CCAAATCCTTTTGCGATG C-3',B1c:5'-TCTCGTTAAACCAAAAGCGC AG-3'做为PCR扩增的引物。将LAMP扩增的产物50倍稀释,用引物F2和B1c进行PCR扩增。PCR反应在50 μL体系中进行,包含灭菌去离子水 37.7 μL、10 × PCR buffer(plus Mg2+) 5 μL、2.5 mmol/L dNTPs Mixture 4 μL、上下游引物各1 μL、LAMP反应产物模板1 μL、Taq DNA聚合酶 (5 U/μL) 0.3 μL。扩增反应程序为: 94°C预变性4 min;94°C变性30 s, 60°C退火30 s, 72°C延伸30 s,35个循环;72°C再延伸7 min。将PCR扩增产物回收,连接至pGEM-T Easy载体,转化到JM109感受态细胞后,菌液送去测序。
1.9 LAMP反应特异性 以猪细小病毒、猪圆环病毒2型、伪狂犬病毒、口蹄疫病毒、猪瘟病毒、猪繁殖与呼吸综合症病毒、猪水泡病病毒、副猪嗜血杆菌、猪传染性胸膜肺炎放线杆菌、猪链球菌、猪衣原体、健康猪和蜱的基因组以及cDNA为模板,应用设计的引物检测LAMP反应的特异性。
1.10 LAMP反应敏感性 将含有非洲猪瘟病毒vp72基因的重组质粒pGEM-T-vp72-E70定量到1 ng/μL, 倍比稀释,检测LAMP反应的敏感性,并且与OIE参考的PCR方法进行平行比较。
1.11 LAMP方法的应用 应用设计的引物对欧盟非洲猪瘟参考实验室馈赠的非洲猪瘟病毒17个毒株的基因组以及本实验室保存的50份猪和30份蜱的野外样品基因组进行检测,对该方法进行评价。
2 结果
2.1 重组质粒的构建结果 应用本实验室所设计的引物,以非洲猪瘟病毒分离株E70为模板,扩增目的片段,构建含有非洲猪瘟病毒vp72基因的重组质粒,经PCR方法鉴定和测序分析,显示构建的重组质粒含有非洲猪瘟病毒vp72基因的完整序列,命名为pGEM-T-vp72-E70。
2.2 LAMP反应条件选择结果 根据所设计的LAMP引物, 选择用于非洲猪瘟病毒检测的最佳反应条件,结果表明,最佳反应条件为:65°C水浴锅中扩增60 min,反应扩增完成后立刻转入80°C水浴锅中灭活2 min。取扩增产物5 μL, 以TAE为缓冲液,在2%的琼脂糖凝胶(含0.5 μg/mL溴化乙锭) 中,在电压75 V电泳中进行检测。
2.3 LAMP反应结果 如图1所示, 本实验所设计的特异性引物在特定的条件下可以对含有非洲猪瘟病毒vp72基因的重组质粒pGEM-T-vp72-E70进行扩增。
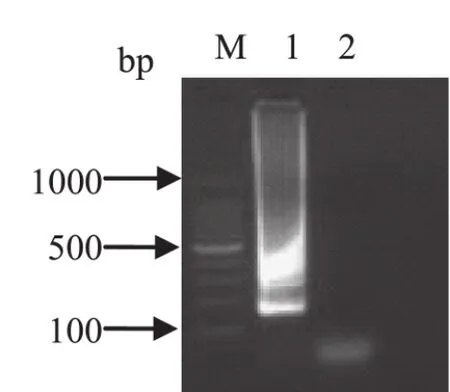
图1 LAMP扩增反应结果Fig.1 Amplif i cation of ASFV by LAMP
2.4 LAMP扩增产物鉴定结果 LAMP反应的产物经过PCR扩增后, 将扩增的目的片段进行测序。测序结果与NCBI上面已提交的序列比对显示正确。
2.5 LAMP特异性结果 LAMP技术用于非洲猪瘟病毒vp72基因的检测, 其电泳检测结果如图2所示。所设计的LAMP引物只能将含有非洲猪瘟病毒vp72基因的重组质粒进行扩增。对照组所有样品均为阴性, 表明该引物分别与猪细小病毒、猪圆环病毒2型、伪狂犬病毒、口蹄疫病毒、猪瘟病毒、猪繁殖与呼吸综合症病毒、猪水泡病病毒、副猪嗜血杆菌、猪传染性胸膜肺炎、猪链球菌、猪衣原体、健康猪和蜱的基因组以及cDNA均没有交叉反应,设计的引物具有很好的特异性, 该方法可以用于对非洲猪瘟病毒的检测。

图2 非洲猪瘟病毒LAMP特异性结果Fig.2 Specif i city of LAMP for ASFV detection

图3 非洲猪瘟病毒LAMP与PCR敏感性比较结果Fig.3 Sensitivity comparisons of LAMP and PCR for ASFV detection
2.6 LAMP敏感性结果 应用特异性引物对已定量的重组质粒进行扩增, 并且与OIE参考的标准PCR方法进行比较。LAMP反应的敏感性如图3所示。非洲猪瘟病毒特异性的LAMP引物可以检测到2 fg的重组质粒(pGEM-T-vp72-E70) DNA(图A);OIE参考的PCR引物可以检测到0.2 fg的重组质粒(pGEM-T-vp72-E70) DNA(图B)。
2.7 LAMP方法的应用 本研究所建立的非洲猪瘟病毒LAMP方法能够对参考实验室提供的非洲猪瘟病毒17个毒株的基因组进行扩增,产生具有特征性的阳性结果;中国收集的50份猪的基因组以及30份蜱的野外样品基因组检测结果均为阴性。本研究中所检测的非洲猪瘟病毒17个毒株见下表2。
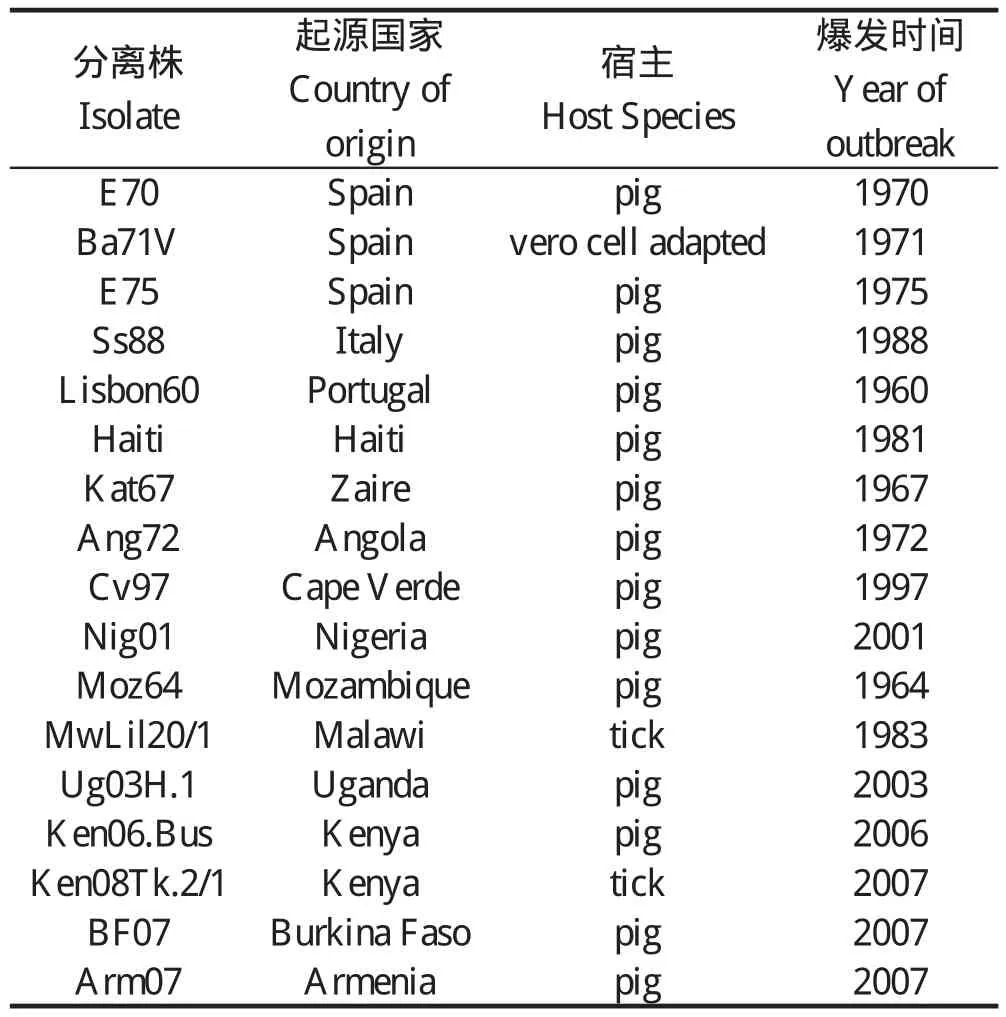
表2 非洲猪瘟病毒参考毒株Table 2 African Swine Fever Virus reference strains
3 讨论
非洲猪瘟的爆发和流行对感染国家和地区造成了巨大的经济损失。由于世界经济贸易、人员往来等因素,很多无非洲猪瘟疫病的国家面临着该病传入的危险局面。2007年,该病进入高加索地区以来,俄罗斯持续爆发非洲猪瘟疫情。2010年1月到11月,俄罗斯共爆发73起非洲猪瘟疫情中,可疑动物73 819头,病例4750例,死亡1088,共淘汰猪58 450头[16]。野猪的存在以及猪产品贸易使得该病在俄罗斯持续存在和蔓延,对周边国家产生了巨大的威胁。
非洲猪瘟在临床上与猪的其他出血性疾病,比如古典猪瘟、高致病性蓝耳病、伪狂犬病等很难进行区分[17],并且由于非洲猪瘟病毒有22个基因型[18],引起的临床症状较为复杂,根据临床表现很难完成对该病的确诊,建立一种简单可靠的实验室检测技术尤为重要。vp72基因是非洲猪瘟病毒的结构蛋白基因,不同毒株之间的差异较小,因此,本研究基于非洲猪瘟病毒vp72基因设计引物,建立了检测非洲猪瘟病毒特异性核酸的LAMP技术,并且应用本研究所建立的LAMP检测技术与OIE参考的PCR方法进行比较。研究结果显示,本研究中所设计的引物具有很好的特异性,与猪的其他病毒病和细菌病病原以及健康猪和蜱之间均没有交叉反应。敏感性结果显示,本研究所建立的LAMP方法敏感性略低于OIE参考的PCR方法,但是非洲猪瘟病毒感染产生较高的病毒血症[19],通常可以在感染的第二天能够从血液中检出[13],并不会影响该检测技术在该病检测中的应用,并且LAMP技术应用于核酸检测具有特异性高、快速、所需设备简单、容易操作等优点,因此,该技术能够用于非洲猪瘟病毒的检测。虽然国外已有该技术用于非洲猪瘟病毒检测的报道[20],但是基于各国猪病的疫情及流行毒株与我国存在差异,必须建立适用于我国、并且可以与我国流行的其他猪病病原区分的检测方法;国内的相关报道均基于单一合成的含有vp72基因的重组质粒[21,22],本研究中应用非洲猪瘟病毒的全基因组,全基因组共包括不同国家和地区、不同爆发时间17个非洲猪瘟病毒分离株的基因组,保证了该方法的特异性和敏感性。根据本研究,引物是LAMP技术稳定性的关键因素,本研究通过序列比对、软件分析设计了多套引物,在保证特异性、敏感性的基础上,经多次重复筛选,选出了比较稳定、可用于该病检测的一套引物。
本研究中参考的OIE-PCR方法完全按照“非洲猪瘟参考实验室” SOP所规定的试剂以及操作程序进行,反映出了本研究所建立方法的有效性。应用本研究所建立的LAMP检测技术,能够有效扩增非洲猪瘟病毒17个毒株的基因组,而对我国收集的50份猪的基因组、30份蜱的野外样品基因组检测均为阴性。在参考实验室惠赠的非洲猪瘟病毒基因组中,包括2007年分离自亚美尼亚的非洲猪瘟病毒基因Ⅱ型(Arm07),基于LAMP技术本身的一些优点,目前该技术可以用于与俄罗斯接壤地区的疫情监控。
基于上述研究结果,本研究基于非洲猪瘟病毒vp72基因所建立的LAMP技术,能够快速、准确的对非洲猪瘟病毒进行检测,可以有效地用于非洲猪瘟的快速诊断以及防控,为防止该病进入我国奠定一定的基础,具有很好的应用前景。
[1] Arias M, Sánchez-Vizcaíno J M.African Swine Fever:Trends in emerging viral infections of swine[M].Iowa (IA):Iowa State University Press, 2002, 119-124.
[2] Arias M, Sánchez C, González M A,et al.Peste porcina Africana: Curso digital de enfermedades infecciosas porcinis[EB/OL].2002.http:www.sanidadanimal.info.
[3] Arias M, Martínez Escribano J A, Rueda A,et al.La peste porcina Africana[J].Med Vet, 1986, 3: 333-359.
[4] Sánchez-Vizcaíno J M.African swine fever: Diseases of swine, 8th ed[M].Iowa (IA):Iowa State University Press, Ames, 1999, 93-102.
[5] Montgomery R E.On a form of swine fever occurring in British East Africa[J].J Comp Pathol, 1921, 34: 59-191.
[6] Costard S, Wieland B, Dixon L K,et al.African swine fever: how can global spread be prevented [J].Phil Trans R Soc Lond B Biol Sci, 2009, 364(1530): 2683-2696.
[7] Plowright W, Thomson G R, Neser J A.African swine fever: Infectious diseases of livestock, with special reference to southern Africa, 1st ed[M].Cape Town, South Africa: Oxford University Press, 1994, (1): 567-599.
[8] OIE WAHID.Office International des Epizooties-World Animal Health Information Database (WAHID)Interface[EB/OL].2010.http://www.oie.int/wahis/public.php?page=disease_timelines
[9] Rebecca J R, Michaud V, Heath L,et al.African Swine Fever Virus Isolate, Georgia, 2007[J].Emerg Infect Dis,2008, 14(12): 1870-1874.
[10] Beltran-Alcrudo, Lubroth D, Depner J,et al.African swine fever in the Caucasus[M].FAO Empres Watch,2008, 1-8.ftp://ftp.fao.org/docrep/fao/011/aj214e/aj214e00.pdf.
[11] OIE WAHID.Office International des Epizooties-World Animal Health Information Database (WAHID)Interface[EB/OL].2010.http://www.oie.int/wahis/public.php?page=country_disease_time_series.
[12] Agüero M, Fernández J, Romero L,et al.A highly sensitive and specific gel-based multiplex RT-PCR assay for the simultaneous and differential diagnosis of African swine fever and Classical swine fever in clinical samples[J].Vet Res, 2004, 35(5): 551-563.
[13] Agüero M, Fernández J, Romero L,et al.Highly sensitive Pcr assay for routine diagnosis of African swine fever virus in clinical samples[J].J Clin Microbio, 2003,41(9): 4431-4434.
[14] King D P, Reid S M, Hutchings G H,et al.Development of a TaqMan® PCR assay with interna1 amplification control for the detection of African swine fever virus[J].J Virol Methods, 2003, 107(1): 53-61.
[15] Notomi T, Okayama H, Masubuchi H,et al.Loopmediated isothermal amplification of DNA[J].Nucleic Acids Res, 2000, 28(12): e63-e63.
[16] OIE WAHID.Office International des Epizooties-World Animal Health Information Database (WAHID)Interface[EB/OL].2010.http://www.oie.int/wahis/public.php?page=disease_immediate_summary.
[17] Office International des Epizooties.African swine fever:Manual of diagnostic tests and vaccines for terrestrial animals [M].5th ed.Paris: Office International des Epizooties, France.2004: 1178.
[18] Boshoff C I, Bastos A D.Gerber S,et al.Genetic characterisation of African swine fever viruses from outbreaks in southern Africa (1973-1999)[J] .Vet Microbiol, 2007, (121): 45-55.
[19] Knudsen R C, Genovesi E V.In vivo and in vitro effects of moderately virulent African swine fever virus on mitogenesis of pig lymphocytes[J].Vet Immunol Immunopathol, 1987, 15(4): 323-36.
[20] James H E, Ebert K, King D P,et al.Detection of African swine fever virus by loop-mediated isothermal amplification[J].J Virol Methods, 2010, 164(1-2): 68-74.
[21]江彦增, 朱鸿飞.非洲猪瘟病毒环介导等温扩增快速检测方法的建立[J].中国畜牧兽医, 2009, 2: 72-74.
[22]王彩霞, 刘建, 林祥梅, 等.环介导恒温扩增技术快速检测非洲猪瘟病毒[J].动物医学进展, 2010, 31(2): 15-19.
