不同温度下注射用丹参稳定性的紫外光谱相似度考察Δ
2011-08-10吕建伟广西柳州市中医院药剂科柳州市545001
吕建伟,李 茵,孙 丽(广西柳州市中医院药剂科,柳州市 545001)
中药注射剂配伍后的稳定性是影响其安全性的主要因素之一,但以往对中药注射剂配伍稳定性的研究主要是采用高效液相色谱法[1]、紫外分光光度法[2]测定其中“有效成分”的含量,合并微粒检测进行考察,结果虽然均发现微粒增多,但“有效成分”的含量却没有变化,含量测定结果无法解释微粒变化。中药的紫外吸收光谱是由各组分特征吸收光谱叠加而成,中药紫外光谱特征的差异在一定程度上反映了中药化学成分的差异,能从中医的“整体观”反映微量成分的变化。温度是影响中药注射剂稳定性的重要因素之一,而以往的中药注射剂稳定性试验均没有考察这一因素[3]。因此,本试验通过比较不同温度下注射用丹参无菌粉末紫外相似度的大小,以为注射用丹参的保存和配伍温度提供参考。
1 仪器与试药
AL204电子天平(梅特勒-托利多仪器(上海)有限公司);UV-1601紫外-可见分光光度计(日本岛津公司);GWJ-4微粒检测仪(天津大学精密仪器厂)。
注射用丹参(哈药集团中药二厂,规格:400 mg,批号:090333);0.9%氯化钠溶液(武汉滨湖双鹤药业有限责任公司,批号:090504901)。
2 方法与结果
2.1 配伍液的配制
用0.9%氯化钠溶液,分别在5、10、20、30、40 ℃下将注射用丹参配制成浓度为0.8 mg·mL-1的溶液(虽然5%葡萄糖注射液和0.9%氯化钠溶液对注射用丹参的稳定性影响均较小[4],但5%葡萄糖注射液具有较明显的末端吸收,为尽量避免对测试样品紫外图谱的影响,本试验选用0.9%氯化钠溶液为配伍液进行试验),并相应标记为A、B、C、D、E,即为试验用配伍液。
2.2 配伍液7 h外观变化
取上述各配伍液,分别于0、1、2、3、4、5、6、7 h观察其外观变化(沉淀、气泡、颜色变化)。结果表明,所有配伍液均未出现颜色变化,均无沉淀、气泡产生。
2.3 紫外光谱扫描条件
精密量取上述C溶液2 mL,置于25 mL容量瓶中,加注射用水至刻度。选择波长范围200~400 nm、吸光度记录范围-0.10~3.999、波长间隔0.5 nm、扫描速度中速、石英比色皿厚度1 cm,以扫描3次光谱数据平均值作为配伍液最终紫外光谱数据。结果发现,配伍液在281 nm波长处有最大吸收。
2.4 配伍液稳定性的紫外光谱相似度考察
精密量取上述A~E溶液各2 mL,用0.9%氯化钠溶液稀释至25 mL,相应标记为A1、B1、C1、D1、E1。以0.9%氯化钠溶液作空白对照,按“2.3”项下条件分别于0、1、2、3、4、5、6、7 h进行紫外扫描,并根据紫外光谱相似度公式计算相似度值。
紫外光谱相似度计算公式[5]:
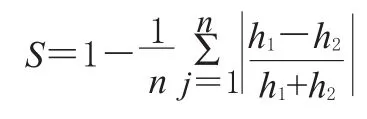
式中,S为相似度,h1、h2为两光谱曲线某一对应采样点的吸光度,1/n为权重系数,绝对值表示由于吸光度的差异而使它们相似度降低的程度。如果两光谱曲线所有采样点的吸光度都相等,则S等于1;两光谱曲线的采样点吸光度相差越大,S越小。S能够定量反映出两紫外吸收曲线的相似程度:如果配伍液在7 h内的S较大且都接近,那么就可以表明配伍后药物质量成分基本稳定;若S较小或相差较大,则表明两药物配伍后稳定性下降。
2.4.1 权重的设置 对200~400 nm波长范围内的紫外吸收光谱进行全程比较,涉及400个波长点对应的紫外吸收值。由于其中的峰和谷往往表达着药品的重要特征,因此应在峰和谷的周围设置较大的权重[6]。此外,药物的“有效成分”也应占有较大的权重。根据丹参中水溶性酚酸类在紫外区(281±3)nm波长处有最大吸收、原儿茶醛在268 nm波长处[7]有最大吸收,酯溶性成分丹参酮ⅡA和隐丹参酮在254 nm波长处有最大吸收[8],选择在250~290 nm波长处也设置较大权重。同时,由于紫外吸收的吸光值最好在0.1~1.5A,以最大程度减少颗粒对测试结果的影响,因此对吸光值<0.1或>1.5的均应设置较小权重。本研究采用层次分析法(AHP)[9]设定权重系数。AHP是由美国科学家T L Saaty在20世纪70年代提出的,是一种解决多目标的复杂问题的定性与定量相结合的决策分析方法,它是用决策者的经验来判断各衡量目标能否实现的标准之间的相对重要程度,并合理地给出每个决策方案的各标准的权重,利用权重系数求出各方案的优劣次序。AHP的本质是试图使人的思维条理化、层次化,它充分利用人的经验和判断,并予以量化,进而对决策方案进行排序。
结合图谱,本试验将200~400 nm波长范围分为6段,每段的权重采用AHP进行研究,具体步骤如下:(1)建立评价目标树。将200~400 nm波长分为6段,分别为200~220、221~240、241~270、271~290、291~310、311~400 nm。(2)构成两两比较优先矩:比较同一层次目标的相对重要性,并构成两两比较矩阵。目标树图各层次评分标准见表1;目标树中6项目标成对比较判断优先矩阵见表2。

表1 目标树图各层次评分标准Tab1 Point standard to different hierarchy of goaltree
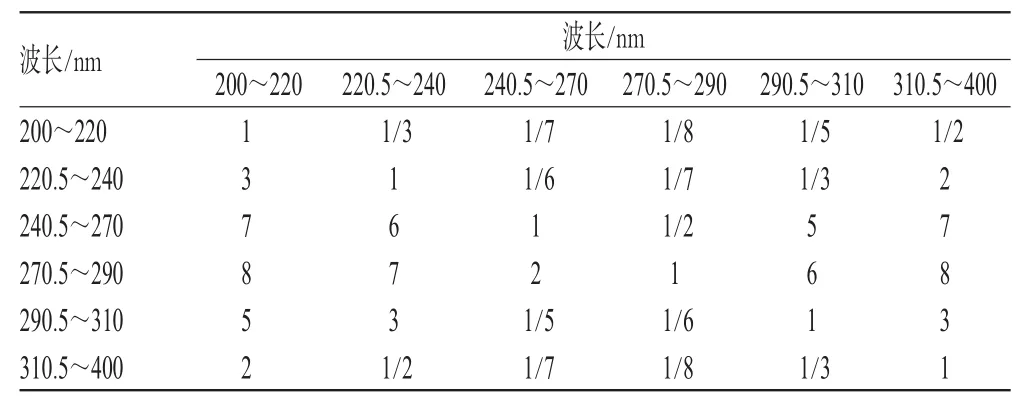
表2 目标成对比较判断优先矩阵Tab2 Comparison judgment of priority matrix between couple objects

表3 平均随机一致性指标RI表Tab3 RI table of average random coincidence indicator

表4 权重系数Tab4 Weight coefficient
2.5 试验结果
2.5.1 紫外光谱图变化及紫外光谱相似度计算结果 由于紫外吸收光谱只有1个或几个宽带吸收,曲线的形状变化不多,连续监测同一样品溶液得到的紫外光谱应该是连续变化的。因此,本试验拟设定0 h的相似度为1,相邻时间点测到的相似度为相对相似度,而间隔时间点测到的相似度(绝对相似度)为各相邻时间点的相对相似度乘积。计算方法:相对紫外光谱相似度为配伍后1 h与前1 h对比得出的相似度,如以配伍后1 h与0 h紫外光谱数据计算出相似度S1,以此类推,以2 h与1 h、3 h与2 h、4 h与3 h紫外光谱数据计算出的相似度分别为S2、S3、S4。再以S2与S1相乘得到2 h相对于0 h的绝对相似度S2a,以S3与S2a相乘得到3 h相对于0 h的绝对相似度S3a,以S4与S3a相乘得到4 h相对于0 h的绝对相似度S4a,以此类推。相对紫外光谱相似度(与0 h的测定图谱对比,0 h紫外光谱相似度设为1)见表5;绝对紫外光谱相似度(与0 h的测定图谱对比,0 h紫外光谱相似度设为1)见表6。
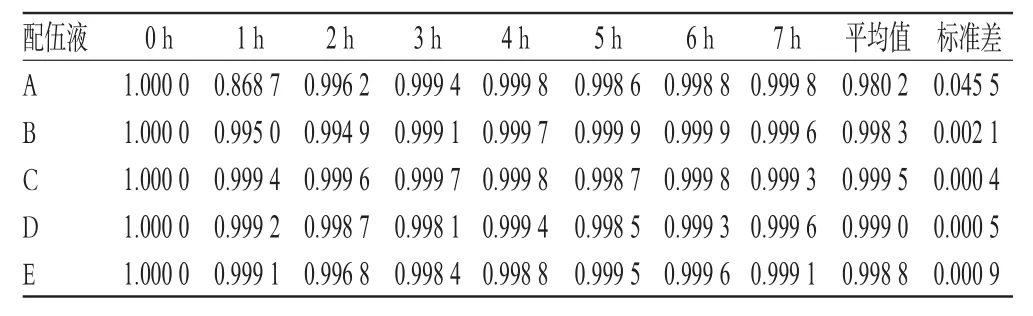
表5 7 h内的相对紫外光谱相似度Tab5 Similarity of relative UV spectrum in 7 h

表6 7 h内的绝对紫外光谱相似度Tab6 Similarity of absolute UV spectrum in 7 h
2.5.2 单变量双因素方差分析结果 试验结果用SPSS17.0软件进行统计,使用普通线性模型(General Liner Model)的单变量双因素方差分析方法。定义不同温度注射用丹参的紫外光谱相似度值为因变量,定义时间和温度为固定因素变量,采用主效应方差分析进行检验。结果,相对紫外光谱相似度的F=1.05,P>0.05;绝对紫外光谱相似度的F=12 271.796,P<0.01。多重比较结果显示,任意两个配伍液的相对紫外光谱相似度比较均不存在显著性差异(P>0.05),而绝对紫外光谱相似度比较均存在非常显著的差异(P<0.01)。
2.5.3 紫外光谱相似度变化图谱 在200~400 nm波长范围内,以0.5 nm为一个采样点,根据“2.4”项下公式计算每一采样点的紫外光谱相似度值;并以此为纵坐标,以波长为横坐标,分别绘制7 h内5、10、20、30、40℃下注射用丹参的紫外光谱相似度变化图谱,详见图1。
3 讨论
结合紫外光谱相似度值(表5、表6)及方差分析结果可知,温度对注射用丹参的稳定性有一定影响。温度为20℃时的配伍液最稳定,其次依次为30、40、10、5℃时的配伍液。方差分析结果显示,各配伍液相对紫外光谱相似度比较无显著差异,而绝对紫外光谱相似度比较差异显著,表明各配伍液在相邻时间段成分变化不大,但时间跨度长时,药物成分可产生显著变化。

图1 7 h内各温度下注射用丹参紫外光谱相似度变化图谱A.5℃;B.10℃;C.20℃;D.30 ℃;E.40 ℃Fig1 Change map of the similarity of UV spectrum of Danshen for injection under different temperatures in 7 hA.5℃;B.10℃;C.20℃;D.30 ℃;E.40 ℃
从紫外光谱相似度变化图谱可知,紫外光谱相似度的变化在低温时(≤10℃),配伍之初即发生剧烈变化;而在20℃以上时,变化主要发生于配伍后几小时。而且,紫外光谱相似度在低温时所有波长段均产生较大变化;而在20℃以上时,其变化主要发生于310 nm波长段之后。据此推测低温可能对注射用丹参稳定性的影响更大。我院中药注射剂不良反应报告时间大多集中在冬春季节,除了输液温度过低对患者机体产生不良影响外,还可能与低温对中药注射剂稳定性影响较大有关。因此,当环境温度较低时,应尽量避免使用中药注射剂。
从紫外光谱相似度变化图谱可知,所有配伍液的紫外相似度差异最大的波长段均位于310 nm之后,而该波长段所对应的成分并非注射用丹参的“有效成分”。由此可知,“有效成分”并非为引起注射用丹参稳定性变化的主要成分。由于药物在研发过程中着重考虑“有效成分”的稳定性问题,因此“有效成分”已能通过添加各种增溶剂、助溶剂或改变药物分子结构等方式保证其成分的稳定性;但对于中药注射剂中的“杂质”如蛋白质、糖类、鞣质等未能给予足够重视,因此其稳定性难以得到保证。
多数中药注射剂配伍稳定性研究的考察指标为单一的药物“有效成分”,再结合pH值和不溶性微粒变化进行检测。但中药中的多成分可能对pH值有缓冲作用,即使pH值相差较远的药物与中药注射剂配伍后,pH值并没有较大改变;不溶性微粒的测定结果受多种因素的影响[10],包括重复测量、仪器的校准状态、装量差异、实验人员操作带来的不确定度以及实验室的供电电压、温度等。正是由于上述原因,即使配伍后溶液的pH值、药物的“有效成分”含量均无变化,紫外扫描的波峰和波谷位置及波型均无变化,不溶性微粒的增加也无法解释上述试验结果[11~13],也说明不了配伍后药品不良反应增加的原因[14]。使用紫外光谱相似度对中药配伍液进行稳定性考察,可以从紫外光谱特征的差异了解中药化学成分的差异,从而从中医的“整体观”反映微量成分的变化,可作为传统方法考察中药注射剂配伍稳定性的补充。
本试验只是采用紫外光谱相似度的方法对药物配伍条件进行优选。因为没有合适的对照品和相似度的评价阈值,该方法尚不能作为一个技术指标来考察药物是否能够配伍。今后仍需不断完善技术方案和研究内容,使其能作为中药注射剂的有效质量控制方法。
[1]彭六保,黎银波,张郁葱,等.丹参系列注射液与葡萄糖注射液配伍的稳定性考察[J].中国中药杂志,2006,31(20):1 733.
[2]应群芳,徐 冬.复方丹参注射液与临床常用溶媒配伍的稳定性[J].医药导报,2008,27(7):862.
[3]王 维.造成中药注射剂不良反应的原因及预防措施[J].中国医药指南,2009,7(2):63.
[4]李 茵,吕建伟,冯秀芳.紫外光谱相似度考察注射用丹参与6种常用输液的配伍稳定性研究[J].成都中医药大学学报,2009,32(9):85.
[5]孟庆华,王微波,胡育筑.紫外光谱相似度及在中药注射液质控的应用[J].中国中药杂志,2007,32(3):206.
[6]莫志江.紫外吸收光谱加权相关分析法对若干中成药的鉴别[J].中国中药杂志,2007,32(2):116.
[7]杨宇宏.丹参及其制剂的质量标准研究[J].当代医学,2009,15(162):148.
[8]李晓莉,李晓蓉,王丽娟,等.RP-HPLC测定丹芎方中丹参素、阿魏酸、隐丹参酮和丹参酮ⅡA的含量[J].中成药,2008,30(1):77.
[9]任爱农,卢爱玲,田耀洲,等.层次分析法用于中药复方提取工艺的多指标权重研究[J].中国中药杂志,2008,33(4):372.
[10]熊芬霞.丹参注射液的配伍禁忌[J].中国药房,2005,16(3):1 036.
[11]范治云,程春雷,刘 琦,等.对丹参注射液不溶性微粒检查的不确定度的评定[J].中国药事,2008,22(3):235.
[12]张志勇,郑明兰,管 玫,等.复方丹参注射液与右旋糖苷-40葡萄糖注射液的配伍稳定性[J].中国医院药学杂志,2002,22(1):58.
[13]王文彤,袁立友.丹参注射液与黄芪注射液在5%葡萄糖注射液中的配伍稳定性考察[J].天津药学,2003,15(5):6.
[14]吴根生,曹永松.53例复方丹参注射液致过敏性休克文献分析[J].中国药房,2007,18(6):461.
