猪传染性胃肠炎病毒陕西株的分离鉴定
2011-08-07陈光达许信刚童德文
丁 利,陈光达,许信刚,童德文
(西北农林科技大学动物医学院,陕西 杨凌 712100)
猪传染性胃肠炎病毒(TGEV)属于冠状病毒科、冠状病毒属成员,由其引发的猪传染性胃肠炎是猪的一种急性、高度接触性传染病,临床以呕吐、严重腹泻、脱水和对2周龄以内仔猪高度致死率为特征。5周龄以上的猪死亡率较低,成年猪几乎没有死亡,但感染猪生长缓慢,饲料报酬率降低。世界动物卫生组织(OIE)将TGE定为B类传染病,是我国法定重点防控的疫病之一。本病在许多国家和地区广泛流行,经流行病学调查发现,近年来该病在我国的流行呈明显上升趋势,同时亦有病毒的分离报道[1-5]。本试验从陕西省某猪场发病猪只的腹泻粪便等样品中分离到1株猪传染性胃肠炎病毒,命名为TGEV shaanxi株,并对其进行了系统鉴定。
1 材料与方法
1.1 病料和细胞 空肠内容物及腹泻粪便采集于陕西省某疑似感染TGE的猪场,于灭菌生理盐水中冻存,低温运至实验室备用;PK-15细胞由本实验室保存。
1.2 主要试剂 DMEM为Gibco公司产品;胰酶、琼脂糖、RNase A为Sigma公司产品;新生牛血清为 Hyclone公司产品;Taq DNA聚合酶、DL-~DNA Marker、pMD18-T vector,购自大连TaKaRa公司;M-MLV逆转录酶,购自Promega公司;病毒基因组RNA提取试剂盒,购自BioTeke公司;高纯度质粒小量提取试剂盒、DNA凝胶回收纯化试剂盒,购自威格拉斯生物技术有限公司;猪传染性胃肠炎病毒弱毒疫苗,购自中国农业科学院哈尔滨兽医研究所;受体菌DH5α、猪传染性胃肠炎病毒阳性血清由中国动物卫生与流行病中心惠赠。
1.3 方法
1.3.1 病料的处理 解冻TGE病猪的空肠内容物以及腹泻粪样,反复冻融3次后,6000r/min离心5min,收集上清液,上清液经0.22μm孔径细菌滤器除菌后,置-20℃冻存备用。
1.3.2 病毒分离培养 将过滤后的病料上清液1mL接种于单层PK-15细胞,37℃吸附1h,弃上清后加入含2%新生牛血清的DMEM培养液,置37℃,5%CO2培养箱中培养3~5d,观察细胞病变(CPE)。将培养细胞反复冻融3次,取冻融液1mL盲传3~6代进行病毒分离和细胞适应,传至出现较稳定的CPE后收毒,盲传6代未出现CPE则判为阴性。
1.3.3 病毒TCID50的测定 按照参考文献[6]方法进行。
1.3.4 核酸类型鉴定及氯仿试验 按照参考文献[3]方法进行。
1.3.5 病毒中和试验 将TGEV阳性血清进行系列稀释(1∶10、1∶20、1∶40、1∶80、1∶160、1∶320、1∶640、1∶1280),加到96孔反应板中,25μL/孔;将病毒稀释到200TCID50,加入到上述各反应孔中,25μL/孔,37℃作用1h;按常规方法制成细胞悬液,50μL/孔加到上述各孔中,37℃培养,逐日观察并记录CPE。同时设立正常细胞对照、不加血清的病毒液对照、阴性血清对照。
1.3.6 引物设计与合成 根据GenBank中公布的TGEV基因序列,利用计算机辅助软件Premier 5.0设计一对特异性引物,上游引物为P1:5′-ATGGCCAACCAGGGACAAC-3′;下游引物为P2:5′-TGGAGGAAGACGAGCATC-3′),用于扩增1149bp的N基因
1.3.7 病毒RNA 提取和RT-PCR 参照病毒基因组RNA 提取试剂盒说明书从细胞毒中提取总RNA。RT体系:RNA模板2μL、dNTPs 2μL、P22μL,70℃作用5min然后,向体系中加入5×RT Buffer 5μL、RNase inhibitor 0.2μL、M-MLV 0.5 μL、DEPC水9.3μL。37℃孵育60min,95℃10 min,4℃10min。PCR体系:10×PCR Buffer 2.5 μL、dNTPs 2μL、上下游引物(20pmol/μL)各0.5 μL、cDNA 2μL、Taq DNA polymerase 0.2μL、灭菌双蒸水16.3μL。PCR程序为:94℃5min;94℃30s,56℃30s,72℃45s,35个循环;72℃10min。回收PCR产物,将N基因纯化后插入到T载体中,将重组质粒送交南京金斯瑞生物科技公司进行序列测定。
1.3.8 序列分析 应用DNAStar软件对TGEV shaanxi分离株N基因的测序结果与GenBank中已发表的10株TGEV毒株的N基因序列进行核苷酸及氨基酸序列比较分析并绘制系统进化树。
2 结果
2.1 病毒分离培养 初代病毒液接种PK-15细胞60h时CPE不典型,盲传至第3代时细胞出现皱缩、变圆、聚堆等现象。传至第5代时细胞病变达80%,时间稳定在48h~60h,细胞折光性增强,聚集、变圆,形成空斑,逐渐成拉网状病变,最后成片脱落(图1)。

图1 正常PK-15细胞与接毒后60h的PK-15细胞 (100×)
2.2 病毒TCID50及中和试验测定结果 根据TCID50测定数据(表1)可知,使半数细胞出现CPE的病毒稀释度(即TCID50)介于1×10-6~1×10-7之间,按Reed-Muench法得出 TCID50为10-6.68/0.1mL。
利用固定病毒稀释血清法得出,能保护50%细胞的血清稀释度介于1∶320~1∶640之间。根据Reed-Muech氏法计算标准阳性血清的中和效价为1∶431。而分离毒株与阴性血清作用后CPE没有被抑制,阳性血清对细胞毒性试验以及空白试验细胞正常。
2.3 病毒理化试验
2.3.1 病毒核酸类型鉴定 采用BUDR法进行病毒核酸类型鉴别,结果对照组TCID50为10-6.68/0.1 mL,试 验 组 TCID50为 10-6.52/0.1mL,二 者 的TCID50的对数差值小于1,证明病毒的核酸类型为RNA。
2.3.2 氯仿敏感试验 经氯仿处理的病毒液接种96孔细胞培养板,结果对照组TCID50为10-6.68/0.1mL,试验组 TCID50为10-3.84/0.1mL,二者的TCID50的对数差值为2.84,说明该病毒对氯仿敏感。
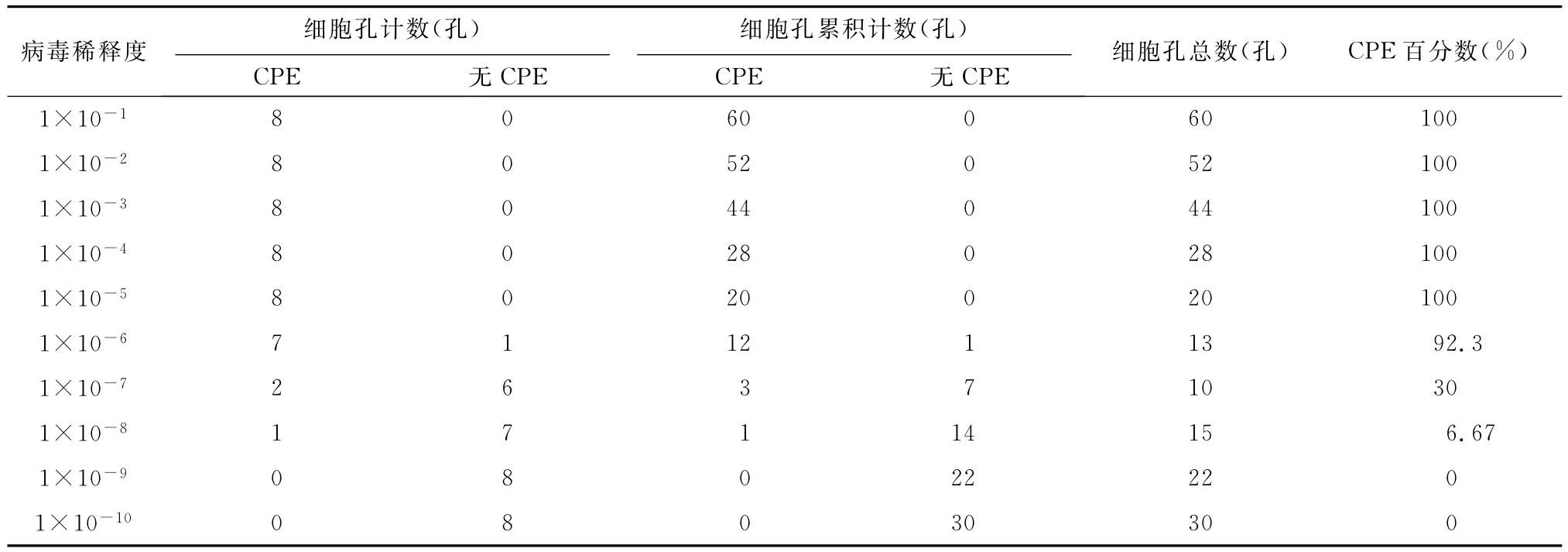
表1 感染TGEV病毒后CPE的出现情况
2.4 分离病毒的RT-PCR鉴定结果 从分离病毒的小肠内容物、病毒细胞培养液和TGEV疫苗毒中均扩增出了约~bp的片段(图2),与预期大小一致。说明该病毒株为TGEV,命名为TGEV shaanxi株。
2.5 序列分析及进化树 将所测的N基因序列与GenBank中已发表的10株TGEV毒株的N基因序列进行同源性比较分析。结果表明,TGEV shaanxi株与其他分离的TGEV株之间的同源性很高,核苷酸同源性为94.3%~98.3%,氨基酸同源性为95.6%~99.4%。系统发生进化树(图3)分析表明,TGEV shaanxi株与HN2002株亲缘关系较近,处于同一分支。
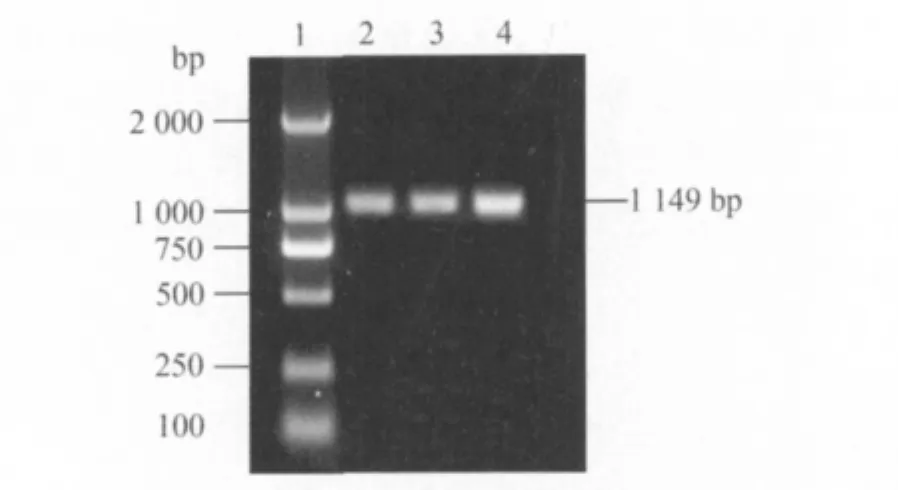
图2 病毒RT-PCR鉴定
3 讨论
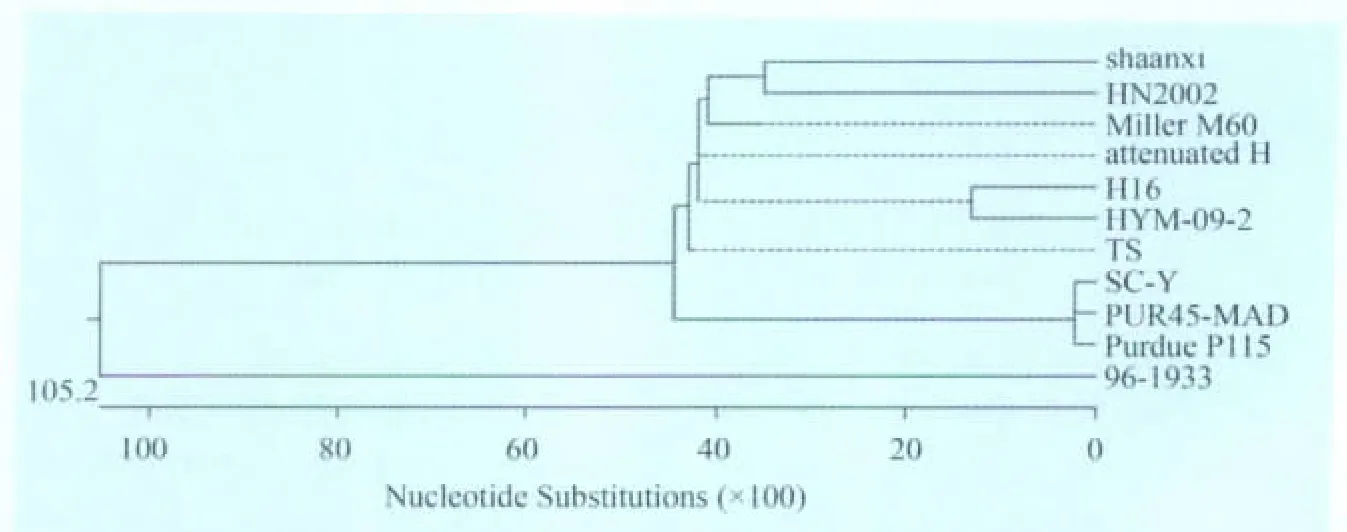
图3 TGEV shaanxi分离株与TGEV参考毒株N基因系统发生进化树分析
TGEV可在多种细胞系如猪睾丸细胞(ST细胞)、猪肾细胞(PK-15细胞、IBRS-2细胞)、猪甲状腺细胞等多种细胞上生长。本试验选用了PK-15细胞进行病毒分离,病毒很快适应PK-15细胞,产生典型的细胞病变:细胞皱缩、聚集、拉网、脱落,胞浆内形成空泡等。随着病毒作用时间的延长,细胞几乎全部脱落。TGEV有4种结构蛋白,分别为纤突糖蛋白(S蛋白)、膜内在蛋白(M蛋白)、核衣壳蛋白(N蛋白)和小膜蛋白(sM蛋白)[7]。其中核衣壳蛋白基因(N)是TGEV主要结构蛋白基因,可与基因组RNA组装成核糖核蛋白复合物掺入病毒粒子中[8-9]。N蛋白不仅在病毒致病性、转录和翻译及增强细胞免疫等方面起到重要作用,而且具有辅助增强病毒RNA复制的能力。比较分离株N基因与GenBank中其他TGEV N基因序列,发现N基因高度保守,核苷酸同源性为94.3%~98.3%,氨基酸同源性为95.6%~99.4%,表明陕西分离株与其他分离的TGEV株之间的同源性很高。系统发生进化树分析表明,TGEV shaanxi株与HN2002株亲缘关系较近,处于同一分支,表明我国不同地区分离毒株的N基因差异不大。
本试验通过病毒分离、细胞培养、核型鉴定、氯仿敏感性试验、RT-PCR鉴定、序列分析等从陕西省发生腹泻的仔猪小肠内容物及腹泻粪便中分离到1株猪传染性胃肠炎病毒,命名为TGEV shaanxi株。测定的病毒TCID50显示该毒株在体外培养增殖性能稳定,病毒滴度高。猪传染性胃肠炎病毒shaanxi株的成功分离对陕西地区该病的病原学研究、流行病学调查、诊断和防制具有重要意义,也为今后开展TGEV流行病学、分子病毒学、疫苗免疫及诊断研究提供有价值的毒株。
[1]黄小波,曹三杰,文心田,等.猪传染性胃肠炎病毒SC-H株的分离与鉴定[J].黑龙江畜牧兽医,2008,8:58-61.
[2]宋振辉,郭万柱.猪传染性胃肠炎病毒的分离鉴定及全基因组序列分析[J].病毒学报,2008,24(5):364-368.
[3]王龙涛,葛晨霞,王翠瑜,等.猪传染性胃肠炎病毒吉林株的分离鉴定及S基因的克隆与序列分析[J].中国兽医学报,2010,30(10):1277-1281.
[4]张莉,翁崇鹏,毛娅卿,等.猪传染性胃肠炎病毒河北分离株核衣壳N蛋白基因的克隆与序列分析[J].中国兽药杂志,2005,39(6):14-17.
[5]何孔旺,林继煌,还红华,等.猪传染性胃肠炎病毒弱毒株STC3细胞培养特性及致病性研究[J].中国兽医科技,2001,31(8):829.
[6]Reed L J,Muench H.A simple method of estimating 50percent end-points[J].Am J Hyg,1938,27:493-497.
[7]Delmas B,Denis R,Go det M,et al.Four major antigenic site of the corona virus transmissible gastroenteritis virus are located on the amino-terminal half of spike glycoprotein S [J].J Gen Virol,1990,71:1313-1323.
[8]Escors D,Ortego J,Laude H,et al.The membrane M protein carboxy terminus binds to transmissible gastroenteritis coronavirus core and contributes to core stability[J].J Virol,2001,75:1312-1324.
[9]Risco C,Anton I M,Enjuanes L,et al.The transmissible gastroenteritis coronavirus contains a spherical core shell consisting of M and N proteins[J].J Virol,1996,70:4773-4777.