红花药材黄色素类成分的HPLC指纹图谱研究Δ
2011-08-06李雪莹武永刚山东中医药高等专科学校烟台市264100
李雪莹,武永刚(山东中医药高等专科学校,烟台市 264100)
红花为菊科植物红花Carthamus tinctoriusL.的管状花,为活血化瘀的主要中药之一,用于治疗冠心病、脑血栓等心脑血管疾病[1]。目前对红花有效部位的研究主要集中在查尔酮类化合物红花黄色素(safflower yellow,SY)上。SY是一种复杂的水溶性混合物,在干花中含量占20%~30%,目前报道的SY类成分中主要有羟基SYA、SYB、SYC、SYA、Safflomin A、Safflomin B、Safflomin C、tinctorimine、precarthamin等,红花的活血化瘀等功能多与这一类化合物有关[2]。笔者通过反相高效液相色谱(RP-HPLC)法建立了红花药材中SY类成分的指纹图谱分析方法,以期为红花的鉴别和质量控制提供依据。
1 仪器与试药
1100型HPLC仪,包括四元梯度泵、DAD紫外检测器(美国Agilent公司)。
乙腈(色谱纯,德国Merck公司);三氟乙酸(分析纯,南开大学精细化学实验厂);甲醇(色谱纯,天津市大茂化学试剂厂);纯净水(杭州娃哈哈集团有限公司,使用前经0.45 μm水系滤膜过滤);羟基SYA对照品(中国药品生物制品检定所,批号:111637-200301);红花为菊科植物红花C.tinctoriusL.的干燥花瓣,由本校张钦德教授鉴定为真品,其商品药材编号S1、S2、S3、S4、S5、S6、S7、S8、S9、S10分别来源于四川、江苏、辽宁、黑龙江、山东、吉林、内蒙古、北京、河南、新疆。
2 方法与结果
2.1 色谱条件
色谱柱:Phenomenex C18(250 mm×4.6 mm,5 μm);柱温:25℃;流速:1.0 mL·min-1;流动相:乙腈(A)-0.01%三氟乙酸溶液(B),梯度洗脱(0~25 min,2%~10%A;25~35 min,10%~15%A;35~65 min,15%~25%A;65~70 min,25%A);分析时间:70 min;检测波长:403 nm;进样量:20 μL。
2.2 供试品溶液的制备
称取红花药材粉末5 g,加12倍量水浸泡30 min,于60℃下温浸1 h,滤过;滤渣再加10倍量水,继续温浸1 h,滤过,合并滤液减压浓缩至提取液含生药1 g·mL-1。加入95%乙醇使含醇量达到80%,醇沉24 h,取续滤液作为供试品溶液。
2.3 对照品溶液的制备
精密称取羟基SYA对照品适量,置50 mL量瓶中,加水溶解并稀释至刻度,制成含羟基SYA0.6 mg·mL-1的对照品溶液。
2.4 方法学考察
2.4.1 精密度试验 取供试品溶液(编号:S10)适量,连续进样6次,按“2.1”项下色谱条件进样测定。结果,各共有峰的相对保留时间和相对峰面积基本没有明显变化,RSD均<3%,表明方法精密度良好,符合指纹图谱技术要求。
2.4.2 稳定性试验 取供试品溶液(编号:S10)适量,分别在配制后0、3、6、9、12和24 h进样,按“2.1”项下色谱条件进样测定。结果,各共有峰相对保留时间的RSD均<0.36%,相对峰面积的RSD均<2.53%,表明供试品溶液在24 h内稳定。
2.4.3 重复性试验 取同一批(编号:S10)红花药材适量,共6份,分别按“2.2”项下方法制备供试品溶液,照“2.1”项下色谱条件进样测定。结果,各色谱峰相对保留时间和相对峰面积的RSD均<3%,表明方法重复性良好。
2.5 指纹图谱及技术参数研究
2.5.1 HPLC指纹图谱分析 取S1~S10号红花药材样品粉末各适量,分别按“2.2”项下方法制备供试品溶液,各取20 μL进样,得到各样品的指纹图谱。采用“中药色谱指纹图谱相似度评价系统(2004A版)”进行色谱峰的匹配和相似度的计算,将10批次样品图谱导入相似度软件,以S10号样品色谱为参照,采用平均计算法,由10批红花药材提取物指纹图谱生成对照指纹图谱(见图1)。以对照指纹图谱为参照,各批样品指纹图谱(见图2)与之进行比较,计算得各批样品指纹图谱相似度值,S1~S10号相似度分别为0.996、0.998、0.995、0.998、0.969、0.995、0.999、0.996、0.999、0.999。所测样品的相似度均在0.9以上,显示10批样品与对照指纹图谱有较高的相似性。

图1 红花药材中SY类成分对照指纹图谱(共有模式)Fig 1 Fingerprints of SY from C.tinctorius(common model)
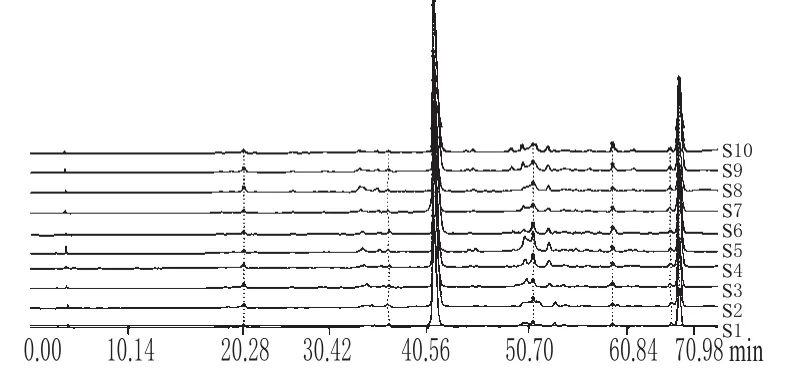
图2 10批次样品的HPLC指纹图谱Fig 2 HPLC fingerprints of 10 batches of samples
由图2可知,所建立的指纹图谱包含8个主要共有峰,占总峰面积的90%以上。再通过图1可确定3号峰为羟基SYA,含量达到了50%以上,峰面积最大,出峰时间适中,与相邻色谱峰分离良好,被选作参照峰;4号峰表现为多个小峰组成的宽峰,峰形常有变化;7、8号峰未完全分开;其他峰分离较好。2.5.2 不同产地药材指纹图谱比较 相对保留值系统将波动较大的绝对值变为稳定性较好的相对保留值,将整个比较系统处于同一尺度范围内进行比较,提高了样品间的可比性和比较结果的可信性。以图1中3号峰为参照峰,计算各样品指纹图谱中各色谱峰的相对保留时间和相对峰面积。从10个样品指纹图谱分析结果可知,8个共有峰相对保留时间一致,但不同样品相对峰面积的比值相差较大。红花药材中SY类成分共有峰的相对保留时间和相对峰面积分别见表1和表2。
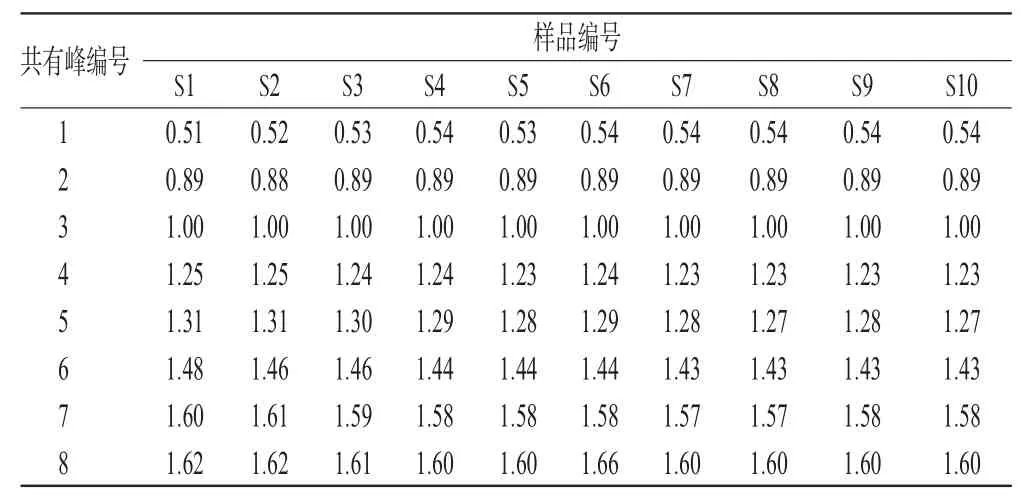
表1 红花药材中SY类成分共有峰的相对保留时间Tab 1 Relative retention time of common peaks of SY from C.tinctorius
3 讨论
3.1 色谱条件的优化
本试验采用RP-HPLC法作为测定红花药材中SY类成分指纹图谱的方法,重复性、稳定性、精密度均较高。由于SY类成分复杂,单一流动相无法达到很好的分离效果,故采用梯度洗脱方式;黄酮类成分含有多个酚羟基,呈弱酸性,故使用酸性缓冲系统;参考相关文献[3],对不同组成的流动相系统进行了梯度洗脱试验,结果发现当使用乙腈时,基线漂移现象较甲醇轻;对流动相中酸的考察包括:甲酸、乙酸、磷酸、三氟乙酸,结果显示使用三氟乙酸能更好地改善峰形和分离度。在整个分析时间段(70 min)内,各色谱峰达到很好的分离效果且相对保留时间稳定,有利于指纹图谱的分析。
在波长为403 nm时,SY类化合物有最大吸收[4],所得色谱峰总峰面积较大、分离度较好,故选取403 nm作为检测波长。
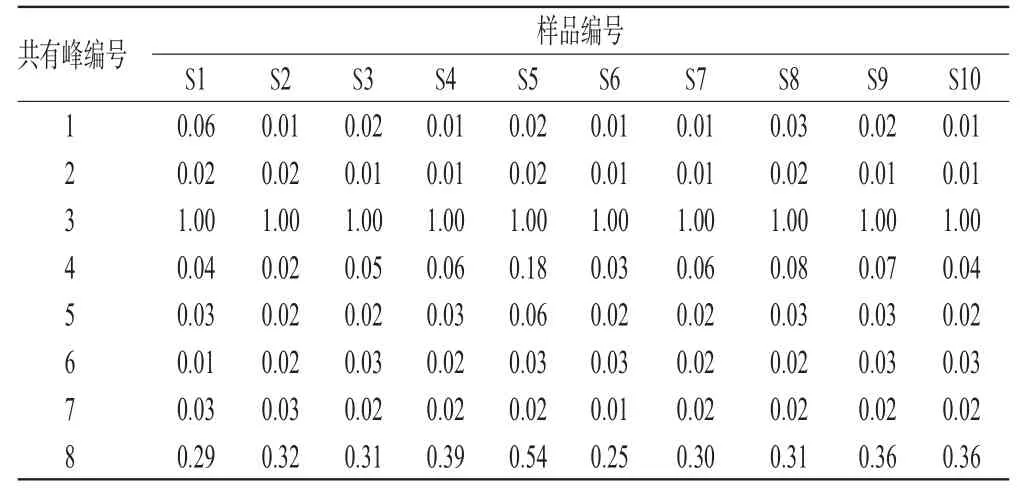
表2 红花药材中SY类成分共有峰的相对峰面积Tab 2 Relative peak areas of common peaks of SY from C.tinctorius
3.2 提取条件的选择
提取工艺是影响指纹图谱、反映药材内在化学成分的重要因素之一。本试验以总黄色素和羟基SYA的含量为考察指标进行提取溶剂和提取方法的选择。为了使SY类成分提取完全,根据红花所含成分的性质,采用不同极性的溶剂(纯水和不同浓度的乙醇)和不同的提取方式(温浸、超声和回流)进行提取[5],并对提取时间进行了单因素试验。结果发现,随着乙醇浓度的增加,SY在提取液中的质量浓度反而降低,且乙醇提取带进的脂溶性杂质较多,因此选择以水作为提取溶剂、60℃下温浸为SY的最佳提取方法;单次提取时间应控制在1 h以内;采取醇沉法以除去水提液中蛋白质、多糖等影响测定的干扰性成分,效果较好。
3.3 不同产地药材指纹图谱相似度评价
由本试验结果可得,10批不同产地来源的红花药材SY类成分的指纹图谱面貌基本一致,相似度良好(r>0.90),说明不同产地红花药材的SY类成分化学组成一致性较好,质量稳定,可以用来作定性鉴别。但各组分相对含量仍有一定的差异,其中变化较大的为来自于山东的红花药材SY类成分指纹图谱(对应于表2中S5号数据),可以看出差异主要集中在4号和8号峰的峰形及其相对保留值上。
3.4 小结
本方法稳定、可靠、重复性好,可为SY类成分的品质评价和质量控制提供科学依据。SY是一种复杂的水溶性混合物,由于对水溶性部位的成分研究有一定的难度,加之其成分有些不稳定,较难获得单体化合物,故本试验只指认了羟基SYA的色谱峰,其他峰有待进一步研究确定其归属;同时,如果将药理数据与指纹图谱数据相结合,建立谱效关联,可进一步优化指纹图谱,提高红花质量控制的针对性。
[1] 廖 晖,郝一彬.红花注射液对急性心肌缺血大鼠的保护作用及机理探讨[J].中国药房,2003,14(5):269.
[2] 姜建双.红花化学成分及生物活性研究[D].北京:中国医学科学院,2008.
[3] Fan L,Zhao HY,Xu M,et al.Qualitative evaluation and quantitative determination of 10 major active components inCarthamus tinctoriusL.by high-performance liquid chromatography coupled with diode array detector[J].J Chromatogr A,2009,1 216(11):2 063.
[4] 高梓真,夏小艳,黄秋月,等.超声法提取红花中红花黄色素的工艺研究[J].哈尔滨医科大学学报,2008,42(6):560.
[5] 周平兰,夏新华.红花黄色素提取工艺的研究[J].湖南中医学院学报,2004,24(1):11.