人CCL21基因克隆及其序列分析
2011-08-04刘长王莹
刘长王莹 崔 凯 李 胜*
(1 临沂大学商学院,山东 临沂 276000;2 山东省肿瘤防治研究院,山东 济南 250117)
次级淋巴组织趋化因子(secondary lymphoid tissue chemokine,SLC)属于CC亚族趋化因子,即CCL21,是由Nagria[1]在人基因表达序列标签(expressed sequence tag,EST)数据库中克隆出的趋化因子,CCL21的基因定位于9p13,其cDNA序列包括847个碱基,由4个外显子和3个内含子组成,其分子量约为14KD,由134个氨基酸残基组成,其中23个氨基酸残基为信号肽序列,111个氨基酸的成熟肽含有4个半胱氨酸残基,与其他人类CC型趋化因子有21%~33%的同源性,但有其独特的约30个氨基酸组成的羧基末端延伸,该延伸内包含2个半胱氨酸残基。CCL21主要存在于外周次级淋巴组织,如脾、淋巴结等部位,它具有较强的趋化作用,特别是对树突状细胞,T细胞与自然杀伤细胞,能使其聚集到外周淋巴组织或器官,而外周淋巴组织是免疫应答发生的初始部位。Campebell等[2]研究证实:在流动状态下CCL21能诱导循环T细胞快速粘附到高内皮小静脉(high endothelial venules,HEV)上,参与淋巴细胞和树突状细胞(dendritic cell,DCs)的归巢和迁移。CCR7是CCL21的高亲合力受体,CCL21具有种属特异性,人CCL21只与CCR7相结合,而小鼠CCL21不仅与CCR7也与CXCR3结合[3]。为进一步探索CCL21在肿瘤基因治疗中的应用,本实验中我们成功克隆了人CCL21基因并进行了序列分析。
1 材料与方法
1.1 淋巴结组织及质粒、菌种
胃癌患者手术清扫下来的新鲜淋巴结组织取自山东大学附属齐鲁医院,经患者家属同意后收集进行实验;pEASY-T1 simple cloning kit购自北京全式金生物技术有限公司;Trans109化学感受态细胞购自北京全式金生物技术有限公司。
1.2 主要仪器和设备
YJ-1450D 型医用净化工作台;ABI PRISM 3100-Avant Genetic Analyzer全自动DNA测序仪;TGL-18R高速低温离心机;PB303-电子精密天平;ABI 9700 PCR仪;WH-1微型漩涡混合仪;移液器2μl、10μl、20μl、100μl、200μl、1000μl;-20℃低温冰箱;DYY-皿型电泳装置等。
1.3 主要试剂
Trizol试剂购自Invitrogen公司;逆转录酶、TaqDNA聚合酶、XbaⅠ、NotⅠ内切酶购于大连宝生物工程有限公司(TAKARA产品);T4 DNA连接酶、DNA marker、质粒DNA小提试剂盒购于北京天根生物技术公司;胶回收试剂盒均系MBI fermenters公司产品;酵母提取物、蛋白胨和琼脂糖均购于英国OXOID公司。
1.4 引物设计及合成
CCL21引物设计:应用primer 5.0软件设计引物,由上海生物工程有限公司合成。
上游引物:5’-GCtctagaatggctcagtcactggctct-3’;下游引物:5’-ATATgcggccgcctatggccctttaggggtctgt-3’。
1.5 总RNA的提取及浓度测定
取新鲜淋巴结组织约100mg,采用Trizol法提取总RNA,以随机六聚体为引物合成cDNA,以此cDNA为模板,以P1、P2为引物,先94℃预变性5min,再以94℃ 45s,48℃ 45s,72℃ 1min 进行35个循环,最后72℃延伸7min。以此次PCR产物为模板,以P1、P2为引物,先94℃预变性5min,再以94℃ 45s,58℃ 45s,72℃1min进行30个循环,最后72℃延伸7min。1%的琼脂糖凝胶电泳分离分析PCR产物,用胶回收试剂盒纯化回收扩增的目的基因。
1.6 基因克隆及测序
将纯化回收PCR片段与克隆载体pEASY-T1按摩尔数5∶1加入连接反应体系内,室温连接4h后转化Trans109感受态,37℃培养过夜,挑取菌落PCR阳性的单个菌落于LB+Amp的培养液37℃振荡培养过夜,小量提取质粒DNA,经XbaⅠ、NotⅠ双酶切初步鉴定后,由本室采用ABI PRISM 3100-Avant Genetic Analyzer全自动DNA测序仪完成测序。
2 实验结果与分析
2.1 人CCL21基因克隆
从淋巴结组织中提取RNA,经逆转录获得cDNA,以此为模板及上下游引物进行PCR扩增,扩增产物经1.5%琼脂糖凝胶电泳显示扩增片段约425bp,与目的基因大小相符(图1)。
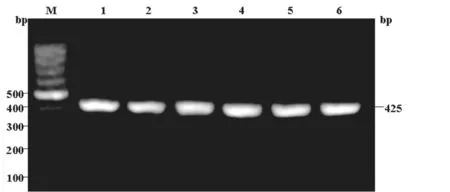
图1 人CCL21基因的PCR扩增
(附:CCL21基因序列:GCTCTAGAATGGCTCAGTCACTGGC TCTGAGCCTCCTTATCTTGGTTCTGGCCTTTGGCATCCCCAGGAC CCAAGGCAGTGATGGAGGGGCTCAGGACTGTTGCCTCAAGTAC AGCCAAAGGAAGATTCCCGCCAAGGTTGTCCGCAGCTACCGGA AGCAGGAACCAAGCTTAGGCTGCTCCATCCCAGCTATCCTGTTC TTGCCCCGCAAGCGCTCTCAGGCAGAGCTATGTGCAGACCCAAA GGAGCTCTGGGTGCAGCAGCTGATGCAGCATCTGGACAAGACAC CATCCCCACAGAAACCAGCCCAGGGCTGCAGGAAGGACAGGGG GGCCTCCAAGACTGGCAAGAAAGGAAAGGGCTCCAAAGGCTGC AAGAGGACTGAGCGGTCACAGACCCCTAAAGGGCCATAGGCGG CCGCATAT)
2.2 琼脂糖电泳双酶切鉴定
重组质粒pEASY-T1-CCL21用限制性内切酶XbaⅠ与NotⅠ双酶切,鉴定插入目的片段。由于所选用的pEASY-T1 simple cloning vector是不带任何酶切位点的克隆载体,所以不管目的片段插入方向如何,双酶切后只得到一种结果,一条位于约425bp条带,一条位于约3900bp处(图2)。
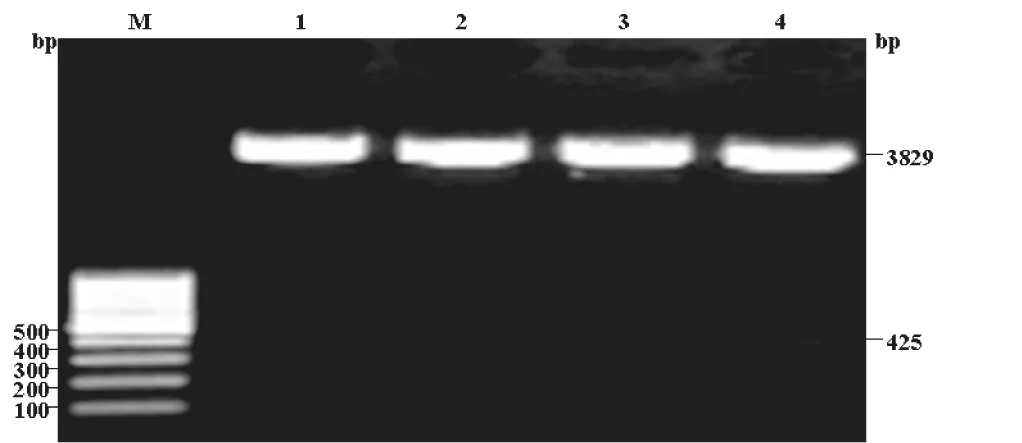
图2 质粒pEASY-T1-CCL21的酶切鉴定
2.3 重组质粒的序列分析
将酶切鉴定阳性含目的基因的菌液保存,并送于上海博尚生物技术有限公司进行序列分析(图3),结果显示获得的目的基因序列与基因库中CCL21基因序列一致,说明成功克隆出CCL21基因片段。
3 讨 论
图3 pEASY-T1 simple-CCL21质粒构建后测序结果
本研究采用的是基因克隆技术,基因克隆(gene cloning)是20世纪70年代发展起来的一项具有革命性的研究技术,可概括为:分、切、连、转、选。“分”是指分离制备合格的待操作的DNA,包括作为运载体的DNA和欲克隆的目的DNA;“切”是指用序列特异的限制性内切酶切开载体DNA,或者切出目的基因;“连”是指用DNA连接酶将目的DNA同载体DNA连接起来,形成重组的DNA分子;“转”是指通过特殊的方法将重组的DNA分子送入宿主细胞中进行复制和扩增;“选”则是从宿主群体中挑选出携带有重组DNA分子的个体。基因工程技术的两个最基本的特点是分子水平上的操作和细胞水平上的表达,而分子水平上的操作即是体外重组的过程,实际上是利用工具酶对DNA分子进行“外科手术”。Berg等[4]于1972年把一种猿猴病毒的DNA与λ噬菌体DNA用同一种限制性内切酶切割后,再用DNA连接酶把这两种DNA分子连接起来,于是产生了一种新的重组DNA分子,从此产生了基因克隆技术。一般来说,基因克隆技术包括把来自不同生物的基因同有自主复制能力的载体DNA在体外人工连接,构建成新的重组DNA,然后送入受体生物中去表达,从而产生遗传物质和状态的转移和重新组合。因此基因克隆技术又称为分子克隆、基因的无性繁殖、基因操作、重组DNA技术以及基因工程等。本实验选用T-Vector法基因克隆,因Taq DNA酶扩增的PCR产物,其DNA双链前后末端都有一个游离的A碱基,而pEASY-T1 simple cloning Vector末端游离的T碱基与其互补形成环状重组T质粒。
许多研究表明,CCL21/CCR7轴在多种肿瘤的播散和器官特异性转移中发挥着重要的作用[5-12]。CCL21通过趋化T细胞、DC、NK细胞,介导T细胞、NK细胞依赖的抗肿瘤免疫应答,分泌IFN-γ、TNF-α、GM-CSF、IL-12等细胞因子,改善肿瘤微环境,促进全身的细胞免疫应答,抵抗肿瘤细胞分泌的免疫抑制因子导致的免疫逃避,促进血管抑制性因子的分泌来抑制血管生成以及诱导肿瘤细胞的凋亡等来发挥抗肿瘤免疫效应。但CCL21/CCR7相互作用具有双向效应,可促进肿瘤细胞分泌蛋白水解酶,加快肿瘤细胞的侵袭转移,导致肿瘤进一步发展;因此,深入探析CCL21/CCR7与肿瘤侵袭转移作用机制,阻断其不利效应,为CCL21成为肿瘤生物治疗和免疫治疗新靶点提供全面保障。
综上所述,利用PCR技术获得目的基因片段CCL21,将其插入pEASY-T1 simple cloning vector,行酶切鉴定及目的基因序列分析,所获得的人CCL21基因序列与GenBank报道的人CCL21序列一致。我们成功克隆了人CCL21基因,为下一步实验研究奠定了基础。
[1]Nigira M,Imai T,Hieshima K,et al.Molecular cloning of a novel human CC chemokine secondary lymphoid-tissue chemokine that is a potent chemo-attractant for lymphocytes and mapped to chromosome 9p13[J].J Biol Chem,1997,272(31):19518-19524.
[2]Campbell JJ,Hedrick J,Zlotnik A,et al.Chemokines and the arrest of lymphocytes rolling under fl ow conditions[J].Science,1998,279(5349):381-384.
[3]Soto H,Wang W,Strieter R,et al.The CC chemokine 6Ckine binds the CXC chemokine receptor CXCR3[J].Proc Natl Acad Sci USA,1998,95(14):8205-8210.
[4]Morrow JF,Berg P.Cleavage of Simian virus 40 DNA at a unique site by a bacterial restriction enzyme[J].Proc Natl Acad Sci U S A.1972,69(11):3365-3369.
[5]Muller A,Homey B,Soto H,et al.Involvement of chemokine receptors in breast cancer metastasis[J].Nature,2001,410(6824):50-56.
[6]Mashino K,Sadanaqa N,Yamaquchi H,et al.Expression of chemokine receptor CCR7 is associated with lymph node metastasis of gastric carcinoma[J].Cancer Res,2002,62(10):2937-2941.
[7]Nakata B,Fukunaga S,Noda E,et al.Chemokine receptor CCR7 expression correlates with lymph node metastasis in pancreatic cancer[J].Oncology,2008,74(1/2):69-75.
[8]Mumtaz M,Wågsäter D,Löfgren S,et al.Decreased expression of the hemokine CCL21 in human colorectal adenocarcinomas[J].Oncol Rep,2009,21(1):153-158.
[9]Sancho M,Vieira JM,Casalou C,et al.Expression and function of the chemokine receptor CCR7 in thyroid carcinomas[J].J Endocri nol,2006,191(1):229-238.
[10]Yousefieh N,Hahto SM,Stephens AL,et al.Regulated Expression of CCL21 in the Prostate Tumor Microenvironment Inhibits Tumor Growth and Metastasis in an Orthotopic Model of Prostate Cancer[J].Cancer Microenviron,2009,2(1):59-67.
[11]Takeuchi H,FujimotoA,Tanaka M,et al.CCL21 chemokine regulates chemokine receptor CCR7 bearing malignant melanoma cells[J].Clin Cancer Res,2004,10(7):2351-2358.
[12]Shields JD,Kourtis IC,Tomei AA,et al.Induction of lymphoidlike stroma and immune escape by tumors that express the chemokine CCL21[J].Science,2010,328(5979):749-52.
