牛磺酸对弥漫性脑创伤大鼠脑葡萄糖转运体表达的影响*
2011-08-02李新娟李晓娟姜洪波李东亮
李新娟, 李晓娟, 姜洪波, 李东亮△
(新乡医学院1生理学与神经生物学教研室,2第三附属医院神经内科,河南 新乡 453003)
弥漫性脑创伤(diffuse brain injury,DBI)发生率和致残率较高,严重危害着人们的生命与生活,但目前对其治疗尚无特效方法。近年来研究发现,DBI后可引起缺血缺氧[1],缺血缺氧导致脑内代谢异常乃至能量衰竭,是引起脑神经元损伤坏死的重要原因,因此在DBI后缺血缺氧条件下神经元能否从细胞外获得足够的能量是其能否生存的关键。脑组织对血液中葡萄糖的持续供应具有依赖性,而血液中的葡萄糖通过血-脑屏障进入脑组织需要相应的运载工具,即葡萄糖转运体(glucose transporter,GLUT)来完成[2],故GLUT在脑组织糖代谢及能量代谢过程中的作用显得极其重要。
牛磺酸(taurine,Tau)为人体条件性必需氨基酸,已有实验证实牛磺酸具有神经保护作用[3]。本课题前期研究发现牛磺酸可通过下调DBI大鼠脑皮层基质金属蛋白酶3的表达发挥对DBI的保护作用[4]。但关于牛磺酸对DBI大鼠脑GLUT的影响国内外尚未见报道,值得探讨。本研究通过观察牛磺酸对DBI大鼠脑葡萄糖转运体1(glucose transporter 1,GLUT1)和葡萄糖转运体3(glucose transporter 3,GLUT3)蛋白表达和大脑病理形态学的影响,探讨牛磺酸脑保护作用的可能机制,为更好地预防与治疗DBI提供理论和实验依据。
材料和方法
1 材料
1.1 主要试剂 牛磺酸购自Sigma,羊抗鼠55kD的GLUT1和GLUT3多克隆抗体购自Santa Cruz,免疫组化检测试剂盒、碱性磷酸酶标记兔抗山羊IgG购自北京中杉金桥生物技术有限公司,预染低分子量蛋白质marker购自北京索莱宝科技有限公司。
1.2 动物 雄性Sprague-Dawley大鼠64只,体重280-320 g,由新乡医学院实验动物中心提供。
2 方法
2.1 动物分组与给药方法 SD雄性大鼠随机分为假手术组、脑创伤组和低、高剂量牛磺酸组,每组16只。各组随机分为2个亚组,每亚组8只,一亚组作免疫组织化学测定,另一亚组作Western blotting和透射电镜观察。实验前7 d各组分别给药,低剂量牛磺酸组给予牛磺酸 200 mg·kg-1·d-1,ig;高剂量牛磺酸组给予牛磺酸 300 mg·kg-1·d-1,ig;假手术组和脑创伤组给予 6 mL·kg-1·d-1生理盐水,ig。
2.2 模型的制备 实验的第8 d,按照 Marmarou等[5]的方法制备DBI模型,致伤前0.5 h注射阿托品(0.1 mg/kg,ip),3%戊巴比妥钠(30 mg/kg,ip)麻醉动物,沿头部中线矢状切开头皮约15 mm,剥离骨膜显露冠状缝及人字缝,将直径10 mm、厚3 mm的不锈钢垫片固定在大鼠冠状缝与人字缝之间正中。待大鼠将要苏醒时,将大鼠俯卧位固定于海棉致伤床上,置于致伤架下,用重450 g、直径18 mm的铜棒从75 cm高度的垂直玻璃落体管自由落下,击中垫片后迅速移开大鼠,取出垫片,消毒、缝合。假手术组仅麻醉、切皮、固定垫片、取出垫片、消毒及缝合,但不致伤。脑创伤后24 h进行以下操作。
2.3 脑GLUT蛋白免疫组织化学检测 4%多聚甲醛灌注后取脑、固定、脱水、二甲苯透明,常规石蜡包埋,冠状连续切片,片厚5 μm,置4℃冰箱保存备用。采用非生物素二步法免疫组织化学技术,常规脱蜡水化,微波修复,3%过氧化氢阻断内源性过氧化物酶20 min,I抗4℃过夜,II抗37℃30 min,底物用二氨基联苯胺显色,中性树胶封片,光镜下观察。
2.4 脑GLUT蛋白Western blotting检测 大鼠深度麻醉后处死,迅速断头取脑,去除嗅脑、小脑和低位脑干,沿失状缝平分脑组织,一半迅速-70℃冰箱保存备用,另一半做电镜观察。脑组织蛋白抽提后,Bradford法测定蛋白浓度,加入等体积的6×SDS上样缓冲液煮沸5 min,以40 μg/well加样经5%积层胶后进行10%分离胶SDS-PAGE电泳,在4℃冰箱内,用45 mV电压使样品跑至分离胶后,用90 mV电压电泳至溴酚兰距离底线1 cm左右。电泳后在4℃冰箱内,用190 mA电流进行电转移20 h。取出硝酸纤维素膜,封闭后加GLUT1(1∶500稀释)或GLUT3(1∶500稀释)37℃振摇孵育1.5 h,碱性磷酸酶标记的兔抗羊II抗(1∶1000稀释)37℃振摇1 h;用现配制的含 16.5 μL BCIP、33 μL NBT 和碱性磷酸酶缓冲液5 mL的显色液,37℃避光显色3-5 min,至目的条带出现;自来水冲洗终止显色,吸水纸吸干硝酸纤维素膜上水分,避光干燥保存,1周内照相。Band-Scan 5.0凝胶图像处理软件进行蛋白灰度分析,各组GLUT1和GLUT3条带灰度值与β-actin蛋白条带灰度值的比值为相对灰度值(relative gray),分别代表各组GLUT1和GLUT3的相对表达量。
2.5 电镜观察 每组各取3只大鼠,脑切片用H-7500透射电子显微镜观察大脑皮层病理形态学改变。
3 统计学处理
结 果
1 GLUT免疫组织化学结果
各组脑组织中均可见有GLUT1表达的阳性细胞,其表现为在微血管内皮细胞胞浆或胞膜呈棕黄色。假手术组和脑创伤组大脑皮层可见少量GLUT1阳性细胞表达,见图1A、B;低、高剂量牛磺酸组大脑皮层GLUT1阳性细胞表达增多,见图1C、D。
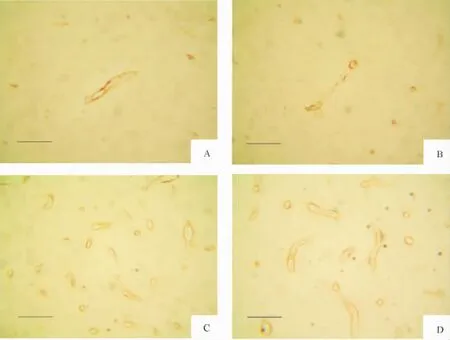
Figure 1.The immunohistochemistry result of GLUT1 expression in cerebral cortex of rats with DBI(×400).A:sham -operated group;B:DBI group;C:low-dose taurine(200 mg/kg)group;D:high-dose taurine(300 mg/kg)group.Scale:30 μm.图1 DBI大鼠大脑皮层GLUT1免疫组织化学结果
各组仅在第三脑室周围可见GLUT3表达的阳性神经元,阳性细胞胞浆或胞膜呈棕黄色。假手术组可见少量GLUT3阳性细胞表达,见图2A;脑创伤组GLUT3阳性表达增多,见图2B;高、低剂量组GLUT3阳性表达强于脑创伤组,见图2C、D。
2 牛磺酸对DBI大鼠脑GLUT表达的影响
Western blotting电泳条带灰度分析结果显示,与假手术组相比,脑创伤组大鼠脑GLUT1蛋白表达无显著差异(P>0.05);与脑创伤组相比,低、高剂量牛磺酸组脑GLUT1蛋白表达显著增多(P<0.01);且低剂量牛磺酸组脑GLUT1蛋白表达显著高于高剂量牛磺酸组(P<0.05),见图3。
与假手术组相比,脑创伤组大鼠脑GLUT3蛋白表达显著增多(P<0.01);与脑创伤组相比,低、高剂量牛磺酸组脑GLUT3蛋白表达显著增多(P<0.01);且高剂量牛磺酸组脑GLUT3蛋白表达显著高于低剂量牛磺酸组(P<0.01),见图4。
3 牛磺酸对DBI大鼠大脑皮层病理形态学的影响
透射电镜结果显示:假手术组大脑皮层神经元超微结构未见明显异常,见图5A;脑创伤组大脑皮层神经元胞质内粗面内质网扩张,线粒体肿胀、嵴混乱或断裂,可见线粒体空泡化,偶见线粒体膜破裂、消失,细胞器数量减少,胞核异染色质边集,见图5B;牛磺酸能明显改善创伤脑组织病理改变,且低剂量牛磺酸组改善明显。电镜结果显示低剂量牛磺酸组大脑皮层神经元胞质内偶见线粒体嵴肿胀和粗面内质网扩张,胞核内异染色质仅有小部分边集,见图5C;高剂量组大脑皮层神经元胞质内偶见线粒体髓样变性和粗面内质网扩张,胞核内异染色质有小部分边集,见图5D。
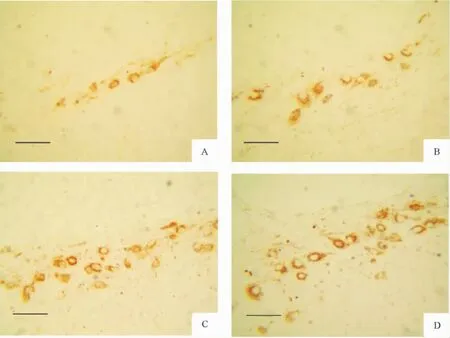
Figure 2.The immunohistochemistry result of GLUT3 expression in the periphery of the third ventricle of rats with DBI(×400).A:sham-operated group;B:DBI group;C:low-dose taurine(200 mg/kg)group;D:high-dose taurine(300 mg/kg)group.Scale:30 μm.图2 DBI大鼠第三脑室周围GLUT3免疫组织化学结果
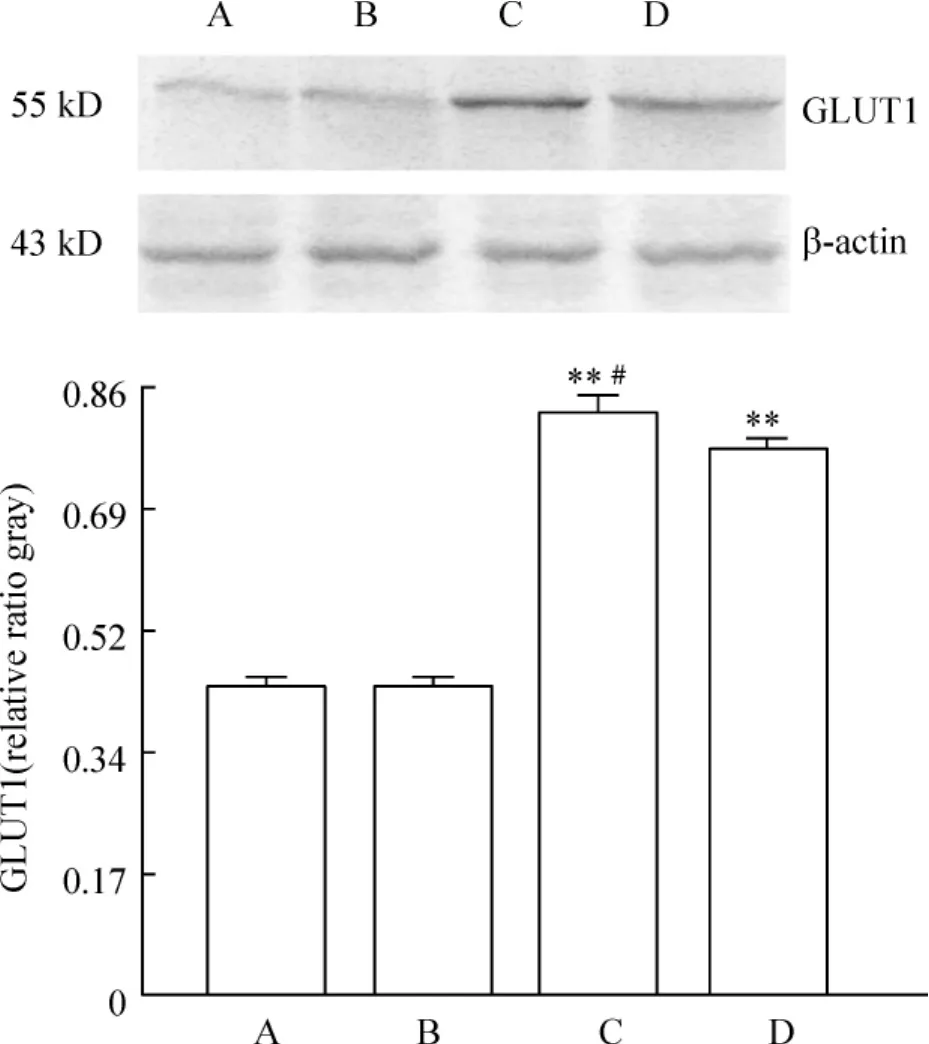
Figure 3.Effects of taurine on GLUT1 expression in the brain of rats with DBI.A:sham -operated group;B:DBI group;C:low-dose taurine(200 mg/kg)group;D:high-dose taurine(300 mg/kg)group..n=8.**P <0.01 vs B group;#P <0.05 vs D group.图3 牛磺酸对DBI大鼠脑GLUT1表达的影响
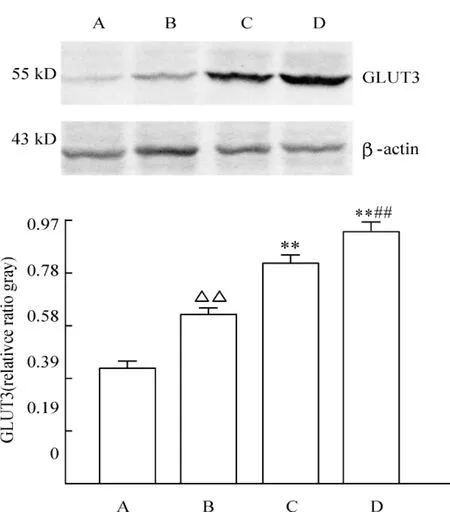
Figure 4.Effects of taurine on GLUT3 expression in the brain of rats with DBI.A:sham -operated group;B:DBI group;C:low-dose taurine(200 mg/kg)group;D:high-dose taurine(300 mg/kg)group..n=8.**P<0.01 vs B group;##P <0.01 vs C group.△△P <0.01 vs A group.图4 牛磺酸对DBI大鼠脑GLUT3表达的影响
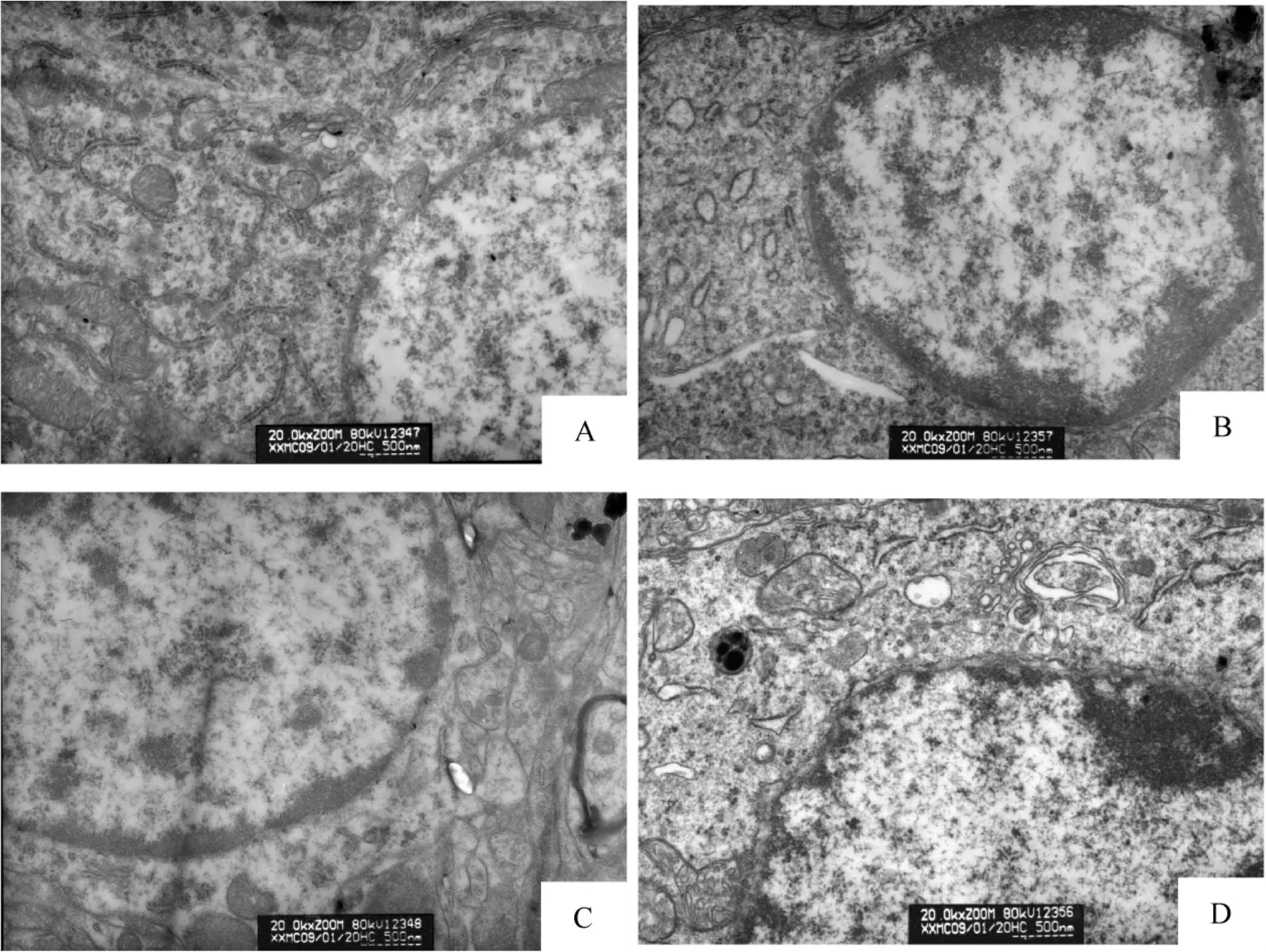
Figure 5.Ultrastructure changes of cortical neurons in DBI rats(×20000).A:sham-operated group;B:DBI group;C:lowdose taurine(200 mg/kg)group;D:high-dose taurine(300 mg/kg)group.图5 DBI大鼠大脑皮层神经元超微结构的变化
讨 论
脑的生化特点决定脑组织对血液中葡萄糖的持续供应具有依赖性,而葡萄糖须在葡萄糖转运体介导下通过易化扩散进入脑组织[2],脑组织中的葡萄糖转运体主要是GLUT1和GLUT3,GLUT1主要分布在构成血-脑屏障的内皮细胞上,负责将葡萄糖从血液中跨血-脑屏障转运至脑细胞外间隙;GLUT3又称神经元葡萄糖转运体,主要分布在神经元胞膜上,负责将葡萄糖从细胞外间隙转运至神经元内[6]。因此在脑组织的糖代谢及能量供给过程中GLUT1和GLUT3的作用显得尤为重要。
本实验结果显示,各组脑组织中均可见有GLUT1表达的阳性细胞,其表现为在微血管内皮细胞胞浆或胞膜呈棕黄色;各组仅在第三脑室周围可见GLUT3表达的阳性神经元。其中假手术组脑组织可见少量GLUT1和GLUT3蛋白表达;与假手术组相比较,脑创伤组GLUT1蛋白表达未明显增加,但GLUT3表达显著增加,与Hamlin等[7]建立大鼠DBI模型实验中得到的结果相一致。实验结果提示大鼠DBI后葡萄糖从血液循环转运至脑细胞外间隙的量与假手术组相比并未增加,而转运至细胞外间隙的葡萄糖由于DBI后缺血缺氧仅能以无氧酵解的形式供应能量,所供应的能量远少于正常脑组织,因此创伤后脑内能量物质匮乏;而脑创伤组GLUT3表达增多可能认为是脑创伤后神经元急性防御反应的一部分,又反映了DBI后神经元对葡萄糖的利用需求增多,GLUT3表达增多可能使更多的葡萄糖从脑细胞外间隙转运至神经元内,增强葡萄糖摄取[8],进而促使神经元能量代谢的恢复。总之,脑创伤后脑内能量物质匮乏,且脑创伤后神经元对能量的需求增加,而能量物质匮乏是引起脑神经元损伤坏死的重要原因。因此在DBI后缺血缺氧条件下脑组织能否从细胞外获得足够的葡萄糖是其能否生存的关键。
牛磺酸是一种内源性氨基酸,在神经、血管平滑肌和骨骼肌的可兴奋组织中含量最丰富,具有抗兴奋性神经毒性、抗自由基、稳定细胞膜等多方面的神经保护作用[9,10]。本实验结果显示,低、高剂量牛磺酸组脑GLUT1和GLUT3蛋白表达较脑创伤组显著增加,且低剂量牛磺酸组GLUT1表达显著高于高剂量牛磺酸组,而高剂量组GLUT3蛋白表达显著高于低剂量组,结果表明牛磺酸可使大鼠脑创伤后脑GLUT1和 GLUT3蛋白表达增加,且 GLUT1和GLUT3可能对牛磺酸剂量的敏感性不一样,其最佳剂量有待进一步研究。Sharp等[11]研究表明GLUT1表达增加有利于葡萄糖从血液经血-脑屏障转运入脑细胞外间隙,促使脑内葡萄糖水平增加,而较高的葡萄糖储备是增加脑内ATP合成的前提条件,对于维持脑组织能量供给,延迟能量衰竭引起的级联反应有重要意义;Vannucci等[12]研究认为GLUT3表达升高可增加神经元对葡萄糖的摄入,有助于恢复神经元的能量代谢,对脑组织有保护作用;另外本实验结果还发现牛磺酸能明显改善DBI大鼠脑组织病理改变,这些强烈提示牛磺酸可对DBI大鼠发挥脑保护作用,其机制可能是上调GLUT1和GLUT3蛋白表达,维持脑组织的能量供给。在本研究的基础上,探讨牛磺酸对DBI脑组织葡萄糖摄取率的影响,进一步证明牛磺酸脑保护作用是否与葡萄糖摄取率有关,还待于进一步实验来探讨。
[1]杨治权,马建荣,王君宇,等.弥漫性脑损伤后脑缺血的实验研究[J].中华创伤杂志,2004,20(4):226-229.
[2]McEwen BS,Reagan LP.Glucose transporter expression in the central nervous system:relationship to synaptic function[J].Eur J Pharmacol,2004,490(1 -3):13 -24.
[3]Ricci L,Valoti M,Sgaragli G,et al.Protection by taurine of rat brain cortical slices against oxygen glucose deprivation- and reoxygenation - induced damage[J].Eur JPharmacol,2009,621(1-3):26-32.
[4]李雪姣,李新强,李新娟,等.牛磺酸对弥漫性脑损伤大鼠脑皮层基质金属蛋白酶3表达的影响[J].新乡医学院学报,2010,27(2):123-126.
[5]Marmarou A,Foda MA,Vanden Brink W,et al.A new mode of diffuse brain injury in rats.Part I:Pathophysiology and biomechanics[J].J Neurosurg,1994,80(2):291-300.
[6]Espinoza - Rojo M,Iturralde - Rodríguez KI,Chánez-Cárdenas ME,et al.Glucose transporters regulation on ischemic brain:possible role as therapeutic target[J].Cent Nerv Syst Agents Med Chem,2010,10(4):317 -325.
[7]Hamlin GP,Cernak I,Wixey JA,et al.Increased expression of neuronal glucose transporter 3 but not glial glucose transporter 1 following severe diffuse traumatic brain injury in rats[J].J Neurotrauma,2001,18(10):1011 -1018.
[8]陈为安,杨得奖,屈 洋,等.3-硝基丙酸预处理对脑缺血耐受模型GLUT1和GLUT3表达的影响[J].中国病理生理杂志,2010,26(11):2212-2216.
[9]王国华,姜正林,李 霞,等.牛磺酸联合安定治疗脑缺血再灌注损伤的实验研究[J].中国病理生理杂志,2010,26(4):737-741.
[10]成兰云,门秀丽,张连元,等.内质网应激诱导的细胞凋亡在大鼠肢体缺血再灌注后肺损伤中的作用及牛磺酸的影响[J].中国病理生理杂志,2010,26(9):1776-1780.
[11]Sharp FR,Bergeron M,Bernaudin M.Hypoxia-inducible factor in brain[J].Adv Exp Med Biol,2001,502:273-291.
[12]Vannucci SJ,Reinhart R,Maher F,et al.Alterations in GLUT1 and GLUT3 glucose transporter gene expression following unilateral hypoxia-ischemia in the immature rat brain[J].Brain Res Dev Brain Res,1998,107(2):255-264.
