变性高效液相色谱技术定量检测急性髓细胞白血病FLT3基因内部串联重复突变方法学的建立
2011-08-02陈建兰李庆山王汉平杜庆华许艳丽陈晓燕谢健晋李志鹏
陈建兰,李庆山△,王汉平,应 逸,杜庆华,许艳丽,陈晓燕,谢健晋,毛 平,李志鹏
(1广州医学院附属市一人民医院血液科,广东 广州 510180;2厦门大学生命科学学院分子诊断学实验室,福建 厦门 361005)
在急性髓细胞白血病(acute myeloid leukemia,AML)分层治疗的研究中,Fms样酪氨酸激酶3(Fms-like tyrosine kinase 3,FLT3)基因近膜区的内部串联重复(internal tandem duplication,ITD)是最早被识别的分子标记之一,其存在与否被认为对AML的预后具有重要的判断价值。有研究认为[1,2],FLT3-ITD的这种预测价值与突变等位基因的比例有关,疾病复发率(relapse rate,RR)、无病生存率(disease-free survival,DFS)和总体生存期(overall survival,OS)随着突变比例的升高均有恶化趋势,且高白细胞也在高突变比例中更加突出,高比例突变的FLT3-ITD预测价值显得更大,因而定量分析FLT3-ITD尤为重要。通常情况下由于毛细管电泳法(capillary electrophoresis,CE)的高效性和高敏感性,FLT3-ITD相对定量分析主要是采用此法[3]。变性高效液相色谱技术(denaturing high-performance liquid chromatography,DHPLC)已经用于检测慢性粒细胞白血病(chronic myeloid leukemia,CML)ABL激酶区点突变[4],且技术方法稳定可靠,而少见DHPLC用于检测FLT3-ITD,故我们尝试运用DHPLC技术建立相对定量检测FLT3-ITD突变比例的方法,对121例临床病例进行检测,并与CE分析结果进行了比较,最后对比测序结果。
材料和方法
1 材料
1.1 研究对象 为患者,共121例,其中40例来自2007年1月-2010年12月我院住院或门诊初治经细胞形态学、免疫组织化学染色及流式细胞术免疫学分型并参照《血液病诊断及疗效标准》[5]确诊为原发性 AML病例,其余81例来自2007年1月-2010年12月厦门大学中山医院与第一附属医院的住院或门诊初治同上确诊为AML病例,由厦门大学生命科学学院分子诊断学实验室提供。其中M111例,M235例,M335例,M49例,M526例,M64例,M71例;男59例,女62例;中位年龄35(16-77)岁。阴性对照为10例健康人群。
1.2 主要试剂 EZHighTMDNA kit购自Texas BioGene。5×buffer溶液(含 2.5 mmol/L dNTPs,2.5 mmol/L Mg2+)和无RNase H2O均购自TaKaRa大连宝生物工程有限公司;10×LCGreen plus dye、Hotstart polymerase均为 Qiagen产品;FLT3-ITD正反向引物参照NCBI设计,由TaKaRa大连宝生物工程有限公司合成。DHPLC流动液:三乙胺乙酰盐(TEAA)和乙腈(ACN)均购自Transgenomic。
2 方法
2.1 基因组DNA提取 原保存的固定后的骨髓样本用EZHighTMDNA kit提取样本DNA,具体操作步骤按试剂盒说明进行。采用紫外分光光度计测定A260/A280值确定DNA产物的浓度。将提取的DNA置于-80℃冻存备用。
2.2 PCR扩增 针对FLT3-ITD突变主要发生在14号外显子上,设计扩增片段长度为328 bp,正向引物5'-AGC AAT TTA GGT ATG AAA GCC AGC TA-3',反向引物 5'-GGT TGC CGT CAA AAT GCT GAA AG-3'。反应体系组成为:5× buffer 5.0 μL;正向引物(10 μmol/L):0.5 μL;反向引物(10 μmol/L):0.5 μL;Hotstart polymerase 1.0 μL,DNA 2.0 μL(根据浓度调到50-100 ng);加无RNA酶水至体积25 μL。上ABI Veriti PCR扩增仪,反应条件:95℃预变性10 min,94 ℃ 30 s,55 ℃ 1 min,72℃ 1 min,循环29次。72 ℃延伸7 min,1个循环。将PCR产物置95℃变性5 min,然后降温至25℃ 1 min,这时混合样品中就会形成同源和异源的双链。
2.3 DHPLC分析 上WAVE 3500型分析仪前先配流动液:Buffer A液(0.1 mol/L TEAA):50 mL 2 mmol/L TEAA+250 μL ACN(乙腈)再加HPLC纯水定容至1 L。Buffer B液(0.1 mol/L TEAA,含25%ACN):50 mL 2 mmol/L TEAA+250 mL ACN再加HPLC纯水定容至1 L。将变性后的PCR产物放入到WAVE 3500型分析仪96孔样品池上,在50℃的条件下分析待测样本。根据程序指令,进样器自动吸取15 μL PCR产物,注人DNASep分离柱内,被流动相以0.9 mL/min的流速进行洗脱,在260 nm波长处读取吸光度(A)值。经系统自动处理后,形成DHPLC峰形图谱,结果被自动存储,供分析鉴定。每个样品重复3次实验。
正常人基因组和FLT3-ITD野生型标本DHPLC分析时表现为单1洗脱峰,突变型样本则表现为2个或3个洗脱峰。与标准参考模板对比,通过观察异源双链洗脱峰出现与否,确定突变存在的情况;然后通过对洗脱峰的峰面积进行计算,获得突变等位基因的比例,计算公式:

2.4 CE方法分析 在厦门大学生命科学学院分子诊断学实验室完成,首先也是针对FLT3-ITD基因突变多发生在14外显子上设计引物,设计扩增片段为367 bp。摸索反应体系和反应条件后进行PCR扩增,摸索反应体系和反应条件,25 μL 反应体系含5 μL 10 ×PCR buffer(100 mmol/L Tris-HCl,pH 8.3,500 mmol/L KCl,15 mmol/L MgCl2),0.2 mmol/L dNTPs,1 U Taq HS DNA聚合酶,正反向引物(各自均为150 nmol/L)和5 μL gDNA模板。在T3 Thermocycler上进行PCR扩增,程序如下:95℃预变性3 min;18个循环的Touchdown PCR,程序为95℃ 30 s,61℃ 30 s(每个循环下降0.5℃),72℃ 40 s;17个循环的普通PCR,程序为95℃ 30 s,52℃ 30 s,72℃ 40 s;72℃ 7 min。
后取1 μL PCR产物(用去离子水稀释50-200倍)、16.5 μL去离子甲酰胺(SLS)、2.5 μL 荧光标记的分子量标准(CEQ 600 size standard mixture,Beckman Coulter,p/n 608095,用SLS稀释10倍)混匀后,转移到96孔加样板,并滴加1滴石蜡油防止挥发。在CEQ8800遗传分析系统上,采用“Frag-2”程序运行,程序进行自动化操作。实验结束后,根据仪器自带软件进行“Fragment Analysis”,对毛细管电泳结果进行片段分析,确定是否存在FLT3-ITD突变。正常人基因组DNA标本和野生型PCR扩增产物在367 bp处出现单个尖峰。突变型标本除在367 bp处出现单峰外,在367 bp后将出现另一峰,根据软件给出的野生型峰面积S1和突变型峰面积S2,按照以下公式来计算突变比例,计算公式:
FLT3-ITD突变比例(%)=S2/(S1+S2)×100%。
2.5 DNA测序 将所有样品DNA送北京六合华大基因科技有限公司扩增后测序验证;再将测序结果利用DNAMAN软件分析并与NCBI网上的FLT3基因进行比对确定基因突变情况;最后与2种方法检测结果对比。
3 统计学处理
采用SPSS 13.0统计软件包对实验数据进行统计学分析。两组计量资料均数比较采用随机配对设计资料t检验,假定差值服从正态分布。
结 果
1 AML患者DHPLC分析结果
121例患者样本中有108例样本扩增后进行分析出现单1洗脱峰,为FLT3-ITD野生型,121例中(4号、5号、7号、8号、11号、14号、28 号、79号、85号、93号、107号、110号和118号)有2个或3个洗脱峰,即为FLT3-ITD突变型的样本,见图1,总阳性率为13/121(10.7%)。根据以上所述对应的公式计算出阳性样本的突变比例。每例阳性样本3次实验所得突变比例间无显著差异,取平均值。得出13例阳性样本突变等位基因的比例不一,分布范围中位数34.0%(12.4%-87.0%),见表1。正常对照的10例健康人群PCR产物的DHPLC洗脱峰也全为单1峰。
2 AML患者CE分析结果
正常对照健康成人DNA标本进行CE的片段分析结果在367 bp处出现单个尖峰。121例AML标本中108例在367 bp处出现单个尖峰,为FLT3-ITD野生型;13例除367 bp处峰之外在367 bp后出现额外峰,为FLT3-ITD突变型(见121例样本中4号、5号、7号、8号、11号、14号、28号、79号、85号,93号、107号、110号和 118号),见图 2,总阳性率为13/121(10.7%)。根据以上所述对应的公式计算出阳性样本的突变比例。每例阳性样本重复3次实验所得突变比例间无显著差异,取平均值。13例阳性样本间比较突变等位基因的比例不一,分布范围中位数为34.5%(11.4%-80.2%),见表1。
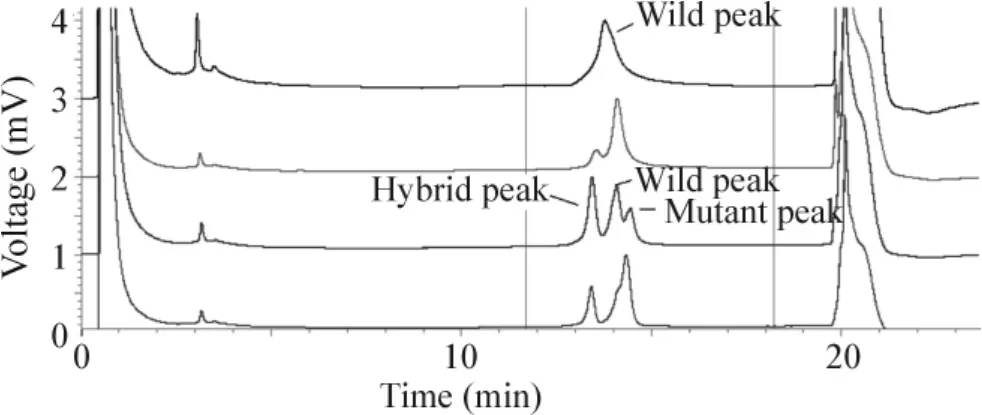
Figure1.The DHPLC characteristic elution peaks.From top to bottom:represent sample of wildtype FLT3-ITD;the 28th sample:FLT3-ITD mutation in the low percentage(12.4%);the 8th sample:FLT3-ITD mutation in the moderate percentage(42.3%);the 7th sample:FLT3-ITD mutation in the high proportion(87.0%).图1 DHPLC的特征性洗脱峰
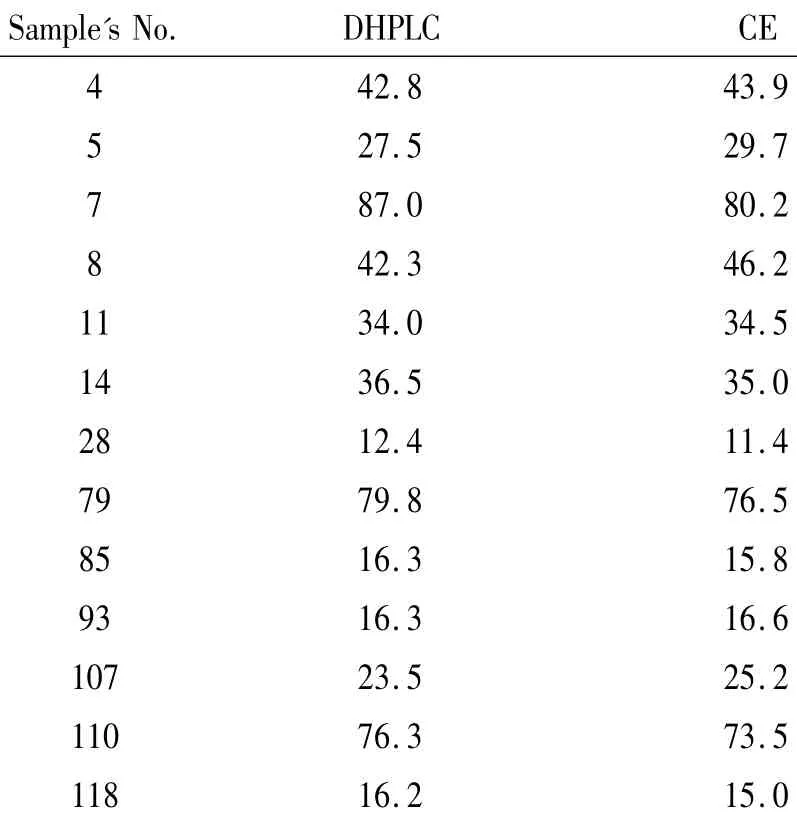
表1 DHPLC和CE定量分析FLT3-ITD突变阳性样本的结果对比Table1.The quantitative analysis of FLT3-ITD mutation in positive samples examined with DHPLC and CE methods(%.the average for three repeative experiments)
3 2种方法结果对比
2种方法阳性定性结果吻合,阳性率是一样的。2种方法阳性定量结果之间比较也无显著差异(P>0.05)。
参照文献[1],我们将突变比例分成3组。低突变 (<25%)有5例,中突变(≥25%且≤50%)有5例,高突变 (>50%)有3例。
4 测序验证
将所得样品进行了测序验证,发现4号、5号、7号、8号、11号、14号,28号、79号、85号,93号、107号、110号和 118号样品为单个串联重复突变,插入片段大小为21-87 bp不等,均为单个插入片段。结果与DHPLC、CE检测到的阳性结果吻合。其余108例为FLT3-ITD阴性。
讨 论
AML分层治疗是近年来研究的热点,染色体核型异常的AML病例可按照WHO的标准进行分层管理,而占原发病例40%-50%的核型正常的中间型病例具有高度异质性,目前尚缺乏足够分子标记对其进行精细的分层管理和准确的预后判断[6]。作为最早被发现具有不良预后判断价值的的分子指标之一,FLT3-ITD的研究最为广泛,早几年国内外针对FLT3-ITD定性研究较多。尹列芬等[7]已用DHPLC技术定性检测了60例AML患者FLT3-ITD基因突变情况,认为FLT3-ITD基因突变可作为预测AML预后的一个指标。而目前这种预测价值探索深入化,有些研究者认为FLT3-ITD等位基因突变水平的不同,预后也不同;比尹列芬他们单纯的定性研究更具有预后判断价值。比如有一项采用CE的方法[1]的研究以FLT3-ITD突变等位基因水平和FLT3-ITD存在与否作为分组指标,比较分析了2组病例RR、DFS和OS,显示前者的预测作用明显强于后者,差异极显著:随着FLT3-ITD突变比例的增加,患者的RR也随之增加,DFS和OS降低,预后则变差;低突变水平(﹤25%)患者的预后较野生型患者差,中度突变水平(25%-50%)患者的预后又较低突变水平患者差,高度突变水平(﹥50%)患者的预后最差。Bullinger等[8]研究提示对FLT3-ITD突变等位基因进行定量分析,有可能对AML进行更精细的治疗分层和更准确的预后判断。不过Thiede等[2]则认为,FLT3-ITD低突变水平患者的预后与野生型患者相比并无差别,只有高水平的FLT3-ITD突变才具有预后判断价值。

Figure2.The analysis result of one sample using CE method.图2 某一样品的CE方法分析结果
所以定量检测FLT3-ITD对日后详细判断正常核型AML患者预后及指导治疗具有更重要的意义。但是目前多用上述的CE方法进行检测,该方法对仪器设备要求高或技术方法上繁琐耗时长,不利于快速判断,为进一步探讨FLT3-ITD突变等位基因水平的临床价值,我们根据自身实验条件,在DHPLC定性检测基因突变功能的基础上对FLT3-ITD突变等位基因进行定量检测。它是一项敏感可靠的DNA分析技术[9]。FLT3-ITD基因突变运用该法的检测是基于异源双链的形成,根据PCR产物变性复性后,形成了同源双链和异源双链,而异源双链由于碱基对不匹配,在部分变性的温度条件下,会在不匹配的碱基对处形成部分解链。由于单链DNA带负电荷减少,结合力弱,因此,异源双链比同源双链先洗脱出来。根据其在柱子上保留时间的不同,可将同源双链和异源双链分离。如此就可分离检测出由于ITD的插入而引起的FLT3基因长度多态性,再通过对洗脱峰面积的计算,对FLT3-ITD突变等位基因即可进行定量分析。
应用该方法,我们成功地对121例AML样本进行了检测分析,对13例突变阳性的样本进行了定量计算。为验证DHPLC定量结果的准确性,我们采用CE的方法对样本重复进行了分析。从表1可知,2种方法定量的结果完全一致(P>0.05),表明本研究的DHPLC定量检测方法准确可靠、稳定。而本组的研究群体中,FLT3-ITD突变的阳性率只有10.7%(13/121),远低于文献报道的AML中20%-30%的阳性检出率,正常核型AML中30%-40%[9]。而这较低的阳性率可能与样本数量有限、地域分布局限性有关。而且,目前有研究认为FLT3-ITD定量结果不同,预后比较有显著差异,当然,这有待我们后续进一步研究。
与以往多数采用的CE方法检测FLT3基因突变情况相比,DHPLC除具有同CE方法一样快速、高重复性、自动化、准确的优点外,且具有高通量、快捷、成本相对低的特点[10]。它不需要荧光标记的引物,也不需要任何PCR纯化,简化了操作步骤。经我们对比观察,DHPLC方法检测1个样品所花时间不足CE方法的一半,而我们的研究又证实DHPLC的结果与CE的结果一致,更进一步证实了DHPLC方法的可行性和实效性。虽然突变比例极高时该法不如CE精确,但计算软件中的切割峰功能能使计算结果达到较高精确性,且并不影响对高突变比例样本界限的判定。
综上所述,建立DHPLC技术相对定量检测FLT3-ITD突变情况,能为急性髓细胞白血病临床治疗与预后提供了更详尽的参考指标。
[1]Gale RE,Green C,Allen C,et al.The impact of FLT3 internal tandem duplication mutant level,number,size,and interaction with NPM mutations in a large cohort of young adult patients with acute myeloid leukemia[J].Blood,2008,111(5):2776-2784.
[2]Thiede C,Steudel C,Mohr B,et al.Analysis of FLT3-activating mutations in 979 patients with acute myelogenous leukemia:association with FAB subtypes and identification of subgroups with poor prognosis[J].Blood,2002,99(12):4326-4335.
[3]Noguera NI,Ammatuna E,Zangrilli D,et al.Simultaneous detection of NPM1 and FLT3-ITD mutations by capillary electrophoresis in acute myeloid leukemia[J].Leukemia,2005,19(8):1479-1482.
[4]秦效英,秦亚溱,刘艳荣,等.应用变性高效液相色谱检测伊马替尼治疗后慢性髓性白血病患者ABL激酶区点突变[J].中华检验医学杂志,2006,29(11):991-995.
[5]张之南,沈 悌.血液病诊断及疗效标准[M].第3版.北京:科学出版社,2007.106-116.
[6]Schnittger S,Schoch C,Dugas M,et al.Analysis of FLT3length mutations in 1003 patients with acute myeloid leukemia:correlation to cytogenetics,FAB subtype and prognosis in the AMLCG Study and usefulness as a marker for the detection of minmal residual disease [J].Blood,2002,100(1):59-66.
[7]尹列芬,王 晔,姚 锦,等.急性髓细胞白血病FLT3-ITD基因突变的检测及其临床意义[J].西安交通大学学报(医学版),2009,30(4):453-455.
[8]Bullinger L,Döhner K,Kranz R,et al.An FLT3 geneexpression signature predicts clinical outcome in normal karyotype AML[J].Blood,2008,111(9):4490-4495.
[9]Jiang A,Jiang H,Brandwein J,et al.Prognostic factors in normal karyotype acute myeloid leukemia in the absence of the FLT3-ITD mutation[J].Leuk Res,2011,35(4):492-498.
[10]李 莉,王 翀,陈瑶生.DHPLC系统工作原理及其应用[J].生物技术通报,2006(S1):120-124.
