CREG调控IGF2R/IGFII内吞抑制人血管平滑肌细胞增殖*
2011-08-02闫承慧黄明方张效林韩雅玲
闫承慧,栾 波,黄明方,李 杰,张效林, 韩雅玲△
(1沈阳军区总医院全军心血管病研究所心内科,辽宁 沈阳 110840;2南京军区福州总医院心内科,福建 福州 210002)
冠心病等心血管病严重危害人类健康,随着我国人民生活水平的提高和生活方式的改变,心血管疾病发病正不断增加,动脉粥样硬化(atherosclerosis,AS)是其主要病理基础[1]。AS的病理变化包括脂质聚集、单核-巨噬细胞的侵入、泡沫细胞形成、炎症及血管平滑肌细胞(vascular smooth muscle cells,VSMCs)增生等。阐明VSMCs在病理性刺激中的增殖机制,对减缓AS的进程,预防和治疗AS的发生发展可能起到积极的作用。
人E1A激活基因阻遏子(human cellular repressor of E1A -stimulated gene 1,hCREG)基因是1998年Veal等[2]从HeLa细胞中克隆的一个新的细胞分化调控基因。CREG蛋白过表达可以抑制体外培养的畸胎瘤细胞增殖并促进其分化[3]。进一步研究证实[4,5],hCREG 是一种分泌型糖蛋白,可与胰岛素样生长因子II(insulin-like growth factor II,IGFII)竞争性结合细胞膜胰岛素样生长因子Ⅱ受体(insulinlike growth factor II receptor,IGF2R),以自分泌和旁分泌2种途径调控细胞分化。本室前期研究发现,hCREG蛋白过表达能抑制体外培养的人VSMCs的增殖并促进其向分化表型转化[6,7]。同时在体颈动脉损伤模型研究也发现,CREG基因过表达可以抑制损伤诱导的大鼠VSMCs由分化表型向合成表型的转化,同时抑制新生内膜的形成和再狭窄的发生[8,9]。但 hCREG 抑制人 VSMCs增殖的作用机制仍有待阐明。本研究旨在应用本室构建的CREG正、反义逆转录病毒载体pLNCX2-CREG和pSM2-siCREG,感染体外培养的人VSMCs,通过G418和嘌呤霉素抗性筛选建立过表达hCREG和hCREG沉默的人 VSMCs株,观察 CREG表达增强或沉默对VSMCs增殖的效应,并深入阐明其调控机制。
材料和方法
1 材料
人VSMCs由本室保存。pLNCX2-CREG质粒由Han等[10]构建。pSM2-siCREG质粒购自 Open Biosystems。抗 CREG和 CD31单克隆抗体购自R&D、抗平滑肌α-actin、平滑肌MHC和PCNA多克隆抗体购自北京中杉金桥公司。Ⅱ抗为辣根过氧化物酶标记的抗小鼠、抗山羊和抗大鼠的IgG购自北京中杉金桥公司。ECL化学发光试剂盒购自Sigma。Alexa 488荧光探针购自Cell Signalling Technology。PD98059和LY294002购自Sigma。
2 方法
2.1 逆转录病毒制备、滴度测定及细胞系感染 感染前1 d将Phoenix 293包装细胞系接种于35 mm皿上,使细胞在感染当天达到70% -80%的融合率。采用磷酸钙沉淀法进行逆转录病毒转染及病毒制备。采用流式细胞仪检测绿色荧光蛋白在293细胞中的表达以确定病毒滴度。将1.5×106VSMCs接种于直径35 mm平皿,细胞生长到90% -95%融合时,按照逆转录病毒感染方案将含有LNCX2-CREG和SM2-siCREG的逆转录病毒分别感染VSMCs,感染24 h后传代,传代第2 d加入G418600 mg/g和puromycin 1 mg/g筛选7-10 d,用克隆环挑取生长良好的耐药克隆,培养、扩增后鉴定并冻存备用。
2.2 阳性细胞克隆中CREG表达检测 将G418和puromycin阳性克隆分别进行扩增,在无血清培养条件下培养24 h,用TCA法收集培养基中蛋白;在有血清培养条件下,细胞生长至90% -95%融合时收获并裂解细胞,收集细胞总蛋白。Western blotting检测培养上清及细胞中CREG表达。
2.3 细胞增殖能力检测
①流式细胞术检测细胞周期 将细胞无血清培养48 h后,换成有血清的培养液培养48 h。胰蛋白酶消化细胞,PBS洗2次,75%乙醇固定过夜。PBS再洗3次,吸尽残余的PBS,用PI染料染1 h,过膜去除细胞凝集块后,应用流式细胞仪进行检测。
②BrdU掺入实验 于6孔板中每孔接种1×104个细胞,每组细胞平行做2个复孔。37℃、5%CO2中培养48 h后换液,加入10 g/L BrdU,继续培养2 h后,常规固定、通透,浓盐酸变性5 min,封闭后加anti-BrdU抗体(1∶100)4℃过夜,Ⅱ抗 (1∶100)室温2 h,加入DAB,待显色明显时PBS终止反应,并以苏木素复染细胞核。显微镜下观察细胞核着色情况。每孔计数10个视野,计算着色细胞比例。
2.4 细胞膜蛋白提取 收集贴壁生长至80%的VSMCs、VSMCs-CREG 和 VSMCs-siCREG 细胞,用总蛋白和膜蛋白提取试剂盒分别提取细胞的总蛋白和胞膜蛋白,BCA方法定量后行Western blotting检测。Ⅰ抗分别为抗IGF2R抗体和抗β-actin抗体。
2.5 共聚焦显微镜观察IGF2R的细胞定位 用抗IGF2R抗体标记VSMCs、VSMCs-CREG和VSMCssiCREG。用FITC或者TRITC标记的Ⅱ抗进行免疫荧光染色,共聚焦显微镜下观察IGF2R在细胞内的定位。
2.6 ELISA法检测 IGFII分泌 用 ELISA检测VSMCs、VSMCs-CREG 和 VSMCs-siCREG 培养上清IGFII含量。3组细胞在60 mm培养皿中融合至80%左右,弃去培养基,无菌PBS洗涤,5 mL×3次,将残留液体吸尽,加无血清的DMEM 4 mL(以尽量少的液体覆盖细胞表面),置37℃、5%CO2细胞培养箱继续培养24 h后收集上清,进行ELISA检测。实验前以细胞计数结果校对上样量,并且使上样量保持一致,按ELISA试剂盒说明书进行。酶标仪读取结果,每次实验读数取2个,重复3次。
2.7 RT-PCR检测 Trizol试剂提取细胞的总RNA,核酸蛋白测定仪测定RNA浓度及纯度,RNA纯度为260/280,比值 1.7 -1.9,加入去 RNase 水调整浓度至1 g/L。用逆转录试剂盒(TaKaRa)合成cDNA第1链,RT-PCR引物扩增目标片段。IGFII因子的扩增引物:上游引物 5'-CTTGGACTTTGAGTCAAATTGG-3',下游引物5'-GGTCGTGCCAATTACAT -3',扩增片段长度292 bp,β-actin作为内参照。
2.8 Western blotting检测 按文献[9]采用 BCA比色法测定裂解液中总蛋白质的浓度并调蛋白的浓度至1 g/L,样品经120 g/L分离胶进行SDS-PAGE。每个泳道上样30 μL,在4℃的循环水浴内以300 mA电流将样品转至硝酸纤维素滤膜上,时间为2 h。滴加含50 g/L脱脂奶粉的TBS-T缓冲液室温封闭1 h,以TBS-T洗膜3次,每次10 min。依次滴加1∶1000的Ⅰ抗(4℃孵育过夜,TBS-T洗膜3次,每次10 min)及4 μL 1∶2000 HRP 标记的Ⅱ抗(室温孵育2 h,洗膜同前述)。用ECL化学发光显色,Kodak黑白胶片成像。
2.9 Alexa 488-IGFII细胞内吞实验 用Alexa 488荧光探针标记重组的IGFII,GE柱子纯化去除未标记荧光分子。将VSMCs培养于24孔细胞培养板中,细胞密度为20%-30%。将标记好的荧光分子定量加入到细胞培养上清中,冰上孵育30 min,荧光显微镜下观察细胞内吞情况。
2.10 阻断实验 IGF2R中和抗体、重组IGF2R蛋白和PI3K/Akt信号抑制剂LY294002、ERK信号通路抑制剂PD98059分别添加到细胞培养上清中,流式细胞术检测其对细胞增殖的作用。
3 统计学处理
采用SPSS 11.5统计软件包进行分析,数据以均数±标准差()表示,组间比较采用t检验或单因素方差分析。
结 果
1 CREG基因过表达抑制体外培养的VSMCs增殖
CREG基因过表达组VSMCs增殖能力较正常对照组明显受到抑制,G1期细胞比例增多,G2/S期细胞数目显著减少。CREG基因沉默(siCREG)组的VSMCs增殖能力明显增强,细胞周期显著缩短,见图1。
2 CREG调控IGF2R受体在细胞膜上的表达干预IGFII内吞
与正常对照组细胞相比较,尽管CREG基因过表达细胞总蛋白中IGF2R表达未见明显增加,但细胞膜上IGF2R表达及分布均显著增加。CREG基因沉默细胞中IGF2R总蛋白的表达明显增加,但大部分表达集中在细胞浆内,而膜上IGF2R蛋白的表达及分布明显下降,见图2。这提示CREG基因的表达变化干扰了IGF2R的表达及在细胞膜上的分布。
与对照组细胞相比较,CREG过表达组细胞上清中IGFII的分泌减少,而CREG基因沉默组细胞上清中IGFII的分泌显著增加,见图3A。3组细胞中IGFII在RNA水平无明显变化,见图3B。CREG过表达组IGFII的内吞显著,而CREG基因沉默组细胞未能检测到IGFII的内吞发生,见图3C。上述研究证实:CREG基因表达变化改变了细胞膜受体IGF2R的表达及分布,干扰了其对细胞因子IGFII内吞的调控,引起CREG沉默细胞中IGFII分泌增加。
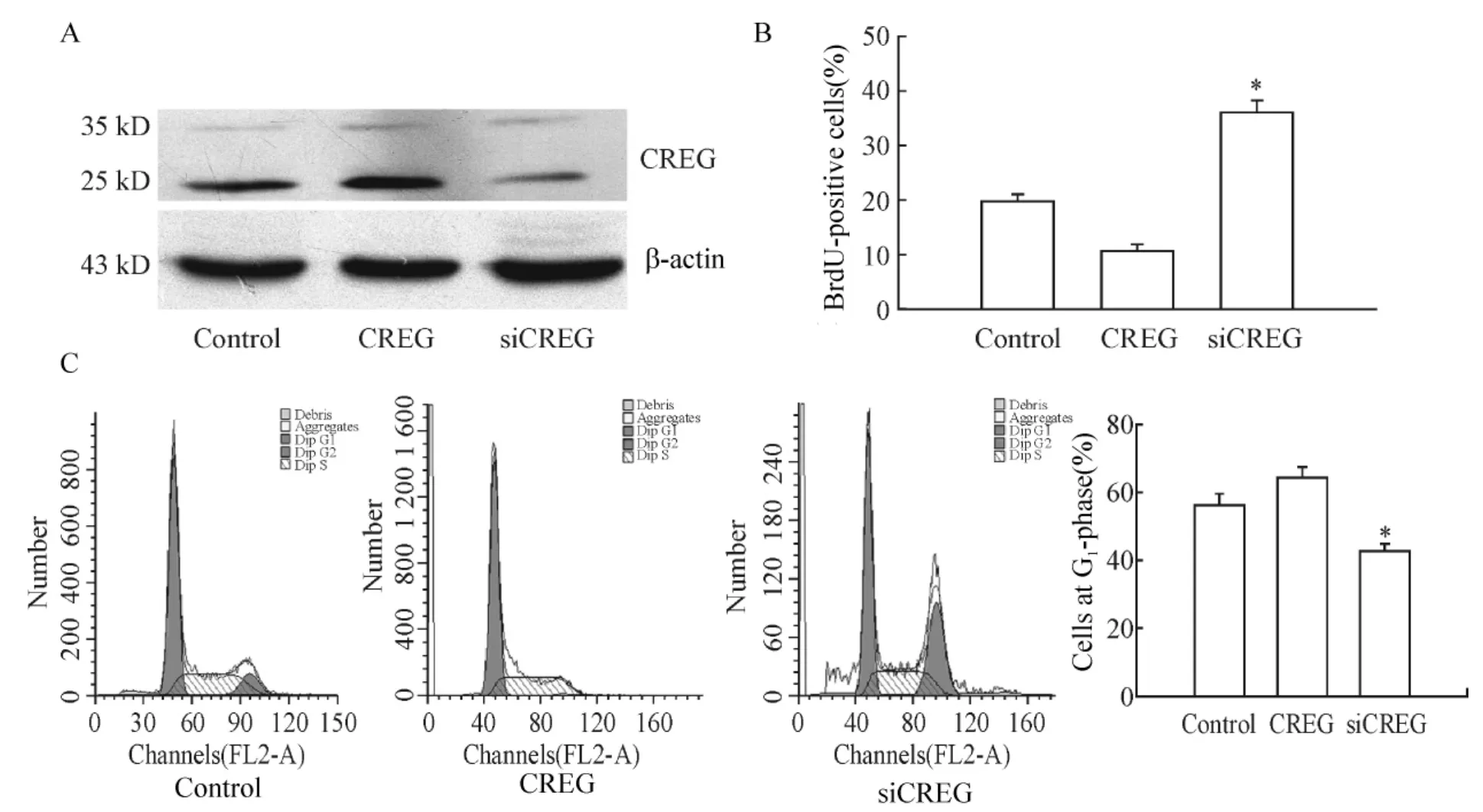
Figure1.Up-regulation of CREG inhibited vascular smooth muscle cell proliferation.A:CREG expression detected by Western blotting;B:Cell proliferation detected by BrdU assay;C:Cell cycle determined by flow cytometry..n=6.*P<0.05 vs control.图1 CREG过表达抑制血管平滑肌细胞增殖
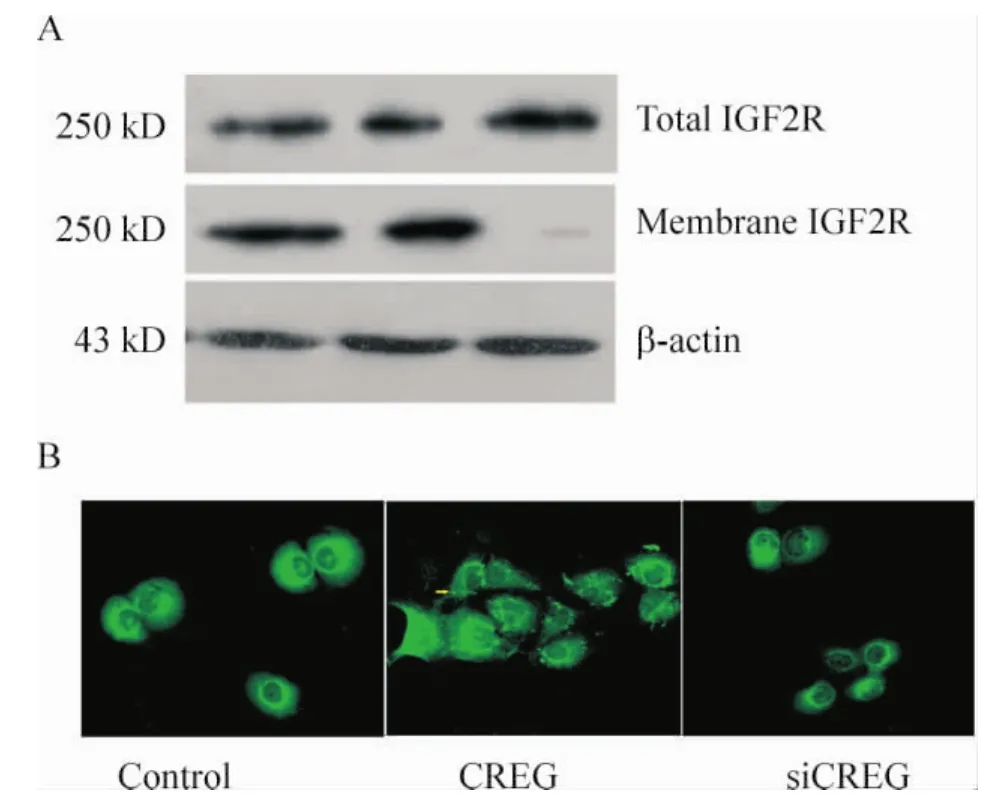
Figure2.CREG regulated the expression and localization of IGF2R in cellular membrane.A:Western blotting showed the expression of IGF2R in cellular membrane and cell lysate;B:immunofluorescence showed that the localization of IGF2R in the cells.图2 CREG调控细胞膜受体IGF2R的表达与定位
3 中和抗体干预IGF2R/IGFII表达对VSMCs增殖的影响
正常对照组细胞或CREG过表达组细胞,应用中和抗体阻断了IGF2R的作用,引起G2/S期细胞比例呈浓度依赖性增加。应用重组IGF2R小肽阻断了IGFII的内吞作用后,所得到结果与中和抗体结果一致,见图4。这提示CREG通过介导IGF2R/IGFII内吞作用抑制VSMCs增殖。
4 IGFII活化PI3K/Akt/ERK信号通路介导CREG沉默诱导的VSMCs增殖
CREG沉默组细胞中PI3K/Akt和MAPK-ERK均较正常组和过表达CREG组明显活化,见图5。应用PD98059和LY294002分别抑制上述2种信号的活化后,结果发现上述2种抑制剂均部分抑制了CREG基因沉默诱导的细胞增殖现象,见图5。
讨 论
hCREG是一种可以阻遏12S E1A介导的腺病毒E2和热休克蛋白70转录激活的分泌型糖蛋白[2],参与维持正常组织细胞的成熟和分化。我室的前期研究发现,与合成表型(增殖型)的VSMCs相比较,分化表型(非增殖型)的VSMCs中CREG的表达明显增加[6]。并且CREG过表达抑制了体外培养的VSMCs增殖,对抗了血管损伤引起的VSMCs增殖和血管狭窄的发生[8-10]。这些研究提示,CREG 可能具有抑制VSMCs增殖和诱导细胞分化的生物学功能,从而维持VSMCs处于静息成熟状态。VSMCs增殖能力是生物体内成熟的VSMCs由分化表型向去分化表型发生转化的重要特征之一,也是多种血管疾病发生发展的重要病理基础。因而,深入阐明CREG对抗VSMCs增殖的分子机制将可能对心血管疾病防治研究提供重要的理论依据和候选基因。
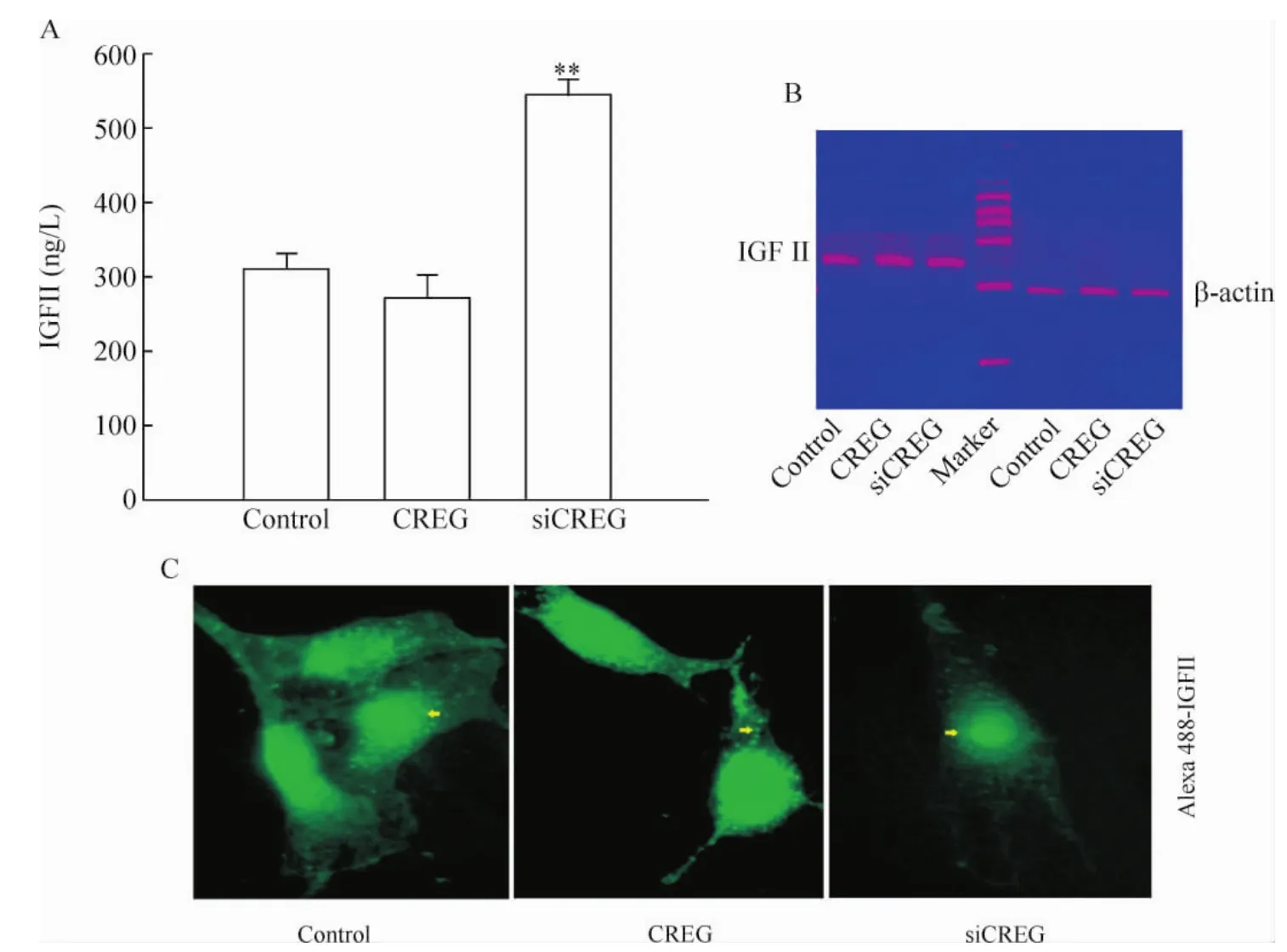
Figure3.CREG regulated the secretion and endocytosis of IGFII in vitro.A:ELISA detected the effect of CREG expression on the secretion of IGFII in VSMCs;B:RT-PCR analysis showed the expression of CREG in transcriptional level in VSMCs;C:internalization of labeled IGFII detected with Alexa 488..n=6.**P<0.01 vs control.图3 过表达CREG基因抑制IGFII的分泌,促进IGFII的内吞
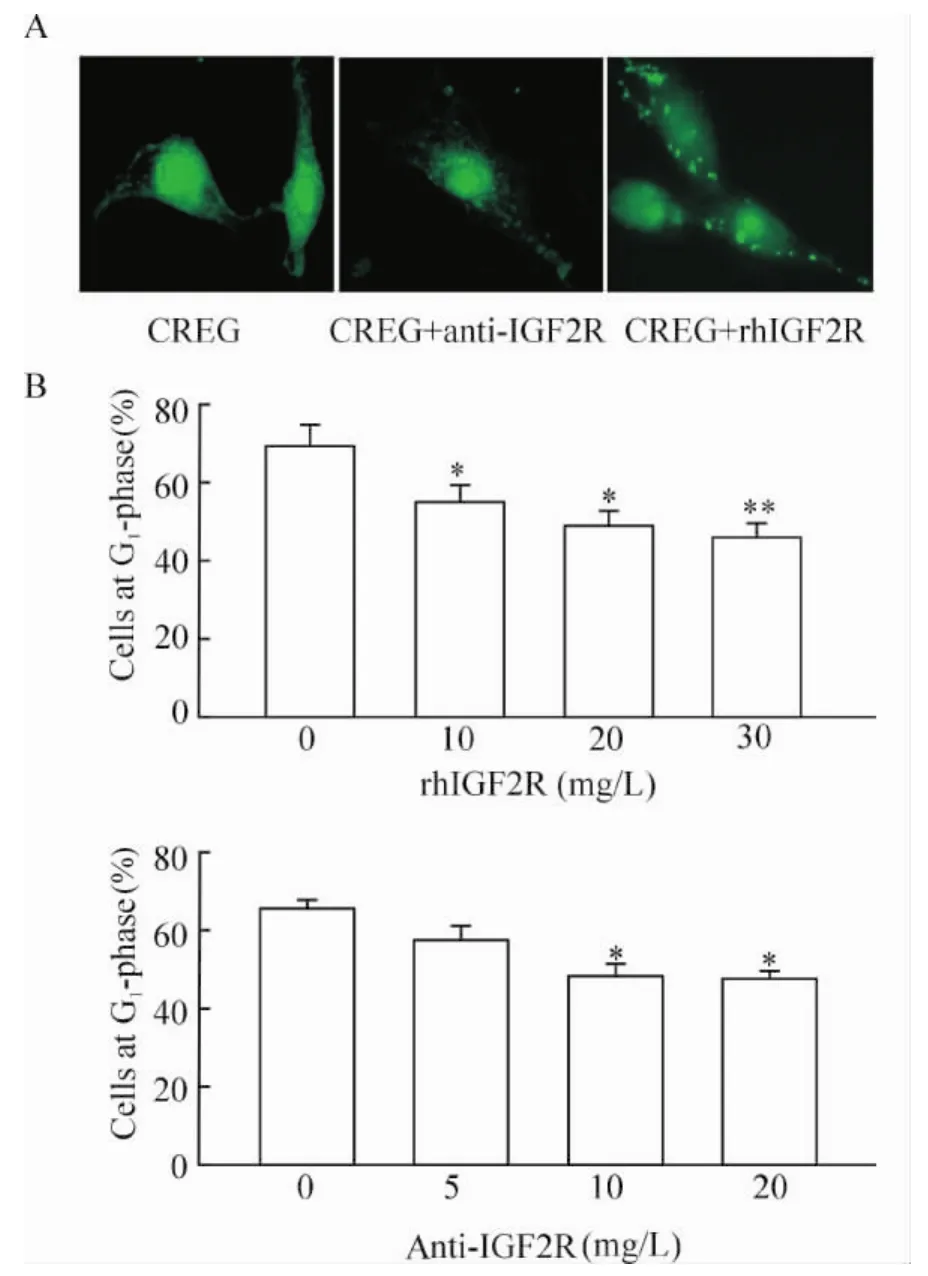
Figure4.Inhibiting the endocytosis of IGF2R to IGFII promoted the proliferation of VSMCs.A:the endocytosis was inhibited by neutralized antibody of IGF2R(anti-IGF2R)or recombinant human IGF2R(rhIGF2R).B:the percentages of the cells at G1-phase decreased as the increased concentration of rhIGF2R or anti-IGF2R..n=6.*P<0.05 vs control(0).图4 抵制IGF2R对IGFII的内吞可促进VSMCs的增殖
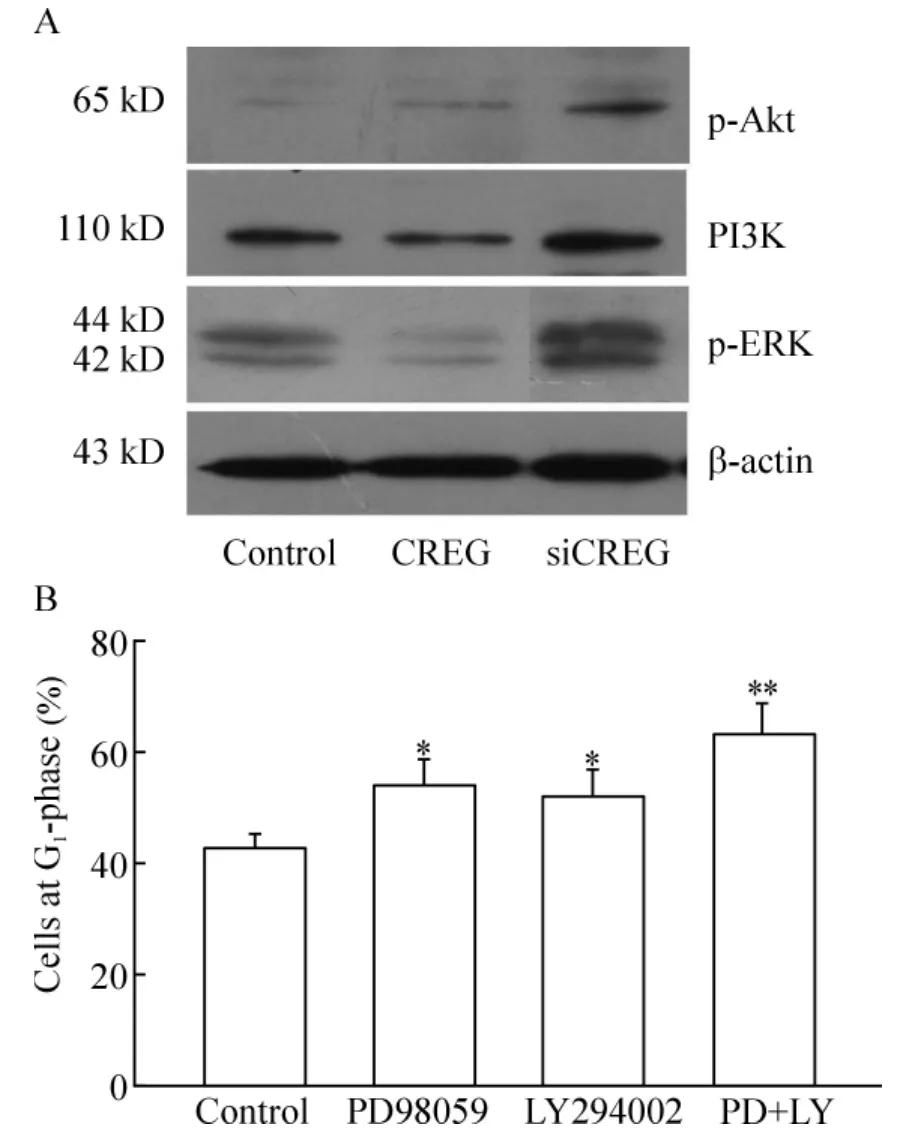
Figure5.PI3K/Akt and MAPK/ERK pathways were involved in CREG -regulated cellular proliferation.A:the protein expression of p-Akt,PI3K and p-ERK was detected by Western blotting.B:LY294002(LY)and PD98059(PD),inhibitors of PI3K/Akt pathway and MAPK/ERK pathway,respectively,were used to determined the roles of the two pathways..n=6.*P <0.05,**P < 0.01 vs control.图5 PI3K/Akt和MAPK/ERK信号转导通路参与CREG对细胞增殖的调控
在前期研究工作的基础上,本研究应用逆转录病毒载体感染和抗性药物的筛选,分别获得了能够稳定传代的hCREG高表达细胞株(VSMCs-CREG)和hCREG表达抑制的细胞株(VSMCs-siCREG)。并通过Western blotting分析证实了VSMCs-CREG细胞中hCREG表达较对照细胞增加;而VSMCs-si-CREG细胞中hCREG表达较对照细胞降低。这2株细胞系的建立为进一步研究hCREG对VSMCs增殖的作用机制提供了较好的细胞学研究平台。
本室先前研究证实[11,12],CREG 蛋白可能与膜受体蛋白IGF2R存在相互作用。为明确CREG基因表达对VSMCs增殖的作用机制,本研究首先应用膜蛋白提取和免疫荧光染色等方法分析了CREG基因表达对细胞膜受体蛋白IGF2R的表达分布的影响,证实了CREG基因过表达可以促进IGF2R在细胞膜上的分布;仅而通过荧光示踪标记方法确定IGF2R受体在细胞膜上大量分布加速了生长因子IGFII的内吞作用。相反,当 CREG基因表达被抑制后,VSMCs细胞膜上受体IGF2R蛋白分布显著下降,同时IGFII因子的内吞受到抑制。为进一步明确IGFII因子内吞与CREG介导的细胞增殖的关系,我们进行了IGF2R中和抗体的阻断研究以及重组IGF2R小肽的干预研究,证实IGFII因子的内吞作用受到抑制后,可明显加速 VSMCs的增殖。PI3K/Akt和MAPK/ERK两个经典的细胞增殖调控信号通路协同参与了IGFII对VSMCs增殖的调控作用。
总之,这些研究工作从分子水平阐明CREG基因过表达促进IGF2R-IGFII内吞,抑制VSMCs细胞增殖的作用机制。同时也证实IGFII启动的VSMCs增殖是PI3K/Akt和MAPK/ERK信号转导通路协同作用介导的,仅单独应用一种增殖信号通路的抑制剂难以有效抑制VSMCs的增殖现象。因而,只有充分了解细胞增殖的机制,找到诱导细胞增殖的“关节点”蛋白,才能更有效地进行细胞学和在体的干预治疗研究。
[1]Hao H,Gabbiani G,Bochaton - Piallat ML.Arterial smooth muscle cell heterogeneity:implications for atherosclerosis and restenosis development[J].ArteriosclerThromb Vasc Biol,2003,23(9):1510 -1520.
[2]Veal E,Eisenstein M,Tseng ZH,et al.A cellular repressor of E1A-stimulated genes that inhibits activation by E2F[J].Mol Cell Biol,1998,18(9):5032 -5041.
[3]Veal E,Groisman R,Eisenstein M,et al.The secreted glycoprotein CREG enhances differentiation of NTERA-2 human embryonal carcinoma cells[J].Oncogene,2000,19(17):2120-2128.
[4]Di Bacco A,Gill G.The secreted glycoprotein CREG inhibits cell growth dependent on the mannose-6-phosphate/insulin -like growth factor II receptor[J].Oncogene,2003,22(35):5436 -5445.
[5]Sacher M,Di Bacco A,Lunin VV,et al.The crystal structure of CREG,a secreted glycoprotein involved in cellular growth and differentiation[J].Proc Natl Acad Sci USA,2005,102(51):18326 -18331.
[6]Han YL,Liu HW,Kang J,et al.Expression of cellular repressor of E1A-stimulated genes in vascular smooth muscle cells of different phenotypes[J].Zhonghua Yi Xue Za Zhi,2005,85(1):49 - 53.
[7]Han YL,Xu HM,Deng J,et al.Over- expression of the cellular repressor of E1A-stimulated genes inhibits the apoptosis of human vascular smooth muscle cells in vitro[J].Sheng Li Xue Bao,2006,58(4):324 -330.
[8]Han Y,Deng J,Guo L,et al.CREG promotes a mature smooth muscle cell phenotype and reduces neointimal formation in balloon -injured rat carotid artery[J].Cardiovasc Res,2008,78(3):597 -604.
[9]Han Y,Guo L,Yan C,et al.Adenovirus- mediated intra-arterial delivery of cellular repressor of E1A-stimulated genes inhibits neointima formation in rabbits after balloon injury[J].J Vasc Surg,2008,48(1):201 -209.
[10]Han Y,Wu G,Deng J,et al.Cellular repressor of E1A-stimulated genes inhibits human vascular smooth muscle cell apoptosis via blocking P38/JNK MAP kinase activation[J].J Mol Cell Cardiol,2010,48(6):1225 -1235.
[11]Han Y,Cui J,Tao J,et al.CREG inhibits migration of human vascular smooth muscle cells by mediating IGF-II endocytosis[J].Exp Cell Res,2009,315(19):3301 -3311.
[12]Han YL,Guo P,Sun MY,et al.Secreted CREG inhibits cell proliferation mediated by mannose 6-phosphate/insulin-like growth factor II receptor in NIH3T3 fibroblasts[J].Genes Cells,2008,13(9):977 -986.
