内皮素-1及一氧化氮水平与2型糖尿病听力损害的关系*
2011-08-02龚小花吴文俊陈咨苗谷雪梅沈飞霞
陈 雄, 林 碧, 龚小花, 吴文俊, 陈咨苗, 谷雪梅, 沈飞霞△
(温州医学院附属第一医院1内分泌科,2耳鼻咽喉科,浙江 温州 325000)
自从1857年Jordao首次报道听力损害(hearing impairment,HI)和糖尿病之间的关系之后,诸多临床研究发现糖尿病是致听力损害的重要原因之一。有学者认为糖尿病患者听力损害的出现与累及视网膜和肾脏的糖尿病微血管相似的病理改变发生在耳蜗脉管系统所导致[1],也有研究发现糖尿病听力损害与糖尿病神经及微血管并发症无关[2],因此其具体机制尚未完全阐明。本研究通过检测糖尿病伴听力损害患者血浆内皮素-1(endothelin-1,ET-1)和血清一氧化氮(nitric oxide,NO)水平,初步探讨上述2个指标与糖尿病听力损害的关系。
材料和方法
1 一般资料
本研究选择在温州医学院附属第一医院内分泌科就诊的符合1999年WHO诊断标准的2型糖尿病患者88例作为糖尿病组(diabetes mellitus,DM),男47例,女41例,年龄(48.21±9.45)岁(<60 岁),糖尿病病程5(1,11)年。根据纯音测听结果,阈值≤25 dB定义为听力正常,将上述患者分成2组。(1)糖尿病伴听力损害(DM-HI组,42例):纯音测听阈值>25 dB;(2)糖尿病不伴听力损害(DM-NoHI,46例):纯音测听阈值≤25 dB。另选同期健康体检患者53例作为对照组(NC),男31例,女22例,年龄(44.59±10.02)岁(<60岁),同样根据听力损害与否进行分类,分为NC-HI组和NC-NoHI组,例数分别为21例和32例。糖尿病患者需通过眼底摄片、24 h尿蛋白定量及周围神经检查(包括10 g尼龙丝及肌电图检查)排除糖尿病视网膜病变、肾病及周围神经病变的患者。其它排除标准:1型及其它特殊类型糖尿病,无糖尿病急性并发症(糖尿病酮症酸中毒、高血糖高渗状态),无严重的心肌梗塞、脑梗塞病史,无中耳疾病、耳毒性药物致聋史,无颅脑外伤、噪声接触史及遗传因素致聋史。
2 方法
2.1 临床生化指标 每位研究对象均空腹10 h次晨抽取静脉血胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(lowdensity lipoprotein cholesterol,LDL - C)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)和糖化血红蛋白(glycation hemoglobin,HbA1c),测量并记录身高、体重、收缩压(systolic blood pressure,SBP)和舒张压(diastolic blood pressure,DBP)。
2.2 纯音测听 每位研究对象均先进行声导抗测试,在确定其鼓室压图为A型图后,在本底噪音<30 dB的隔声室中,采用MADSEN公司的ORBITER 922型纯音听力计进行两耳纯音听阈测试,包括0.25 kHz、0.5 kHz、1 kHz、2 kHz、4 kHz、8 kHz等频率。参照WHO听力损伤分级法(1980)及Beauchamp分级标准(1977),取 0.5 kHz、1 kHz、2 kHz、4 kHz的平均气导听阈,如阈值>25 dB则定义为听力损害,阈值≤25 dB为听力正常。所有操作流程由测听室专人负责完成。
2.3 血浆ET-1和血清NO测定 (1)血浆ET-1水平测定:采用放射免疫法测定血浆中ET-1水平(采用非平衡法),试剂盒购于解放军总医院放免技术中心;(2)血清NO水平测定:应用硝酸还原酶法检测血清中NO水平,NO试剂盒由南京建成生物工程公司生产。实验过程严格参照说明书进行。
3 统计学处理
结 果
1 2组一般临床资料比较
如表1所示,DM组患者体重指数 (body mass index,BMI)和 SBP高于 NC 组(P <0.05),性别、年龄和DBP在2组间均无显著差异。
表1 糖尿病组与对照组一般临床资料比较Table 1.Characteristics in type 2 diabetes group and control group()

表1 糖尿病组与对照组一般临床资料比较Table 1.Characteristics in type 2 diabetes group and control group()
DM:type 2 diabetes mellitus;NC:normal control;BMI:body mass index;SBP:systolic blood pressure;DBP:diastolic blood pressure.*P <0.05 vs NC group.
Group n Sex(male/female) Age(year) BMI(kg/m2) SBP(mmHg) DBP(mmHg)DM 88 47/41 48.35 ±9.45 25.51 ±5.03* 144.10 ±14.67*.20 80.37 ±11.1083.43 ±10.33 NC 53 31/22 44.59 ±10.02 22.71 ±4.24 133.63 ±18
2 2组生化指标的比较
如表2所示,DM组患者HbA1c和TC水平高于NC组(P<0.05),HDL-C水平低于 NC组(P<0.05),TG和LDL-C 2组间无显著差异。
表2 糖尿病组与对照组生化资料比较Table 2.Biochemical parameters in type 2 diabetes group and control group()

表2 糖尿病组与对照组生化资料比较Table 2.Biochemical parameters in type 2 diabetes group and control group()
HbA1c:glycated hemoglobin A1c;TC:total cholesterol;TG:triglyceride;HDL-C:high-density lipoprotein cholesterol;LDL-c:low- density lipoprotein cholesterol;ET -1:endothelin -1;NO:nitric oxide.*P <0.05,**P <0.01 vs NC group.
Group n HbA1c(%) TC(mmol/L) TG(mmol/L) HDL-C(mmol/L) LDL-C(mmol/L)DM 88 7.71 ±1.80** 5.31 ±0.64* 1.52 ±0.61 1.04 ±0.47*2.98 ±0.853.08 ±0.76 NC 53 6.12 ±0.73 4.97 ±0.68 1.46 ±0.97 1.28 ±0.32
3 各组听力损害与血浆ET-1和血清NO水平比较
如表3所示,DM组ET-1水平高于NC组(P<0.01),DM 组 NO 水平低于 NC 组(P <0.01)。DM-HI组(阈值>25 dD)与DM-NoHI组(阈值≤25 dB)比较,发现在糖尿病伴听力损害患者中血浆ET-1水平增高(P<0.01),血清NO水平下降(P<0.05),差异显著。对照组中,NC-HI组(阈值>25 dB)的血浆ET-1较NC-NoHI组显著升高 (P<0.05),2组血清NO无显著差异。
表3 糖尿病组与对照组中听力损害与正常听力对象血浆ET-1和血清NO水平的比较Table 3.Comparison of plasma endothelin-1 and serum nitric oxide between hearing impairment and non-hearing impairment in diabetic group and control group()
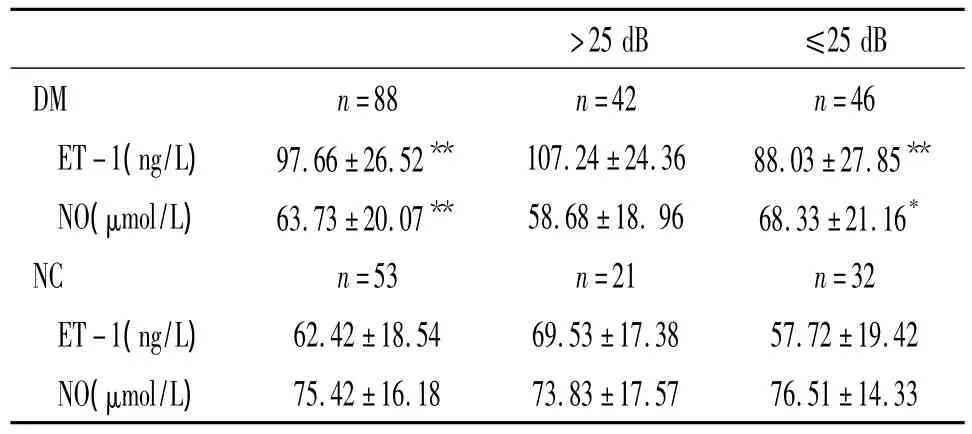
表3 糖尿病组与对照组中听力损害与正常听力对象血浆ET-1和血清NO水平的比较Table 3.Comparison of plasma endothelin-1 and serum nitric oxide between hearing impairment and non-hearing impairment in diabetic group and control group()
>25 dB:hearing impairment;≤25 dB:non-hearing impairment;ET -1:endothelin-1;NO:nitric oxide.*P <0.05,**P <0.01 vs NC group.
>25 dB ≤25 dB DM n=88 n=42 n 75.42±16.18 73.83±17.57 76.51±14.33=46 ET-1(ng/L) 97.66±26.52** 107.24±24.36 88.03±27.85**NO(μmol/L) 63.73±20.07** 58.68±18.96 68.33±21.16*NC n=53 n=21 n=32 ET-1(ng/L) 62.42±18.54 69.53±17.38 57.72±19.42 NO(μmol/L)
4 糖尿病听力损害多因素logistic回归分析
以糖尿病患者听力损害与否为因变量,以年龄、SBP、DBP、TC、TG、LDL - C、HDL - C、HbA1c、ET -1和NO共10个因素作为自变量,经多因素logistic回归分析,结果发现 HbA1c(OR=4.525,95%CI:1.104-8.311,P <0.05)、LDL - C(OR=2.381,95%CI:1.047-5.095,P <0.05)、ET -1(OR=6.207,95%CI:1.600-17.585,P <0.01)和 NO(OR=0.862,95%CI:0.553-0.941,P <0.05)进入模型。结果提示,高HbA1c、LDL-C、ET-1水平以及低NO水平是糖尿病听力损害的危险因素。
讨 论
目前已有许多研究发现糖尿病相关的听力损害大都表现为双侧进展性感音神经性耳聋,可为耳蜗性聋或蜗后性聋或二者兼而有之[1]。本研究选择不伴视网膜、肾脏微血管及神经并发症的糖尿病患者作为研究对象,发现糖尿病患者在发生其它相关并发症之前已经出现听力损害,与文献报道一致[3]。因而推测糖尿病听力学的检测较其它糖尿病并发症的检测手段,如眼底摄片、尿微量白蛋白、神经系统检查等,可能更早地发现听力损害这一糖尿病相关并发症。
本研究结果显示血糖控制不良是糖尿病听力损害发生的重要危险因素,这与糖尿病其它相关并发症发病特点相似,并与国内外相关研究报道一致[4,5]。此外,经多因素分析显示高 LDL - c 水平是糖尿病听力损害的独立危险因素。Xu等[6]发现氧化低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)通过活性氧簇(reactive oxygen species,ROS)的累积刺激ERK的磷酸化,进而血管内皮转录因子活化蛋白-1和ET-1的表达分泌增加,导致微循环障碍。另外,有动物实验证实高脂血症可能引起氧化/硝基化作用从而导致内皮功能障碍[7]。我们推测糖尿病合并高脂血症患者血液黏滞度显著增高及内皮功能损伤,加重内耳微循环障碍导致听力损害。
另外,我们的研究结果显示无论是否存在糖尿病,听力损害与血浆ET-1升高有关。Franz等[8]研究发现在内耳除Corti器的毛细胞外的其它细胞几乎均有ET-1与ET-3分布。其中血管纹的边缘细胞ET-1反应活跃,有学者推测在耳蜗外侧壁(血管纹)ET可能是一种调节肽,与NO、前列腺素、心钠素等相互作用,维持耳蜗微循环的正常及水电解质平衡。Scherer等[9]对离体的蜗轴螺旋动脉的研究发现ET-1与内皮素A受体(endothelin A receptors,ETA-R)作用,通过磷脂酶C及IP3受体介导肌浆网Ca2+的释放,使血管产生收缩反应,尤其是诱导耳蜗侧壁螺旋韧带毛细血管收缩,从而影响耳蜗微循环。此外,本研究发现糖尿病组血浆ET-1水平高于对照组,血浆ET-1的升高在糖尿病听力损害组中尤为显著。目前针对ET-1与糖尿病微血管并发症的关系研究揭示了ET-1在糖尿病微血管并发症病理进程中起重要作用[10]。结合上述机制研究,我们推测高糖状态可能诱导耳蜗脉管系统内皮细胞ET-1 mRNA表达增加,使耳蜗毛细血管收缩,血流下降,从而促使糖尿病听力损害的发生发展。因此糖尿病早期伴听力损害患者ET-1水平的增高提示可能已存在耳蜗微循环障碍。
本研究另一结果是血清NO是糖尿病听力损害的重要的保护因素。新近报道包括NO在内的多项氧化应激指标与糖尿病患者听力损害发生密切相关,这与我们研究结果相一致[3]。内源性NO是由L-精氨酸(L-arginine,L-Arg)与O2在一氧化氮合酶(nitric oxide synthase,NOS)的作用下生成的[11]。NO是具有神经递质样作用的自由基,通过可溶性鸟苷酸环化酶(guanylate cyclase,GC),使靶细胞内cGMP水平增高而发挥作用。目前诸多糖尿病慢性血管并发症的研究均提示在糖尿病进程中NO合成受损导致内皮依赖的血管舒张功能障碍[12]。目前已知NOS广泛分布于内耳的内皮细胞、神经细胞、毛细胞等。生理状态下NO在内耳血流调节、局部水电解质平衡及神经信号传递等方面起重要作用,病理条件下NO则可能参与局部组织炎症反应等病理过程[13]。目前有研究发现来自耳蜗血管壁的NO产物能够调节耳蜗血管血流[3]。因此,血清NO水平的下降可能同样预示糖尿病患者存在耳蜗血管循环障碍所致听力损害。
综上所述,本研究通过对尚未合并糖尿病视网膜、肾脏及神经病变的糖尿病患者研究发现在糖尿病上述相关并发症发生之前已经存在与可能糖尿病相关的听力损害。高HbA1c、LDL-c水平、血浆ET-1水平以及低血清NO水平可能参与糖尿病伴听力损害的发病机制。因此,我们推测糖尿病微循环障碍更早地发生于耳蜗,表现为听力损害。同时本研究结果也提示临床医务人员在糖尿病患者中应进行早期听力筛查,严格控制血糖血脂水平,使用改善血管内皮功能的药物可能延缓糖尿病伴听力损害患者听力下降。
[1]Hirose K.Hearing loss and diabetes:you might not know what you're missing[J].Ann Intern Med,2008,149(1):54-55.
[2]Díaz de León - Morales LV,Jáuregui- Renaud K,Garay-Sevilla ME,et al.Auditory impairment in patients with type 2 diabetes mellitus[J].Arch Med Res,2005,36(5):507-510.
[3]Aladag I,Eyibilen A,Guven M,et al.Role of oxidative stress in hearing impairment in patients with type two diabetes mellitus[J].J Laryngol Otol,2009,123(9):957 -963.
[4]樊云霞,韩 峰,崔小康,等.老年2型糖尿病患者听力损害特征及相关因素分析[J].山东大学学报(医学版),2008,46(7):707 -709.
[5]Bainbridge KE,Cheng YJ,Cowie CC.Potential mediators of diabetes-related hearing impairment in the U.S.population:National Health and Nutrition Examination Survey 1999 -2004[J].Diabetes Care,2010,33(4):811 -816.
[6]Xu H,Duan J,Wang W,et al.Reactive oxygen species mediate oxidized low-density lipoprotein-induced endothelin-1 gene expression via extracellular signal-regulated kinase in vascular endothelial cells[J].J Hypertens,2008,26(5):956 -963.
[7]李 榕,王文清,张海锋,等.高血脂通过氧化/硝基化双重作用介导大鼠内皮功能失调[J].中国病理生理杂志,2010,26(8):1494 -1497.
[8]Franz P,Hauser-Kronberger C,Egerbacher M,et al.Localization of endothelin-1 and endothelin-3 in the cochlea[J].Acta Otolaryngol,1997,117(3):358 -362.
[9]Scherer EQ,Wonneberger K,Wangemann P.Differential desensitization of Ca2+mobilization and vasoconstriction by ETAreceptors in the gerbil spiral modiolar artery[J].J Membr Biol,2001,182(3):183 -191.
[10]Settergren M,Pernow J,Brismar K,et al.Endothelin-A receptor blockade increases nutritive skin capillary circulation in patients with type 2 diabetes and microangiopathy[J].J Vasc Res,2008,45(4):295 -302.
[11]陈 静,秦 炯,韩 颖,等.一氧化氮和内质网应激[J].中国病理生理杂志,2008,24(11):2272 -2275.
[12]Cohen RA.Role of nitric oxide in diabetic complications[J].Am J Ther,2005,12(6):499 -502.
[13]王 剑,邱建华.一氧化氮和心钠素对耳蜗血流的影响[J].中华耳科学杂志,2006,4(3):234-237.
