18-α甘草酸对大鼠四氯化碳慢性肝损伤的治疗作用
2011-08-01徐中南吴锡铭张喜全夏春光徐铭益陆伦根
徐中南,吴锡铭,王 佩,张喜全,夏春光,戴 峻,朱 玲,李 琨,曲 颖,徐铭益,陆伦根
(1.上海交通大学附属第一人民医院消化科,上海,200080;2.江苏正大天晴药业股份有限公司,江苏南京,210018;3.浙江省杭州市第六人民医院,浙江 杭州,310014)
许多研究表明甘草酸制剂具有较强的抗病毒、保护肝细胞、降低丙氨酸氨基转移酶(ALT)、天冬氨酸转移酶(AST)以及血清胆红素水平的作用。近来的研究显示它还具有明显的抗纤维化、抗氧化和抗细胞凋亡等功效[1]。因此在临床上被广泛应用于治疗多种原因所致的肝脏疾病。本文我们进一步观察了18-α甘草酸对大鼠四氯化碳慢性肝损伤的治疗作用,为临床应用提供更多的实验依据。
1 材料与方法
1.1 试剂
取18-α甘草酸(18α-glycyrrhetinic acid,18-α-GA,批号:20010306,江苏正大天晴药业股份有限公司),用0.9%氯化钠溶液分别制成每1 mL含2.5、5、10 mg的溶液,pH 为6.5~8.0,用4#垂熔漏斗过滤,灌装于10 mL安瓿中,熔封,105℃灭菌45 min。临用前用灭菌生理盐水稀释或直接应用。取四氯化碳(上海化学试剂公司)25 g,加入橄榄油(上海化学试剂公司)中溶解,加橄榄油至100 mL(W/V),将四氯化碳橄榄油溶液超声15 min。
1.2 实验动物
雄性SD大鼠110只,(160±10)g,清洁级(浙江省医学实验动物中心,合格证号:浙医实动单项准第2001001号)。实验期间所有动物除中毒后绝食20 h(自由饮水)外,其余时间均自由进食和饮水。
1.3 方法
将110只SD大鼠随机分为6组,正常对照组10只,其他5组每组20只。除阴性对照组外,其余所有动物均皮下注射25%CCl4橄榄油液2 mL/kg,每周2次,连续13周。药物治疗组于注射CCl4后第5周起分别腹腔注射18-α-GA 15、30、60 mg/kg(根据小鼠静脉注射18-α-GA LD50=586 mg/kg及预试验选择的治疗剂量约为LD50的1/10,1/20,1/40),阴性对照组和模型对照组腹腔注射同容积灭菌生理盐水,阳性对照组腹腔注射复方甘草酸[Stronger Neo Minophagen C,SNMC;深圳健安医药公司,批号:02119,中国药品注册证编号:X960546-(2);由0.2%甘草酸、0.1%半胱氨酸、2%甘氨酸组成,每1 mL相当甘草酸(甘草酸单铵)2 mg]SNMC 30 mL/kg,每日 1次,连续至第 13周,于末次给药 24 h后,处死动物,取血分离血清或血浆,测ALT、AST、总蛋白、白蛋白、球蛋白、A/G 比例、唾液酸、一氧化氮及透明质酸。每只动物取肝左叶两份,一份经液氮保存测定羟脯氨酸含量,另一份作病理切片,苏木精-伊红(HE)染色和银染法分别观察肝组织的炎症和纤维化的程度,病理组织学判断标准按Scheuor[2]推荐的方法,进行计数等级分析。实验结束后,实验动物死亡数在模型对照组、阳性对照组和低剂量治疗组均为10只,中剂量治疗组为11只,高剂量治疗组为9只。
2 结 果
2.1 18-α-GA对CCl4引起慢性肝损伤大鼠
血清ALT和AST的改变
取各组存活大鼠血清,用Hitachi 7060型全自动生化分析仪测定ALT和AST的活力,结果各组存活大鼠血清转氨酶水平均明显升高,模型对照组ALT增高幅度约为正常对照组的59倍,各治疗组均低于此水平,并呈剂量依赖(表1)。
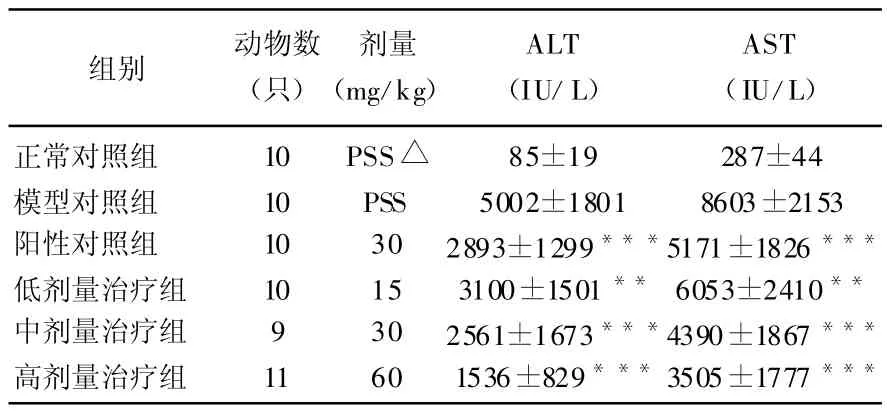
表1 18α甘草酸对CCl4引起慢性肝损害大鼠肝功能的影响
2.2 18-α-GA对CCl4引起慢性肝损伤大鼠血清蛋白的影响
各组存活大鼠血清经Hitachi 7060全自动生化分析仪测定总蛋白、白蛋白含量,A/G比例,结果各组白蛋白含量和A/G比例均明显低于正常对照组,治疗组血清白蛋白略高于模型对照组,差异有统计学意义,而总蛋白明显高于模型对照组,但A/G比例无明显提高,说明各组试验动物均明显存在肝组织间质炎症,治疗组肝脏实质损害程度比模型对照组轻,且代偿功能良好(表2)。

表2 18α-GA对CCl4慢性肝损伤大鼠血清蛋白的影响作用
2.3 18-α-GA对CCl4慢性肝损伤大鼠肝组织羟脯氨酸的影响
取各组经液氮贮存的肝组织称重(湿重),用蒸馏水制成10%的肝匀浆,按文献方法[3]测定羟脯氨酸含量,结果各组肝组织羟脯氨酸均有不同程度增加,其中模型对照组增加幅度为正常对照组的6倍,说明大鼠肝组织胶原合成处于增高水平,各治疗组羟脯氨酸含量低于模型对照组,并呈剂量依赖(图1)。
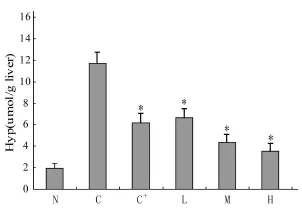
图1 各试验组大鼠肝组织羟脯氨酸含量(μ mol/g肝重)
2.4 18-α-GA对CCl4慢性肝损伤大鼠血清唾液酸的影响
取各组存活大鼠血清用硫代巴比妥法测定唾液酸(Sialic acid,NANA)含量[4],结果各组动物血清NANA含量均有明显增高,说明慢性肝损伤会影响肝组织对NANA的结合,使血清NANA含量升高,治疗组能提高肝细胞对NANA的结合能力,抑制血清NANA水平,并呈剂量依赖(图2)。
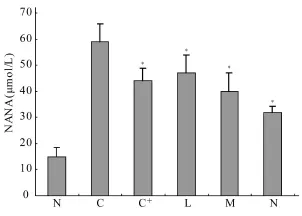
图2 各试验组大鼠血清唾液酸含量(μ mol/L)
2.5 18-α-GA对CCl4慢性肝损伤大鼠血清透明质酸的影响
取各试验组大鼠血清用放免法检测血清透明质酸(HA)的含量,试剂盒购自上海海医所,结果各试验组血清HA含量均明显高于正常组,模型对照组增高幅度为正常值的2倍,治疗组增高值低于模型对照组水平(图3)。
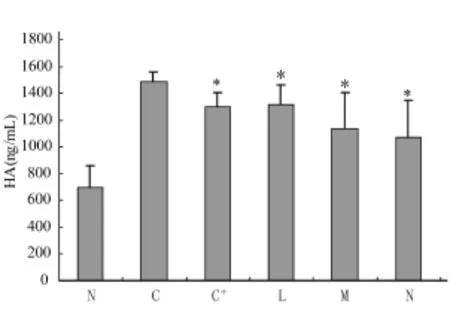
图3 各试验组大鼠血清透明质酸含量(ng/mL)
2.6 18-α-GA对CCl4慢性肝损伤大鼠血浆一氧化氮的影响
取各试验组存活大鼠血浆采用荧光分光光度法[5]测定一氧化氮(NO)浓度。根据一氧化氮与巯基化合物反应生成亚硝基硫醇,产生可测量的光学信号,并利用荧光物质的原级内滤效应(Inner filter effect)提高灵敏度,于岛津 RF-5301PC荧光分光光度计中测定荧光强度,按工作曲线计算NO浓度,结果各组慢性肝损伤大鼠血清NO浓度显著高于正常对照组,药物治疗组与模型对照组比较,差异均有统计学意义(图4)。
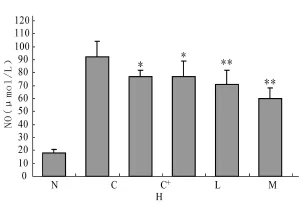
图4 各试验组大鼠血浆NO含量(μ mol/L)
2.7 18-α-GA对CCl4慢性肝损伤大鼠肝组织病理改变的影响
各试验组存活大鼠肝脏病理切片光学显微镜观察表明,模型对照组多数大鼠肝组织学改变为小叶内桥型坏死范围广并累及多个小叶呈多小叶坏死,纤维分隔形成伴小叶结构紊乱,形成早期肝硬化或肝硬化,70%大鼠出现严重皮脂囊肿;药物治疗组病理改变多为小叶内肝细胞变性、严重坏死,少数伴有桥型坏死(BN),部分大鼠肝组织汇管区周围轻度碎屑坏死(PN),小叶内肝细胞变性,点、灶状坏死,并可见嗜酸小体,汇管区周围纤维化,纤维分隔形成,但小叶结构保留,部分大鼠肝组织为分隔伴小叶结构紊乱,而无肝硬化,未见皮脂囊肿。
3 讨 论
作者前期完成的实验结果显示18-α-GA具有抑制肝星状细胞、促进肝细胞增殖的作用,在Fe-NTA诱导氧应激中它还具有抗脂质过氧化的作用,对肝脏细胞的损伤具有保护作用[6-7]。在此基础上,作者在动物水平进一步观察18-α-GA对大鼠四氯化碳慢性肝损伤的治疗作用。
以CCl4引起的慢性肝炎具有肝细胞坏死、炎症及纤维化的病理特征。本研究结果显示,18-α-GA可使肝组织学改变明显减轻,生化学上则反映为ALT和AST活力降低,血清总蛋白、白蛋白含量升高,表明18-α-GA对肝细胞有很好的保护作用。很多研究证实甘草酸制剂包括18-α-GA具有较强的糖皮质激素作用[8],糖皮质激素可以直接降低脯氨酰羟化酶的活力,抑制胶原的合成。因而推测,18-α-GA降低肝组织羟脯氨酸含量可能与以上作用有关。唾液酸是酸性糖与神经酰胺相连的寡糖,在体内与蛋白质形成糖蛋白,肝细胞膜上具有识别去唾液酸血浆蛋白、加强血浆蛋白分解的受体,肝硬化会影响肝细胞对去唾液酸糖蛋白的结合作用,后者与肝功能和肝纤维化有关。透明质酸是反映肝细胞功能及肝纤维化进程的实用指标,其升高幅度与肝纤维化改变成正相关。模型对照组大鼠血清唾液酸、透明质酸含量都明显升高,而18-α-GA均能抑制血清唾液酸及透明质酸,也反映18-α-GA具有改善肝功能,减轻肝纤维化的作用。CCl4引起的慢性肝炎为慢性氧化性肝损伤,其活性氧中间体被认为是重要致病因素,而内源性NO可与超氧阴离子等自由基反应生成低毒物质,对氧化性肝损伤具有保护作用,但同时NO与活性氧中间体反应可生成高毒性物质,而加重氧化性肝损伤。近年研究提示内源性NO可能介导肝硬化高动力循环,使血浆NO水平增高[9]。本试验模型对照组大鼠血清NO水平则明显增高,18-α-GA能降低NO水平,并呈剂量依赖,由于NO在肝内的作用与影响较复杂,具体机制尚需进一步阐明。此外,在本实验中发现模型对照组大鼠普遍出现严重皮脂囊肿,18-α-GA治疗组大鼠无一例出现皮脂囊肿,这些结果提示可能与18-α-GA的抗炎作用有关,具体机制有待进一步研究。
[1] 陈尉华,陆伦根.甘草酸在肝脏疾病中的应用[J].国际消化病杂志,2006,26(2):106.
[2] Scheuer PJ.T he nomenclature of chronic hepatitis:time for a change[J].J Hepatol,1995,22(1):112.
[3] 李文才,张锦生,李 华,等.肝组织羟脯氨酸含量测定方法的优化[J].上海医科大学学报,2000,27(4):295.
[4] Warren L.The thiobarbituric acid assay of sialic acids[J].J Biol Chem,1959,234(6):1971.
[5] Wei G.The determination of NO and NO synthetase in the rat by spectroflurometric method[J].Acta Pharm Sin,1996,31(7):530.
[6] 陈尉华,徐中南,陆伦根,等.异甘草酸镁对培养肝细胞增殖影响的实验研究[J].肝脏,2006,11(1):15.
[7] 陈尉华,陆伦根,曾民德,等.异甘草酸镁对大鼠肝星状细胞增殖和氧应激的影响[J].中华肝脏病杂志,2006,14(6):426.
[8] Amagaya S,Sugishita E,Ogihara Y.Comparative studies of the stereoisomers of glycy rrhetinic acid on anti-inflammatory activities[J].J Pharm Dyn,1984,7(12):923.
[9] Guarner C,Sorino G,Tomas A.Increased serum nitric oxide levels in patients with cirrhosis:relationship to endotoxemia[J].Hepatology,1993,18(5):1139.
