氯胺酮雾化吸入对哮喘大鼠气道反应性和炎症的影响
2011-08-01徐玉民孙灿林谢国柱傅诚章
徐玉民,孙灿林,谢国柱,傅诚章
(1.江苏省泰州市人民医院麻醉科,江苏泰州,225300;2.南京医科大学第一附属医院麻醉科,江苏南京,210029)
哮喘是一种以嗜酸性粒细胞浸润为主,多种炎症细胞参与的慢性气道炎症性疾病[1],嗜酸性粒细胞是过敏性及内源性哮喘的标志物,它释放众多细胞因子,在过敏性哮喘中发挥重要作用,IL-13可活化嗜酸性粒细胞,延长嗜酸性粒细胞存活时间并呈浓度依赖关系,在哮喘气道炎症和气道高反应发病机制中起着重要作用。氯胺酮是临床常用的静脉麻醉药,一些研究表明[2-3],氯胺酮具有抗炎、舒张支气管平滑肌的作用,本文旨在探讨氯胺酮雾化吸入对哮喘大鼠气道高反应性和气道炎症的影响。
1 材料和方法
1.1 材料
雄性Brown Norway大鼠(北京维通利华实验动物技术有限公司),10~12周龄,体重280 g~320 g,SPF级;鸡卵蛋白(OVA,美国Sigma公司,V级)、灭活百日咳杆菌菌苗(北京市中国药品生物制品检定所);盐酸氯胺酮注射液(江苏恒瑞医药股份有限公司);氯乙酰胆碱(上海三爱思试剂公司)。超声雾化器(德国Boehringer Ingelheim公司),动物肺功能体描箱、呼吸机及AniRes2003分析软件(北京贝兰博科技有限公司),大鼠IL-13酶联免疫吸附检测试剂盒(美国Biosource公司)。
1.2 哮喘模型建立及氯胺酮雾化吸入
将40只大鼠随机分成5组,分别为对照组(C组),哮喘模型组(A组),氯胺酮1组(K1组),氯胺酮2组(K2组),氯胺酮 3组(K3组),每组8只。
致敏阶段:在第0天和第7天,各组大鼠在胸部皮下注射0.1%卵蛋白加氢氧化铝100mg PBS混合液1 mL,同时腹腔注射1 mL灭活百日咳杆菌菌苗(6×109)致敏。激发阶段及氯胺酮雾化吸入:各实验组每日雾化吸入液体量为50 mL,用时30 min。A 组于第 14、16、18、20、22、24、26 天 ,雾化吸入 PBS, 于第 15、17、19、21、23、25、27 天雾化吸入1%卵蛋白PBS混合液。K1、K2、K3组于第 14、16、18、20、22、24、26、28 天分别雾化吸入浓度为12.5、25.0、50.0 mg/mL氯胺酮 PBS混合液,于第 15、17、19、21、23、25、27 日雾化吸入 1%卵蛋白进行激发。C组从第14天起每日雾化吸入PBS,连续两周。在最后1次激发后24 h测定气道反应性。
1.3 大鼠气道反应性激发检测
大鼠用1%戊巴比妥钠(50 mg/kg)腹腔注射麻醉,行气管切开插管、颈外静脉穿刺置管,放入密闭的体描箱中,连接小型动物呼吸机行辅助通气,动物呼吸机参数设置为:呼吸频率80次/min,吸呼比为1.0 1.5,初始潮气量为10 mL/kg。每只大鼠分别给予成倍增加的ACH(0、50、100、200 μ g/kg),每次进液量 200 μ L, 两个相邻给药点间隔5 min。采用AniRes2003动物肺功能分析系统测定呼气阻力(expiratory resistance,Re)。
1.4 支气管肺泡灌洗液(BALF)检测
气道反应性测定后即刻行肺灌注,用PBS缓冲液8 mL分3次于气管插管处注入,缓慢冲洗右肺,并用手指轻轻按摩肺组织,反复抽吸6次后回收BALF,回收率约80%,BALF收集在EP管中,1 500 r/min离心15 min,取上清液分装于EP管中,-80℃冰箱保存,采用ELISA法测定BALF中IL-13的浓度,具体步骤严格按试剂盒操作说明书进行。沉淀用台盼蓝拒染检测显示活细胞占95%以上,用瑞氏一吉姆萨染色法作细胞分类计数。
2 结 果
2.1 各组大鼠气道反应性变化
各组不同浓度ACH激发后Re增长率见表1。在 ACH 浓度为 50、100、200 μ g/kg 时 K1、K2、K3组与A组Re的增长率差异有统计学意义(P<0.05),与C组Re的增长率差异无统计学意义(P>0.05);在 ACH 浓度为 200 μ g/kg时 K1、K2、K3组与C组Re的增长率差异有统计学意义(P<0.05);各ACH 浓度下K1、K2、K3组之间差异无统计学意义(P>0.05)。

表1 各组不同剂量ACH给药后Re增长率的比较(%)
2.2 各组大鼠BALF中细胞总数及分类计数的比较
与C组相比较,A组BALF中总细胞数、嗜酸细胞和淋巴细胞百分比明显增高,差异有统计学意义(P<0.01)。与A 组相比,K1、K2、K3组的BALF中总细胞数分别下降46%、53%、41%,差异有统计学意义(P<0.01),K1、K2、K3组BALF中嗜酸细胞和淋巴细胞百分比明显下降,差异有统计学意义(P<0.05,表2)。
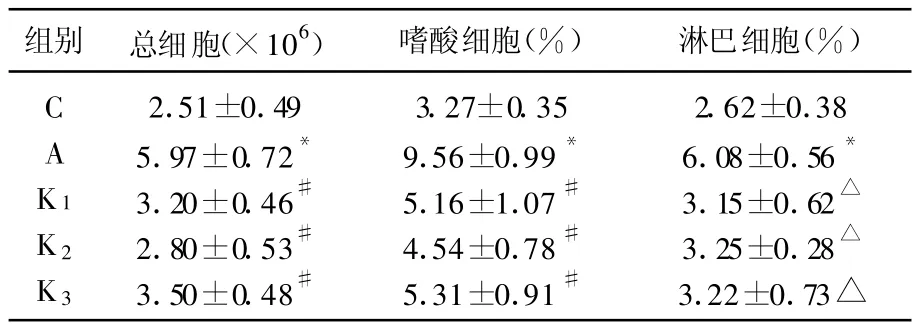
表2 各组BALF中细胞总数及分类计数百分比的比较(%)
2.3 各组大鼠BALF中IL-13浓度的比较
A组肺泡灌洗液IL-13的浓度与C组比较明显升高(P<0.05)。K1组、K2组、K3组BALF IL-13的浓度和A组比较明显降低(P<0.05),K1组、K2组、K3组之间比较两组 BALF IL-13的浓度差异无统计学意义(P>0.05,表3)。
表3 大鼠BALF中IL-13浓度的比较(pg/mL,±s)
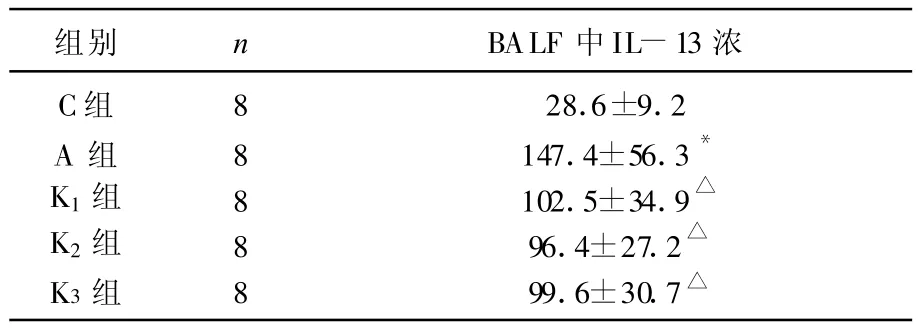
表3 大鼠BALF中IL-13浓度的比较(pg/mL,±s)
与C 组相比:*P<0.05;与A 组相比:P<0.05。
组别 n BALF中IL-13浓C组 8 28.6±9.2 A 组 8 147.4±56.3*K1组 8 102.5±34.9K2组 8 96.4±27.2K3组 8 99.6±30.7
3 讨 论
哮喘的发病机制复杂,至今未能完全明确,已有的研究倾向于哮喘是一种由多种细胞(如嗜酸性粒细胞、T淋巴细胞、肥大细胞、气道上皮细胞)及细胞组分参与的慢性非特异性气道炎症,气道炎症、气道高反应性(AHR)与气道重构是哮喘的重要病理变化[4]。气道炎症的形成和持续存在,引起了支气管收缩、血浆外渗、黏液分泌、神经系统的激活和气道高反应性,同时还刺激成纤维细胞和平滑肌细胞的增殖,造成管壁增厚,管腔狭窄,产生持续性的气道高反应性和不可逆性气流阻塞,使哮喘慢性化、顽固化甚至肺功能下降。细胞因子已经证实通过直接与选择性募集和激活炎症细胞在气道中发挥破坏作用而导致炎症发生,白细胞介素-13(IL-13)是近年来最受重视的Th2细胞因子,是由活化的肥大细胞、Th2型细胞和自然杀伤细胞分泌,和IL-4具有高度的同源性。在气道平滑肌和杯状细胞的表面存在大量的IL-13受体,IL-13与其受体结合后表现为气道的反应性增高、黏液分泌增多、平滑肌细胞的增生肥大及结构的改变(气道重建),同时分泌嗜酸性细胞趋化因子,促进了嗜酸性细胞向病变部位聚集,使气道炎症加重。文献报道[5]IL-13对哮喘及过敏性气道炎症的发生发展起重要作用,它是引起气道炎症反应,杯状细胞增生,气道高反应性及上皮下纤维化的始动因子。
气道高反应性是支气管哮喘公认的基本特征之一,也是哮喘发生发展的重要因素,AHR和哮喘的严重程度呈正相关,能否降低AHR是治疗效果的重要指标[6]。目前AHR发生的确切机制尚不明确,但是气道炎症是引起AHR的重要原因的理论已受到人们的重视,有研究认为IL-4、IL-13在AHR的发生中起关键作用[7-8],本实验中也显示哮喘组大鼠IL-13相比对照组升高。
氯胺酮可以通过抑制副交感神经的活性而扩张气道,被推荐用于支气管哮喘患者的麻醉[9-10];Allen等[11]研究发现氯胺酮可以防止重症哮喘的恶化,改善哮喘患者的肺功能,在临床上常用于治疗重症和持续状态的哮喘;离体实验中氯胺酮具有直接舒张支气管平滑肌的作用,Brown等[12]在研究中发现,临床使用浓度的氯胺酮能明显抑制电场刺激迷走神经引起的气道阻力。氯胺酮具有明显的抗炎作用,氯胺酮具有抑制活化的中性粒细胞的功能,它可抑制中性粒细胞在趋化因子的作用下穿透内皮细胞的活动;Kawasaki等[13]研究发现,在脂多糖活化的人全血细胞中应用氯胺酮,可明显抑制TNF-α、IL-6、IL-8的产生。Yu等[14]研究认为,静脉应用氯胺酮可以抑制脂多糖诱导的外周血单核细胞NF-к B的活化和TNF-α的产生,氯胺酮局部应用可产生抑制炎症细胞的黏附、减少白蛋白的外渗等抗炎效应。雾化吸入疗法具有独特的药动学原理和良好的药效学表现,是目前哮喘治疗的最佳途径之一。
本研究结果显示氯胺酮雾化吸入治疗可明显降低哮喘大鼠肺泡灌洗液中总细胞数、嗜酸细胞和淋巴细胞数,降低IL-13的浓度,说明其可以减轻哮喘大鼠的气道炎症,同时其也能降低哮喘大鼠ACH激发后的气道阻力,降低气道反应性,改善哮喘症状,为临床治疗哮喘尤其是难治性哮喘提供一个很好的思路。
[1] Wardlaw A J,Brightling C,Green R,et al.Eosinophils in asthma and other allergic diseases[J].Br Med Bull,2000,56(4):985.
[2] 田伟千,傅诚章,朱敏敏,等.雾化吸入氯胺酮对哮喘大鼠肺组织一氧化氮及一氧化氮合酶的影响[J].实用临床医药杂志,2007,11(1):16.
[3] Sato T,Hirota K,Matsuki A.The role of the N-methyl-D-aspartic acid receptor in the relaxant effect of ketamine on tracheal smooth muscle[J].Anesth Analg,1998,87(6):1383.
[4] Nadel J A,Busse W W.Asthma[J].Am J Respir Care Med,1998,157(suppl):S130.
[5] Venkayya R,Lam M,Willkom M,et al.The Th2 lymphocyte products IL-4 and IL-13 rapidly induce airway hyperresponsiveness through direct effects on resident airway cells[J].Am J Respir Cell Mol Biol,2002,26(2):202.
[6] Louis R,Lau Lck,Bron Ao,et al.The relationship between airway inflammation and asthma severity[J].Am J Respir crit Care M ed,2000,161(1):9.
[7] Walter D M,McIntire J J,Berry G,et al.Critical role for IL-13 in the development of allergen-induced airway hyperreactivity[J].Immunol,2001,167(8):4668.
参考文献
[8] Eum S Y,Maghni K,Tolloczko B,et al.IL-13 may mediate allergen-induced hyperresponsiveness independently of IL-5 or eotaxin by effects on airway smooth muscle[J].Am J Physiol Lung Cell Mol Physiol,2005,288(3):L576.
[9] Sato T,Matsuki A,Zsigmond EK,et al.Ketamine relaxes airway smooth muscle contracted by endothelin[J].Anesth Analg,1997,84(4):900.
[10] Hirota K,Hashimoto Y,Sakai T,et al.In vivo spasmolytic effect of ketamine and adrenaline on histamine-induced airway constriction.Direct visualization method with a superfine fibreoptic bronchoscope[J].Acta Anaesthesiol Scand,1998,42(2):184.
[11] Allen J Y,Macias C G.The efficacy of ketamine in pediatric emergency department patients who present with acute severe asthma[J].Ann Emerg Med,2005,46(1):43.
[12] Brown R H,Wagner E M.Mechanisms of bronchoprotection by anesthetic induction agents[J].Anesthesiology,1999,90(3):822.
[13] Kawasaki T,Ogata M,Kawasaki C,et al.Ketamine suppresses proinflammatory cytokine production in human whole blood in vitro[J].Anesth Analg,1999,89(3):665.
[14] Yu Y,Zhou Z,Xu J,et al.Ketamine reduces NFkappaB activation and TNF alpha production in rat mononuclear cells induced by lipopolysaccharide in vitro[J].Ann Clin Lab Sci,2002,32(3):292.
