60株鲍曼不动杆菌喹诺酮类耐药基因分析
2011-07-31马全玲魏殿军
曹 阳,马全玲,魏殿军,赵 猛
(天津医科大学第二医院,天津 300211)
近年来,多重耐药鲍曼不动杆菌引起感染的报道明显增多,由于该菌对常用抗菌药物耐药严重,临床治疗棘手,因此常造成医院内感染的暴发流行。以往认为造成细菌喹诺酮耐药的机制主要是靶位基因的变异、外膜孔蛋白通透性下降和外排泵的作用,以上机制均由染色体所介导。近年来,质粒介导的喹诺酮类耐药机制引起国内外学者广泛关注[1,2],但关于质粒介导的喹诺酮类耐药基因的发现几乎均存在于肠杆菌科细菌中,而在非发酵菌中质粒介导的耐喹诺酮基因仅有个别报道[3]。近期我们对天津地区2009年鲍曼不动杆菌喹诺酮类耐药基因情况进行了分析,旨在探究鲍曼不动杆菌喹诺酮类耐药的机制。
1 材料与方法
1.1 材料 2009年1~12月天津三所三级甲等医院各类临床标本,包括痰、血液、伤口分泌物等中分离的非重复鲍曼不动杆菌60株。质控菌株为大肠埃希菌 ATCC 25922,铜绿假单胞菌 ATCC 27853。质粒介导喹诺酮类耐药基因 qnrA、qnrB、qnrS、acc(6')-Ib-cr、qepA阳性对照株由上海华山医院抗生素研究所王明贵教授惠赠。
1.2 药物敏感试验 采用肉汤稀释法测定鲍曼不动杆菌各种药物的最低抑菌浓度(MIC),抗菌药物包括环丙沙星、头孢他啶、氧氟沙星、阿米卡星、头孢噻肟、头孢哌酮/舒巴坦、庆大霉素、头孢西丁、复方新诺明、亚胺培南、氯霉素、氨曲南、左氧氟沙星、美罗培南。判定标准参考CLSI 2009版规定。
1.3 喹诺酮类耐药基因检测
1.3.1 模板DNA提取 采取煮沸法。将临床分离鉴定的鲍曼不动杆菌接种到含有5 ml LB液体培养基的试管中,37℃震荡培养16~18 h,6 000 r/min离心10 min,弃去上清,沉淀用20 μl双蒸水涡旋混匀,95℃煮沸10 min,冰浴5 min,4℃ 12 000 r/min离心10 min,取上清与等量的氯仿(约200 μl)混匀,4℃ 12 000 r/min离心2 min,小心吸取上清,上清即为用于PCR扩增的模板,放于-20℃保存备用。
1.3.2 qnrA、qnrB、qnrS、qepA、acc(6')-Ib、gyrA 和parC基因扩增 ①引物设计:参照文献[4~7],PCR产物的大小分别为 580、617、427、509、548、343、327 bp。②PCR反应体系:总体积25 μl。其中 premix Taq 酶 12.5 μl,上下游引物各 1 μl,DNA 模板 3 μl,去离子水7.5 μl。试剂购自宝生物工程有限公司。qnrA、qnrB、qnrS、qepA、acc(6')-Ib 基因 PCR 循环参数:95℃预变性10 min,95℃变性1 min,55℃ 退火1 min,72℃延长1 min,循环35次,最后72℃延伸10 min。gyrA和parC基因扩增的循环参数:95℃预变性15 min;94 ℃ 30 s,55 ℃ 1 min,72 ℃ 1 min,循环30次;最后72℃延伸10 min。扩增产物用1.5%琼脂糖凝胶电泳。③parC和gyrA基因的酶切分析:取 10 × H buffer 2 μl,10 U/μl的内切酶 Hinf I 1 μl,PCR 基因扩增产物 10 μl,去离子水 7 μl,37 ℃ 水浴2 h,3%琼脂糖凝胶电泳。④测序分析:PCR阳性结果交由北京华大基因研究中心纯化并测序。采用美国国家信息中心(NCBI)在线分析工具Blastn程序进行分析,以确定耐药基因型或基因变异情况。
2 结果
2.1 鲍曼不动杆菌的药物敏感性 鲍曼不动杆菌对环丙沙星、头孢他啶、阿米卡星、头孢噻肟、头孢哌酮/舒巴坦、庆大霉素、头孢西丁、复方新诺明、亚胺培南、氯霉素、氨曲南、美罗培南的耐药率分别为61.7%、41.7%、23.3%、41.7%、16.7%、33.3%、85%、45%、15%、71.7%、61.7%、15%。
2.2 qnrA、qnrB、qnrS、acc(6')-Ib、qepA 基因检测结果 qnrA、qnrB、qnrS和qepA基因PRC产物电泳结果均为阴性。acc(6')-Ib基因PCR产物12株阳性。见图1。
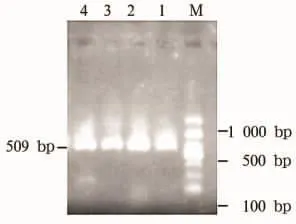
图1 acc(6')-Ib基因电泳图
2.3 acc(6')-Ib基因测序分析 未发现喹诺酮耐药变异基因acc(6')-Ib-cr。
2.4 gyrA和parC基因Hinf I酶切结果 PCR扩增gyrA基因均获得大小为343 bp的产物。经内切酶Hinf I酶切后,环丙沙星敏感菌的扩增产物均能被Hinf I酶切,产生291 bp和52 bp的2条片段;37株耐药菌中30株(81.0%)的扩增产物不能被Hinf I酶切,仍为343 bp。PCR扩增parC基因均获得大小为327 bp的产物。经内切酶Hinf I酶切后,敏感菌的扩增产物均能被Hinf I酶切,产生206 bp和121 bp的2条片段;37株耐药菌中26株(70%)的扩增产物不能被Hinf I酶切,仍为327 bp,见图2和图3。
2.4 gyrA和parC基因序列分析 未被酶切的耐药菌株gyrA基因,Hinf I酶切位点GAN TC中的C突变为T,导致喹诺酮决定区(QRDR)第83位(相应于大肠埃希菌)的丝氨酸被亮氨酸取代,而消失了酶切位点(GAN TC)。未被酶切的耐药株parC基因,Hinf I酶切位点GAN TC中的C均突变为T,造成QRDR第80位(相当于大肠埃希菌)的丝氨酸被亮氨酸取代。能被酶切的耐药菌株与敏感株的gyrA和parC基因均无突变。
3 讨论
不动杆菌属在医院分布广泛,是引起医院感染的常见病原菌,常从患者的呼吸道分泌物、尿液、血液等标本中分离出来,为条件致病菌,在非发酵菌感染中仅次于假单胞菌。鲍曼不动杆菌是临床最常见的不动杆菌,约占不动杆菌属的70%以上;医院感染近年来较多,且较为严重[8]。本研究中不乏多重耐药,甚至泛耐药株,应引起高度重视。
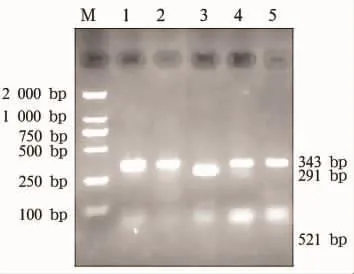
图2 gyrA基因PCR产物HinfⅠ酶切图
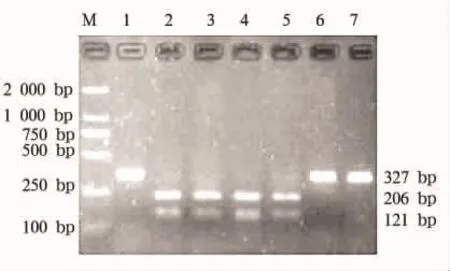
图3 parC基因PCR产物HinfⅠ酶切图
喹诺酮类药物是治疗不动杆菌感染的有效药物之一,具有良好的体外抗菌活性、组织渗透性等优点。但随着喹诺酮类药物的广泛应用,在临床分离出各种相应的耐药菌株,且耐药率逐渐上升,给临床治疗带来困难。研究表明,细菌对喹诺酮类药物产生的耐药机制较为复杂,主要涉及药物作用靶点改变、细菌外膜变化和药物的主动外排等方面。
本研究对临床分离的60株鲍曼不动杆菌可能存在的质粒介导的喹诺酮类耐药基因进行了PCR筛查,并未出现任何阳性结果。考虑筛查结果阴性的原因如下:首先,本次研究筛查的样本量偏小(60株),此应为主要原因,与国外相关报道一致[9];第二,由于目前为止在鲍曼不动杆菌等非发酵菌内发现质粒介导的喹诺酮类耐药基因仅有个别报道[3],说明质粒介导喹诺酮类耐药基因在非发酵菌中还不普遍;第三,本研究中PCR筛查所使用的引物均参考自肠杆菌相同耐药基因研究的文献,考虑肠杆菌与非发酵菌之间同源性方面存在较大差异,可能造成引物不能与目的基因互补,从而导致结果阴性;第四,天津地区关于质粒介导喹诺酮类耐药基因的报道仅见于本院感染研究所李红等[10]肠杆菌相关基因的研究,从侧面说明质粒介导喹诺酮类耐药基因在天津地区呈低流行趋势。
综上所述,染色体基因gyrA和parC的基因突变仍是鲍曼不动杆菌喹诺酮耐药的主要原因,而其他未发现染色体突变的耐药菌可能与主动外排泵或外膜变化相关。
[1]Jacoby GA,Chow N,Waites KB.Prevalence of plasmid-mediated quinolone resistance[J].Antimicrob Agents Chemother,2003,47(2):559-562.
[2]Wang M,Sahm DF,Jacoby GA,et al.Emerging plasmid-mediated quinolone resistance associated with the qnr gene in Klebsiella pneumoniae clinical isolates in the United States[J].Antimicrob Agents Chemother,2004,48(4):1295-1299.
[3]杨仁国,俞汝佳,高燕渝,等.临床分离鲍曼不动杆菌耐药性及qnr基因检测[J].中国抗生素杂志,2009,34(12):747-749.
[4]Cattoir V,Poirel L,Rotimi V,et al.Multiplex PCR for detection of plasmid-mediated quinolone resistance qnr genes in ESBL-producing enterobacterial isolates[J].J Antimicrob Chemother,2007,60(2):394-397.
[5]Teo JW,Ng KY,Lin RT.Detection and genetic characterisation of qnrB in hospital isolates of Klebsiella pneumoniae in Singapore[J].Int J Antimicrob Agents,2009,33(2):177-180.
[6]Jiang Y,Zhou Z,Qian Y,et al.Plasmid-mediated quinolone resistance determinants qnr and aac(60)-Ib-cr in extended-spectrum blactamase-producing Escherichia coli and Klebsiella pneumoniae in China[J].J Antimicrob Chemother,2008,61(5):1003-1006.
[7]Ma J,Zeng Z,Chen Z,et al.High prevalence of plasmid-mediated quinolone resistance determinants qnraac(6')-Ib-crand qepA among ceftiofur-resistant Enterobacteriaceae isolates from companion and food-producing animals[J].Antimicrob Agents Chemother,2009,53(2):519-524.
[8]尤佳女,王寅,马春芳.鲍曼不动杆菌的分离及其耐药性变迁[J].中国卫生检验杂志,2008,18(1):186-187.
[9]Robicsek A,Jacoby G,AHooper DC.The worldwide emergence of plasmid-mediated quinolone resistance[J].Lancet Infect Dis,2006,6(10):629-640.
[10]李红,宋诗铎,王玉宝,等.肠杆菌科临床株质粒介导的喹诺酮类耐药机制的研究[J].中华检验医学杂志,2007,30(11):1256-1259.
