一种简单经济的小鼠骨髓源性肥大细胞的培养与鉴定①
2011-07-30王春锋李济宇上海交通大学医学院附属新华医院普外科上海200092
王春锋 李济宇 (上海交通大学医学院附属新华医院普外科,上海200092)
过去对肥大细胞(Mast cell,MC)的研究多关注于其在超敏反应像支气管哮喘、接触性皮炎等疾病中的作用[1]。自从2006年LU等[2]首次发现肥大细胞缺陷小鼠难以诱导皮肤移植耐受,输注骨髓源性MC重建MC正常鼠移植耐受得以诱导,证明了肥大细胞在器官移植耐受中的关键作用[3]。MC参与免疫耐受的相关机制尚不明确,近年研究多关注其与调节性T细胞(regulatory T cells,Treg)的相互作用,且更多关注Treg对MC的作用,MC对Treg的研究较少,对其他免疫相关细胞的研究也较少[4,5]。体外获得大量高纯度的肥大细胞可以帮助我们更好的研究其在移植免疫耐受领域的作用。然而骨髓来源的MC所需培养时间较长,需要在特定细胞因子下诱导分化,所需的费用较高,因此,本研究通过采取七天换液的方式来观察是否可以获得同样高纯度的MC。
1 材料与方法
1.1 实验动物 BALB/c小鼠8~10周龄,清洁级,购于上海斯莱克实验动物有限责任公司,许可证号:SCXK(沪)2007-0005。
1.2 主要试剂 小鼠重组IL-3、SCF(Peprotech);RPMI1640培养基、胎牛血清FBS、非必需氨基酸(Invitrogen);PE-CD117、FITC-FCεR Ⅰα(eBioscience)、PE-murine control mIgG1(eBioscience);甲苯胺蓝(上海源叶生物科技有限公司)。
1.3 小鼠骨髓来源肥大细胞的获得 取小鼠的股骨,剔除其肌肉组织,剪断两端骨骺,用1 ml注射器抽取RPMI1640培养基,将骨髓细胞冲出,直至骨髓腔变白,加入到培养体系中,培养体系含RPMI1640、10%胎牛血清、青链霉素各100U/ml、50μmol/L非必需氨基酸、10 ng/ml rmIL-3(recombinant murine IL-3)、10 ng/ml rmSCF(recombinant murine SCF)。
1.4 小鼠骨髓来源肥大细胞的培养 将上述细胞按照106ml-1接种于六孔板中,每孔3 ml培养基,置于37℃5%CO2的培养箱中培养,每七天将悬浮细胞按照106ml-1转移到新的培养板中继续培养,4~6细胞分化成熟,四周后收集细胞进行鉴定,分别从形态学、功能学两方面来验证所获得的细胞为肥大细胞。
1.5 肥大细胞的鉴定
1.5.1 形态学鉴定 主要是通过光镜下观察细胞形态、电镜下观察细胞内部结构,以及借用于流式细胞仪来观察细胞表面CD117和FCεRⅠα的表达。具体方法为六周后收集培养细胞,离心,PBS重悬,调整细胞浓度为106ml-1,每管取100μl,分别加入0.5 μl的PE-CD117,0.2μl的FITC-FCεRⅠα,其中双染的同时加入两种抗体,阴性对照组加入PE-mIgG1,4℃避光孵育30分钟,用PBA(含 2.5%FBS的PBS)洗两次,上机检测。
1.5.2 功能学鉴定 肥大细胞的甲苯胺蓝染色:六周后将细胞悬液滴到防脱片(包被有多聚赖氨酸)上,超净台内风干,用1%pH7.4的甲苯胺蓝染液染约30秒,用95%的酒精分色,双蒸水洗涤后,于光镜下观察。
2 结果
2.1 光镜下肥大细胞生长状态的观察以及四周后光镜下的肥大细胞 培养48小时后开始出现贴壁细胞,为长梭形,视野中可见大小不一的悬浮细胞,随着换液次数的增加,贴壁细胞越来越少,悬浮细胞逐渐增多,变为大小、形状、分布均匀具有折光性的细胞,高倍镜下(10×40)可以看见胞膜边缘有丝状突起。四周以后这种大小均一的折光性细胞占95%以上,见图1。
2.2 透射电镜下观察肥大细胞 电镜下发现肥大细胞胞体大部分呈椭圆形或不规则形,表面有伪足,胞内含有丰富的细胞器,如线粒体、游离核糖体、高尔基复合体等,胞浆内充满大量高电子密度颗粒,有些肥大细胞在未受任何刺激的情况下也会发生脱颗粒,可见大量脱颗粒后的空泡(如图2D)。镜下可见明显的核仁,异染色质附于核膜下,见图2。
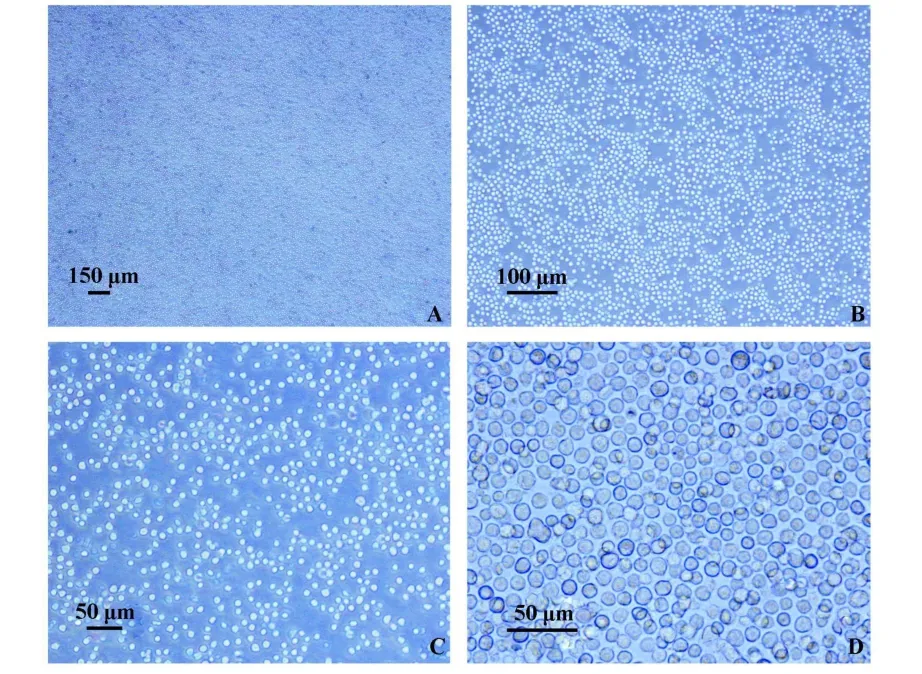
图1 培养四周后光镜下的肥大细胞Fig.1 Characteristic of mast cells after 4 weeks'cultureunder light microscope
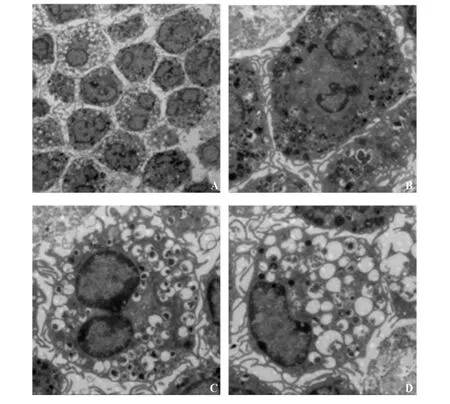
图2 不同倍数电镜下的骨髓来源肥大细胞Fig.2 Characteristic of mast cells after 4 weeks'cultureunder transmission electron microscope

图3 流式细胞仪检测骨髓来源肥大细胞的表面 CD117和FCεRⅠα的表达Fig.3 CD117 and FCεRⅠαexpression on mast cell surface by flow cytometry analysis

图4 骨髓来源肥大细胞的甲苯胺蓝染色Fig.4 Toluidine bluestaining of bone marrow mast cells
2.3 流式细胞仪监测分析肥大细胞 四周后收集肥大细胞,应用流式细胞仪检测表面分子CD117和FCεRⅠα的表达情况,单阳性表达CD117和FCεRⅠα的细胞达到90%以上,见图3A、B,双阳性表达这两种表面分子的细胞达81%,见图3C。
2.4 肥大细胞的甲苯胺蓝染色 培养四周后,用甲苯胺蓝染色,可以观察到细胞质被染成紫红色,胞核染成蓝色。证实该细胞有吞噬甲苯胺蓝的特性,所获得的细胞为肥大细胞,见图4。
3 讨论
IL-3和SCF都是肥大细胞分化和增殖所必需的细胞因子[6]。在骨髓前体细胞向肥大细胞的转化过程中,一方面,IL-3和SCF在诱导转化过程中发挥着关键作用;另一方面,肥大细胞作为悬浮细胞的特性进一步将其与骨髓中的其他细胞(大部分为贴壁细胞)纯化开来。很多研究认为在肥大细胞的培养过程中每四天换液可以获得较纯化的细胞[7]。而我们的研究发现,在四周左右时七天换液的细胞较四天换液的细胞纯度更高(CD117、FCεRⅠα双阳性率更高),而细胞的生存活力和细胞数目没有明显的差异。分析原因可能是肥大细胞作为悬浮细胞对培养基更换的频率没有那么高,再者肥大细胞的寿命比较长,一些贴壁细胞对培养基的要求较高,在七天的时间内大部分死亡,换液过程中纯化出了培养体系。通过这种方法,我们可以更经济、更快速的获得纯化的肥大细胞。这种方式获得的肥大细胞的寿命很长,一般培养十周左右细胞走向凋亡过程。
本研究通过将骨髓细胞直接冲出接种于培养基中,每七天换液的方式获得了大量CD117和 FCεRⅠα表达双阳性的细胞,即为肥大细胞。通过形态学和功能学两方面鉴定了培养所获得的细胞为肥大细胞,相对于四天换液明显节省了人力和财力,成为一种简单经济的体外获得大量肥大细胞的方法,可以更好的研究其在移植免疫领域的作用。
1 Gregory G D,Brown M A.Mast cells in allergy and autoimmunity:implication for adaptive immunity[J].Methods Mol Biol,2006;315(10):35-50.
2 LU L F,Lind E F,Gondek D C et al.Mast cells are essential intermediaries in regulatory T cell tolerance[J].Nature,2006;442(7106):997-1002.
3 Kashyap M,Thornton A M,Norton SK et al.Cutting edge:CD4 T cellmast cell interactions alter IgE receptor expression and signaling[J].J Immunol,2008;180(4):2039-2043.
4 Zhang W,Wu K,He W et al.Transforming growth factor beta 1 plays an important rolein inducing CD4+CD25+forhead box P3+regulatory T cells by mast cells[J].Clin Exp Immunol,2010;161(3):490-496.
5 Gri G,Piconese S,Frossi B et al.CD4+CD25+regulatory Tcells suppress mast cell degranulation and allergic responsesthrough OX40-OX40Linteraction[J].Immunity,2008;29(5):771-781.
6 Haig DM,Huntley J F,Mackellar A et al.Effectsof stem cell factor and interleukin-3 on the growth and serine proteinase expression of rat bonemarrow-derived or serosal mast cells[J].Blood,1994;83(1):72-83.
7 Norton S K,Barnstein B,Brenzovich J et al.IL-10 suppresses mast cell IgE receptor expression and signaling in vitro and in vivo[J].JImmunol,2008;180(5):2848-2854.
