三氧化二砷对胶原诱导的关节炎大鼠STAT/SOCS信号转导通路的影响①
2011-07-30张明峰周守勤刘淑霞彭晨星郭惠芳河北医科大学第二医院免疫风湿科石家庄050000
张明峰 周守勤 刘淑霞 彭晨星 郭惠芳 (河北医科大学第二医院免疫风湿科,石家庄050000)
类风湿关节炎(Rheumatoid arthritis,RA)是一种高度致残性疾病。采取有效措施控制滑膜组织增生是改善预后,延长患者寿命的关键所在。积极探索疗效可靠、毒副作用小、经济适用的缓解病情药物,也成为了各风湿病学者研究的重点课题之一。三氧化二砷(As2O3)在急性白血病和各类实体瘤的治疗中已取得了举世瞩目的成就,并已经应用于临床[1,2]。但其对风湿性疾病的治疗作用仍在探索之中。前期体外细胞培养研究显示,As2O3可通过抑制信号转导及转录活化因子(Signal transducer and activator of transcription,STAT)1信号转导通路,抑制高迁移率族蛋白1诱导的滑膜细胞增殖[3]。本研究借助胶原诱导的关节炎(Collagen-induced arthritis,CIA)大鼠模型进行动物实验,进一步探讨As2O3对滑膜增殖的抑制作用,以及对STAT和细胞因子信号传导抑制蛋白(Suppressor of cytokine signaling,SOCS)信号通路的影响,为将来As2O3应用于临床提供一定理论依据。
1 材料与方法
1.1 主要试剂与仪器 As2O3(黑龙江伊达药业公司生产);兔抗大鼠p-STAT1、p-STAT3单克隆抗体(Cell Signaling公司);SOCS1、SOCS3多克隆抗体、羊抗大鼠FITC-IgG二抗(Santa Cruz);小鼠抗大鼠PCNA单克隆抗体(北京中山生物工程公司),破膜剂(美国eBioscience公司);牛Ⅱ型胶原(美国Sigma公司);弗氏完全佐剂(美国Sigma公司);卡介苗(上海生物制品研究所);免疫组织化学SP试剂盒(生物晶美公司);Epics-XLⅡ型流式细胞仪(Beckman Coulter);光学显微镜(日本Olympus)。
1.2 动物模型制备及分组
1.2.1 实验动物 雄性Wistar大鼠42只,8~12周龄,体重(160±20)克,购于河北医科大学实验动物中心,清洁级动物室内养殖,室内定期进行紫外线照射,所用饲料、水及用具均经定期灭菌处理。室温控制在18~25℃,相对湿度20%~30%。
1.2.2 Ⅱ型胶原乳剂的制备[4]将Ⅱ型胶原溶于0.1 mol/L的醋酸中,在4℃下搅拌充分溶解,浓度为2 mg/ml,置4℃冰箱过夜。再与完全弗氏佐剂等体积混合,冰浴下用玻璃搅拌器匀速搅拌,至充分乳化,即乳化液滴入水中无消散,制成Ⅱ型胶原乳剂。
1.2.3 造模方法及分组 将42只Wistar大鼠随机分成五组,Ⅰ组为正常对照组6只,Ⅱ~Ⅴ组每组各9只用于造模,Ⅱ组为模型对照组,Ⅲ~Ⅴ组分别为低、中、高剂量As2O3治疗组。适应性喂养7天,第8天进行造模。每只大鼠的尾根部及背部多点皮内注射Ⅱ型胶原乳剂0.2ml初次免疫,第21天腹腔注射乳剂0.2 ml作为二次免疫,第22天开始,对Ⅱ~Ⅴ组大鼠进行关节炎指数评分[5],当总评分大于2分时,陆续开始干预治疗,每组给药6只,其余剔除,造模成功率约70%~80%。采用腹腔注射给药方法,连续28天。Ⅰ、Ⅱ组给予等体积的生理盐水,Ⅲ组:1.0 mg/(kg◦d)As2O3治疗,Ⅳ组:2.0 mg/(kg◦d)As2O3治疗,Ⅴ组:4.0 mg/(kg◦d)As2O3治疗。腹腔给药容量均为20 mg/kg。
1.3 关节标本采集及制作 第50天股动脉取血处死所有大鼠,完整剥离滑膜组织,一并取后肢踝、趾关节,充分剃去皮毛及肌腱组织,浸泡于4%的多聚甲醛中固定48小时后,浸于20%EDTA脱钙液中,室温脱钙,时间3~4周。由踝关节中间纵行剖开,一半用于流式细胞学检测,一半用于免疫组织化学检测。后者和滑膜组织(固定24小时)标本均按常规程序,脱水、透明、石蜡包埋,切片 4μm,贴于经多聚赖氨酸处理过的载玻片上,60℃烤片,48小时备用。
1.4 免疫组织化学检测关节组织中PCNA蛋白的表达 切片厚4μm,常规脱蜡水化,一抗为小鼠抗大鼠PCNA抗体(1∶100稀释),二抗分别为与一抗相对应的生物素化IgG(1∶100稀释),以PBS代替一抗作为阴性对照,DAB显色,光镜观察阳性信号。具体步骤按照说明书进行。
1.5 流式细胞术检测关节组织中PCNA、p-STAT 1/3、SOCS1/3蛋白的表达 将标本用网搓法制成单细胞悬液,取单细胞悬液 1×106ml-1,加入破膜剂,轻微震荡,孵育15分钟,离心弃上清;分别加入PCNA、p-STAT1/3、SOCS1/3抗体 100 μl(PCNA 抗体 1∶100稀释,p-STAT1/3、SOCS1/3抗体为 1∶50稀释),室温孵育30分钟,PBS洗涤后加入1∶50羊抗大鼠FITCIgG二抗工作液100μl,避光室温孵育30分钟,PBS洗涤后,在Epics-XLⅡ型流式细胞仪进行检测。设PBS代替一抗和二抗的阴性对照,以及只加一抗或二抗的阳性对照和同型对照。以荧光指数(FI)表示待测蛋白的相对含量,公式:FI=(样品蛋白表达的平均荧光强度-对照样品平均荧光强度)/正常对照样品平均荧光强度。
1.6 结果判定及统计学处理 免疫组织化学结果判定标准:PCNA蛋白阳性信号表达于细胞核内,呈棕黄色颗粒者为阳性。计量资料以±s表示,采用SPSS11.5统计软件进行 t检验、单因素方差(One-Way ANOVA)分析及Spearman相关分析,P<0.05认为差异有统计学意义。
2 结果
2.1 As2O3对大鼠关节炎的治疗作用 与模型组相比,低、中、高剂量As2O3组关节炎指数呈剂量依赖性下降(P<0.01),分别为8.75±1.25、6.19±1.27、3.86±0.44和3.23±0.51;中、高剂量显著优于低剂量组(P<0.01),见图1。
2.2 As2O3对关节组织PCNA蛋白表达的影响 免疫组织化学显示:正常对照组,滑膜衬里层散在滑膜细胞的胞核内可见棕黄色阳性颗粒,软骨细胞、血管内皮细胞均呈阴性表达;模型组可见大量PCNA蛋白表达阳性的滑膜细胞覆盖于软骨表面,并向软骨下侵蚀,浸润的炎细胞胞核内可见棕黄色颗粒,少数受损的软骨细胞内可见淡黄色阳性颗粒。随着As2O3治疗剂量的增加PCNA蛋白阳性的细胞数目明显减少(图2)。
流式细胞术结果显示:模型组PCNA蛋白表达显著增加,与正常对照组相比差异均具有统计学意义(P<0.01);As2O3治疗后,CIA大鼠关节组织中PCNA蛋白表达显著下降,接近正常水平(P<0.01,表1)。
2.3 As2O3对关节组织p-STAT1蛋白表达的影响 模型组关节组织中p-STAT1表达显著高于正常对照组(P<0.01);低、中剂量As2O3治疗4周,p-STAT1蛋白表达较模型组明显下降(P<0.01和 P<0.05),但仍高于正常对照组(图3、表1)。

图1 As2O3对CIA大鼠关节炎指数的影响Fig.1 The effect of As2O3 on MAI of CIA rats in different dose groug

图2 As2O3对 CIA大鼠滑膜组织中PCNA蛋白表达的影响(IHC,×400)Fig.2 The expression of PCNA protein in the synovium detected by IHC(×400)

图3 FCM检测AS2O3对滑膜组织中p-STAT1蛋白的表达的影响Fig.3 Histogram of p-STAT1 protein expression in the synovium detected by FCM
表1 As2O3对 CIA大鼠关节组织中PCNA、p-STAT1/SOCS1,p-STAT3/SOCS3蛋白表达的影响(±s,n=6)Tab.1 The effect of As2O3 on theexpression of PCNA,p-STAT1/SOCS1,p-STAT3/SOCS3 proteins of CIA rats articular tissues by FCM( ±s,n=6)

表1 As2O3对 CIA大鼠关节组织中PCNA、p-STAT1/SOCS1,p-STAT3/SOCS3蛋白表达的影响(±s,n=6)Tab.1 The effect of As2O3 on theexpression of PCNA,p-STAT1/SOCS1,p-STAT3/SOCS3 proteins of CIA rats articular tissues by FCM( ±s,n=6)
Note:One-Way ANOVA,1)P<0.05,2)P<0.01 vs normal control group;3)P<0.05,4)P<0.01 vsmodel control group.
Group PCNA p-STAT1 SOCS1 p-STAT3 SOCS3 Normal control 1.00±0.16 1.00±0.09 1.00±0.08 1.00±0.08 1.00±0.18 Model control 1.26±0.032) 1.27±0.082) 1.18±0.052) 1.27±0.112) 1.24±0.072)As2O3 treated group Low-dose group 1.10±0.104) 1.06±0.084) 1.12±0.031)3) 1.16±0.022)3) 1.18±0.041)Mid-dose group 0.99±0.054) 1.15±0.062)3) 1.17±0.112) 1.19±0.052) 1.21±0.08 High-dose group 1.04±0.094) 1.33±0.122) 1.23±0.102) 1.23±0.092) 1.20±0.111)

图4 FCM检测AS2O3对滑膜组织中SOCS1蛋白的表达的影响Fig.4 Histogram of SOCS1 protein expression in the synovium detected by FCM
2.4 As2O3对关节组织SOCS1蛋白表达的影响 模型组关节组织中SOCS1表达显著高于正常对照组(P<0.01);与模型组相比,低剂量组SOCS1蛋白表达减少(P<0.05),而剂量达 4 mg/(kg◦d)后,SOCS1蛋白表达增加,但无统计学意义(图4、表1)。
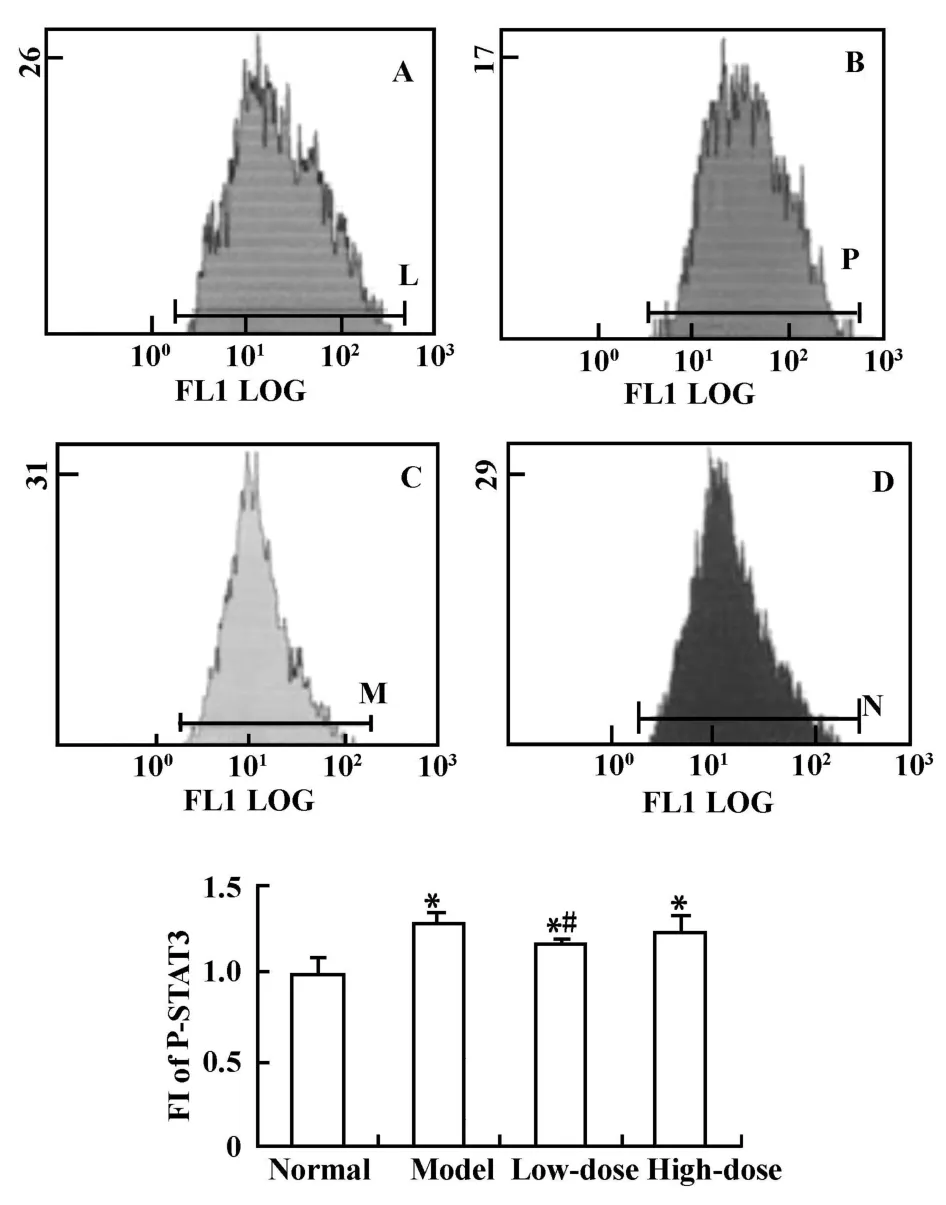
图5 FCM检测AS2O3对滑膜组织中p-STAT3蛋白的表达的影响Fig.5 Histogram of p-STAT3 protein expression in thesynovium detected by FCM
2.5 As2O3对关节组织p-STAT3蛋白表达的影响 模型组关节组织中p-STAT3表达显著高于正常对照组(P<0.01);低剂量As2O3治疗4周,p-STAT3蛋白表达较模型组下降(P<0.05),但仍高于正常对照组,而中、高剂量组蛋白表达变化与模型组相比差异无统计学意义(图5、表1)。
2.6 As2O3对关节组织SOCS3蛋白表达的影响 模型组关节组织中SOCS3表达显著高于正常对照组(P<0.01);不同剂量As2O3治疗组中,SOCS3蛋白表达量较模型组下降,但均无统计学意义(图6、表1)。

图6 FCM检测AS2O3对滑膜组织中SOCS3蛋白的表达的影响Fig.6 Histogram of SOCS3 protein expression in the synovium detected by FCM
2.7 相关性分析 低As2O3治疗CIA大鼠4周时,p-STAT1/3蛋白表达与PCNA表达成正相关,(r=0.413,P=0.045;r=0.427,P=0.023);高剂量治疗4周时,p-STAT1/3蛋白表达与PCNA表达无相关性,(r=0.252,P=0.179,r=0.313,P=0.116)。
3 讨论
CIA大鼠是目前研究RA发病机制运用较多的动物模型。本实验采用Wistar大鼠,通过牛Ⅱ型胶原联合弗氏完全佐剂诱发免疫反应,成功诱导了CIA动物模型,造模成功率在70%以上。基于白血病和肿瘤性疾病的研究成果,近年来,部分风湿病学者以As2O3治疗实验性关节炎[6,7],结果显示As2O3可以通过抑制滑膜细胞分化,诱导滑膜细胞凋亡,但As2O3的作用机制尚不清楚。
本实验首先应用免疫组织化学和流式细胞术两种方法,从定位和半定量的角度探讨了反映细胞增殖的标记物——增殖细胞核抗原(PCNA)的表达情况,模型组大鼠关节软骨表面、软骨下骨组织内均可见大量PCNA蛋白表达阳性的滑膜细胞浸润,同时炎细胞增生也显著增加,提示模型组大鼠滑膜组织已经出现高度侵蚀性增生。As2O3治疗后,PCNA蛋白在浸润的炎细胞、滑膜细胞中的表达均下降,说明As2O3能够显著抑制包括滑膜细胞在内的多种细胞的增殖。
STAT是一种能与靶基因调控区DNA结合的胞质蛋白家族,在人和哺乳动物中已发现7个STAT家族成员 :STAT 1 ~4 、STAT 5a、STAT 5b、STAT 6,能够介导多种细胞因子调控的细胞生长、分化、增殖及凋亡过程[8]。STATs作为转录因子在没有特异性的刺激时定位于胞质内,当细胞受到刺激时,STATs上的SH2结构域与细胞膜受体中被磷酸化的酪氨酸残基结合,同时自身发生磷酸化并迅速形成同源或异源二聚体,转运至细胞核内,与启动子结合,调节基因转录,完成细胞因子受体介导的信号转导,调节机体的天然免疫及获得性免疫应答反应。目前已知,STAT1和STAT3与RA滑膜炎严重程度密切相关。本研究结果也显示,模型组关节组织中p-STAT1/3表达显著增高,低剂量As2O3治疗4周,p-STAT1/3蛋白表达较模型组明显下降,并与PCNA表达呈正相关,而高剂量组其表达量有增加趋势,说明低剂量具有抑制滑膜细胞增殖的作用,而高剂量可能具有促进增殖的作用。既往研究也显示,4.0 mg/kg/d和6.0 mg/kg/d的As2O3治疗CIA大鼠两周,电镜下观察发现,关节A型滑膜细胞减少,B型滑膜细胞增加[9]。因此,As2O3治疗剂量和疗程的选择尚需进一步探讨。
细胞因子信号传导抑制蛋白(Suppressor of cytokine signaling,SOCS)家族是一类由细胞因子诱导产生并反馈性阻断细胞因子信号转导过程的负性调节因子,参与多种细胞因子、生长因子和激素的信号调节,对于维持机体内环境稳定起着重要的内源性调节作用[10,11]。SOCS通过与STAT竞争性结合细胞因子受体的酪氨酸磷酸化位点,对Janus激酶/STAT信号通路进行负反馈调节,减少多种细胞因子受体的表达而抑制细胞因子介导的信号传递。SOCS1是最早被发现的SOCS家族成员之一,SOCS1是STAT1的特异性内源性抑制剂。本研究发现,模型组p-STAT1的活性增强反馈性引起SOCS1表达增强,低剂量As2O3干预治疗后,p-STAT1表达减少,其反馈性调节作用减弱,SOCS1表达量相对减少;但是当高剂量治疗时,随着p-STAT1表达增加,再次激发SOCS1表达增加,推测低剂量As2O3可能通过干预p-STAT1/SOCS1信号通路抑制滑膜组织的增殖。SOCS3是STAT3的负性调节子。本实验中,模型组p-STAT3的活性增强也反馈性引起了SOCS3表达增强,低剂量As2O3干预治疗后,随着p-STAT3表达减少,SOCS3表达量也相对减少,但尚无统计学意义。由此看来,As2O3是否对p-STAT3/SOCS3信号通路有显著抑制作用尚需扩大样本量进一步研究。
综上所述,As2O3是抑制滑膜细胞增殖的良好药物,该药可通过调控p-STAT1信号通路抑制关节炎进展。但是,As2O3毕竟是一种剧毒物质,具有治癌和致癌双向作用。RA发病机制非常复杂,有多种细胞共同参与滑膜组织的增殖过程,As2O3在低剂量时具有抑制增殖的作用,高剂量可能具有促进细胞转化和原浆毒作用[12],因此,治疗时间和剂量的积累对于产生毒副作用都至关重要。如何在保证疗效的前提下,最大限度的降低毒副作用尚需深入探讨。是否可以通过改变给药方式,减轻体内蓄积产生的毒副作用,亦有待进一步研究。
1 张 鹏,王树叶,胡龙虎 et al.三氧化二砷治疗急性早幼粒细胞白血病七年总结—附242例分析[J].中华血液学杂志,2000;21(2):67-70.
2 艾志龙,秦新裕.亚砷酸在实体瘤中的研究进展[J].中国临床医学,2006;13(3):429-430.
3 郭惠芳,刘淑霞,张玉军 et al.三氧化二砷对高迁移率族蛋白诱导的大鼠滑膜细胞增殖的抑制作用[J].吉大学报医学版,2008;34(1):108-111.
4 韩晓枫,马宝骊,张继英 et al.鸡II型胶原诱导大鼠类风关模型的建立[J].上海免疫学杂志,2002;21(6):330-333.
5 Larsson P,Kleinau S,Holmdahl R.Homologous typeⅡcollagen-induced arthritis in rats.Characterization of the disease and demonstration of clinically distinct formsof arthritisin two strains of ratsafter immunization with the same collagen preparation[J].Arthritis Rheum,1990;33(5):693-701.
6 韩 锋,齐文成,任 洁 et al.三氧化二砷对类风湿关节炎滑膜细胞凋亡的影响[J].新医学,2009;40(2):80-82.
7 Lemarie A,Morzadec D,Merino O et al.Arsenic trioxide induces apoptosisof human monocytes duringmacrophagic differentiation through nuclear factor-κB-related survival pathway downregulation[J].J Pharmacol Exp Ther,2006;316(2):304-314.
8 Arbouzova N I,Zeidler M P.JAK/STAT signalling in Drosophila:insights into conserved regulatory and cellular functions[J].Development,2006;133(14):2605-2616.
9 张志毅,刘殿新,王 辉 et al.三氧化二砷对胶原诱导的关节炎大鼠凋亡及肿瘤坏死因子-α白细胞介素-1的作用[J].中华风湿病学杂志,2005;9(11):650-652.
10 Oshimura A,Nishinakamura H,Matsumura Y et al.Negative regulation of cytokine signaling and immune responsesby SOCSproteins[J].Arthritis Res Ther,2005;7(3):100-110.
11 Yoshimura A,Naka T,Kubo M.SOCS proteins,cytokine signalling and immune regulation[J].Nat Rev Immunol,2007;7(6):454-465.
12 杜金荣,刘家仁,吴永辉et al.砷酸钠与亚砷酸钠致NIH3T3细胞转化的比较研究[J].中国工业医学杂志,1999;12(1):10-12.
