HIV-1 RNA被有效抑制下T细胞与外周血中HIV-1前病毒DNA相关性研究①
2011-09-12李艳萍马克坚肖小河云南省中医中药研究院昆明650223
温 敏 李艳萍 赵 竞 方 路 马克坚 肖小河 (云南省中医中药研究院,昆明650223)
过去将近20年的时间里高效抗逆转录病毒治疗(Highly active antiretroviral therapy,HAART)在HIV-1感染者及艾滋病(AIDS)患者中的广泛使用,很大程度上控制大多数感染者HIV-1病毒的复制,同时使CD4+T细胞升高,在临床上显著降低了AIDS[1]。但目前普遍认为抗病毒治疗无法根除HIV-1,因为HIV-1病毒存储库的存在。研究发现HAART治疗时间长达5年成功抑制HIV-RNA的患者外周血仍可以检查出HIV-1前病毒DNA[2]。HIV-1前病毒DNA的下降可以成为预示长期HAART对HIV-1病毒存储库的作用和长期抗病毒治疗有效性的指标[3-7]。目前我国HAART临床实践已经取得一定进展,但尚无HIV-1 RNA被有效抑制状态下T淋巴细胞和外周血中HIV-1前病毒DNA相关性的研究报道。本研究对云南地区90例确诊为AIDS HAART持续治疗时间超过6个月,血浆HIV RNA<50个拷贝/ml的患者进行研究,考察其CD4+、CD3+、CD8+、CD4+CD28+、CD4+CD45RA+、CD4+CD45RO+和CD8+CD38+、CD38+T细胞与外周血中HIV-1前病毒DNA的相关性,了解经过HAART治疗后HIV-1 RNA被有效抑制状态下的T细胞亚群与HIV-1前病毒DNA数量的相互关系。
1 材料与方法
1.1 研究对象 90例病例均来自云南腾冲,经采用国际通用的HAART组合用药方案治疗的连续治疗6个月以上,其血浆HIV RNA载量经2次试验测定均小于50 copies/ml的AIDS患者。90例AIDS患者的一般情况:男性54人,女性36人,年龄21~77岁,平均年龄(41±12)岁;均为性传播途径感染HIV-1;HAART平均治疗时间6~52个月,平均持续治疗时间为(25.6±13.5)个月。将90例经过HAART治疗后CD4+T细胞绝对计数根据《中国艾滋病和艾滋病病毒感染诊断标准》分为A(CD4+<200 cells/μ l)、B(200≤CD4+≤349 cells/μ l)、C(CD4+≥350 cells/μ l)3组,分组情况为A组31人,年龄(43±12.7)岁,HAART治疗时间(24±12.5)个月,HAART治疗前CD4+T细胞绝对计数(70±58.1)cells/μ l;B组13人,年龄(41±11.8)岁,HAART治疗时间(26±13.7)个,HAART治疗前CD4+T细胞绝对计数(78±67)cells/μ l;C 组13人,年龄(38±10.4)岁,HAART治疗时间(25±12.6)个月,HAART治疗前CD4+T细胞绝对计数(110±83)cells/μ l。所有感染者均签定知情同意书,经单位伦理委员会同意。
1.2 主要仪器与试剂 FC500流式细胞分析仪(Beckman Coulter公司);GeXP多重基因表达遗传分析系统(美国Beckman Coulter);单克隆荧光抗体和Optilyse C溶血素(Beckman Coulter公司);COBAS AMPLICOR自动载量仪及配套试剂盒测定病毒载量(美国Roche公司);DNA提取试剂盒(QIAamp DNA Blood Mini Kit,QIAGEN,Germany);GeXP多重基因表达试剂盒(GenomeLab GeXP Start Kit);Taq酶(Thermo-Start DNA Polymerase with separate 25 mmol/L MgCl2)。
1.3 方法
1.3.1 HIV-1前病毒DNA检测
1.3.1.1 DNA提取 使用QIAGEN公司的全血DNA提取试剂盒(QIAamp DNA Blood Mini Kit,QIAGEN,Germany)按照产品说明书上的操作步骤提取全血DNA。
1.3.1.2 引物设计 应用GeXP Express软件,在NCBI(www.ncbi.nlm.nih.gov/),HIV-Datebase数据库(http://www.hiv.lanl.gov/content/index)分别针对HIV-1的gag 、env、pol设计引物,由上海Invitrogen公司合成,所用引物序列见表1。
1.3.1.3 基因扩增 检测的基因有gag、env、gagpol,以Kanr为内参基因(1.5×104copies/ml)。逆转录引物终浓度为500 nmol/L,PCR引物浓度为200 nmol/L,使用 GenomeLab GeXP Start Kit(Beckman Coulter,USA)扩增,20 μ l体系中包含4 μ l 25 mmol/L MgCl2,3.5 U Thermo-Start DNA Polymerase(Thermo,USA),0.2 μ mol/L Custom PCR Primer Plex,15 ~ 50 ng DNA 模板 ,4 μ l GeXP Start Kit Buffer(Containing universal tags)。扩增(Applied Biosys 9700tem,USA)95℃10分钟,94℃30秒,55℃30秒,68℃1分钟,总共35个循环。对 PCR产物稀释(10 mmol/L Tris-HCl pH8.0 为 1∶4)。40 μ l上样体系中包含 1 μ l PCR 反应样品 ,0.5 μ l DNA Size Standard-400,38.5 μ l Sample Loading Solution和1滴矿物油。在Genome Lab GeXP(Beckman Coulter,USA)上检测并做Fragment Analysis分析。
1.3.1.4 被测样本HIV-1前病毒DNA相对拷贝数计算 数据经GeXP多重基因表达系统的express软件自动和已知产物分析可以得到各个PCR扩增的大小和浓度后每个被测基因PCR产物荧光信号和内参基因KanrRNA比较,得到被检测基因的相对表达值(copies/ml)和各个基因的基因表达图谱,最后计算以HIV-1 DNA的gag、env、gag-pol 3个基因的平均值作为患者外周血的HIV-1前病毒的相对表达值。
1.3.2 T淋巴细胞亚群细胞检测 用FC500流式细胞分析仪(Beckman Coulter公司)进行荧光抗体标记检测。所用单克隆抗体(购自美国Beckman Coulter公司)及其组合为:CD3/CD16±CD56/CD45/CD38/CD8;CD45RA/CD45RO/CD28/CD4/CD45。加入20 μ l试剂和 100 μ l Flow-Count荧光微球至管底 ,加入100 μ l混合均匀的受试对象抗凝全血至管底,轻柔振荡混匀后室温避光孵育15分钟,加入450 μ l FACS Lysing solution溶解红细胞,室温溶血6~12分钟。1 700 r/min离心5分钟,倒掉上清,用1%小牛血清洗液2ml洗涤,1 700 r/min离心5分钟后,倒掉上清,加入 600 μ l 1%多聚甲醛固定液,上机检测。每份样品经五色流式细胞仪检测和Coulter MXP/CXP分析法对T和NK淋巴细胞进行绝对计数和相对计数测定。绝对计数是加入浓度已知的标准微球与标本一起测定,流式细胞仪控制软件在设置后能自动计算出浓度。流式细胞仪获取数据后,由各目标群的含量,可以计算出相对含量(%)。T细胞亚群(cells/μ l)=(要计数的细胞总数/flow count微球总计数)×flow count微球浓度;T细胞亚群相对计数(%)=T细胞数/淋巴细胞数。
1.3.3 HIV-1 RNA载量测定 用K3-EDTA抗凝采血管采集外周静脉血10 ml,14小时内分离血浆,分装并保存于-80℃冰箱。严格按照病毒定量检测仪和COBAS AMPLICORHIV-1MONITORTM 1.5版试剂盒操作说明要求进行检测。检测范围50~7 500 000 copies/ml。
1.4 统计学分析 采用SPSS17.0软件,Kolmogorov-Smirnov Test作正态适配度检验;单因素方差分析进行组间多重比较;Spearman检验进行相关性分析。
2 结果
2.1 HIV-1 RNA被有效抑制下各组外周血T细胞亚群结果 HIV-1/AIDS患者经过HAART持续治疗HIV-1 RNA有效抑制下B、C组的CD3+T细胞绝对计数明显高于A组(P<0.01);C组的CD8+T细胞绝对计数高于B组的(P<0.05);B、C组的CD4+CD28+T细胞绝对计数和相对计数明显高于A组(P<0.01),C组的CD4+CD28+绝对计数高于B组(P<0.05);B、C组的 CD4+CD45RA+T细胞和CD4+CD45RO+T细胞绝对计数明显高于A组(P<0.01),C组的CD4+CD45RA+T细胞和CD4+CD45RO+T细胞绝对计数高于B组(P<0.05),B、C组的CD4+CD45RO+T细胞相对计数低于A组(P<0.05);B组、C组的CD8+CD38+T细胞绝对计数高于A组(P<0.05),B组的CD8+CD38+T细胞相对计数低于A组(P<0.05);C组的CD38+绝对计数高于A组(P<0.05)。数据见表2、3。
2.2 HIV-1 RNA被有效抑制下各组外周血HIV-1前病毒DNA检测结果 A、B、C组的HIV-1前病毒DNA的log拷贝数分别为3.561±0.297 9,3.605±0.277 6,3.434±0.289 1(copies/ml),3组间无显著性差异(P>0.05)。
2.3 HIV-1 RNA被有效抑制下HIV-1前病毒DNA与T细胞亚群的相关性 HIV-1前病毒DNA的log拷贝数与CD4+CD45RA+T细胞绝对计数呈负相关(P<0.05),与CD4+CD45RA+T细胞相对计数呈明显负相关(P<0.01),r分别为-0.231、-0270;HIV-1前病毒DNA的log拷贝数与CD38+T细胞绝对计数呈正相关(P<0.05),r为0.250。数据见表4、图 1。

表1 引物序列及大小Tab.1 Primer sequences and size
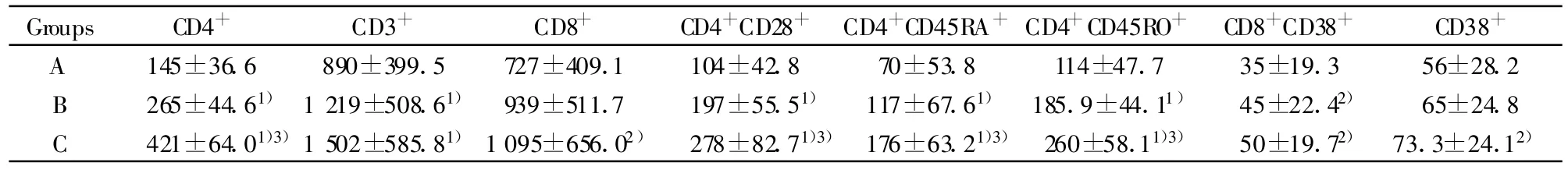
表2 HIV-1 RNA被有效抑制下各组外周血T细胞亚群绝对计数结果(cells/μ l)Tab.2 Comparison of T lymphocytes absolute count in different groups with persistently undetectable plasma HIV-1 RNA(cells/μ l)
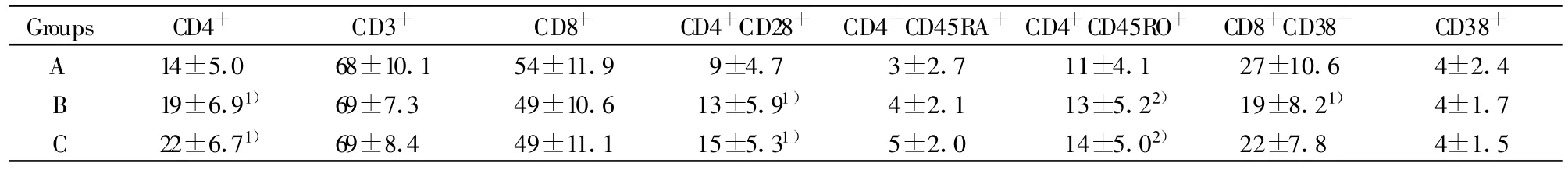
表3 HIV-1 RNA被有效抑制下各组外周血T细胞亚群相对计数结果(%)Tab.3 Comparison of T lymphocytes relative count in different groups with persistently undetectable plasma HIV-1 RNA(%)
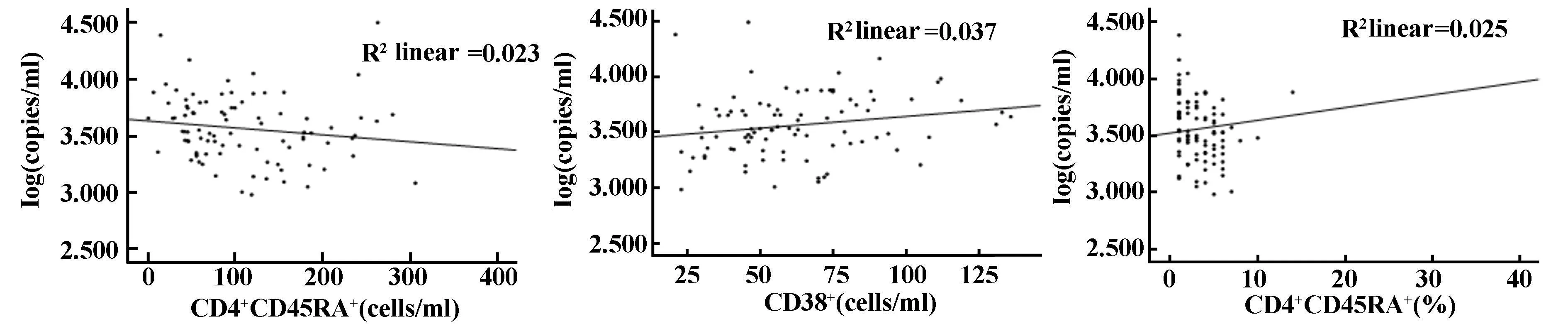
图1 HIV-1 RNA被有效抑制下HIV-1前病毒DNA与T细胞亚群的相关性Fig.1 Correlation between T cell and HIV-1 proviral DNA in AIDS individuals with undetectable plasma HIV-1 RNA levels
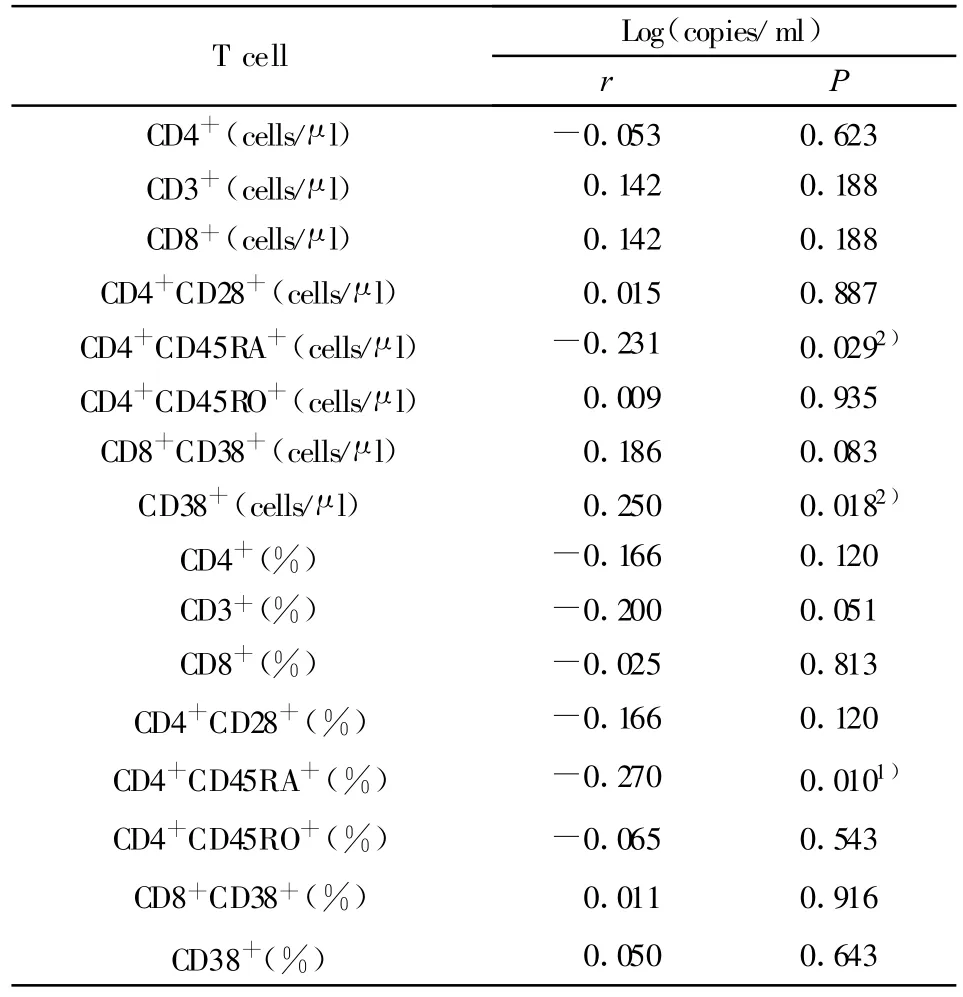
表4 HIV-1 RNA被有效抑制下HIV-1前病毒DNA与T细胞亚群的相关性结果Tab.4 Correlation between T cell and HIV-1 proviral DNAin AIDS individuals with persistently undetectable plasma HIV-1 RNA levels
2.4 HIV-1 RNA被有效抑制下HIV-1前病毒DNA与HAART持续治疗时间的相关性 HIV-1前病毒DNA拷贝数与HAART持续治疗时间做相关性分析发现两者无相关性(R=0.108,P=0.310)。
3 讨论
HIV感染人体后CD4+T细胞成为主要靶细胞,导致机体主要免疫病理改变——包括CD4+T细胞数量的减少,细胞功能受损和异常免疫激活等。HAART治疗不仅能有效地控制HIV-1 RNA的复制,延长HIV感染进程,使AIDS患者的免疫功能得到一定程度的恢复。HIV复制被抑制是免疫重建的主要因素,因为HIV储存库持续存在HAART不能根除病毒,免疫系统不可能完全恢复。本文论述了HIV-1 RNA被有效抑制下T细胞亚群和HIV-1前病毒DNA的相关性。
HIV-1前病毒DNA以嵌合或非嵌合的形式存在于T细胞核内,一旦停药后患者血浆中的HIV-1拷贝数又明显增高,即产生潜伏性感染。这些细胞不但成为HIV的保护屏障,而且作为病毒库在一定条件下又可产生大量病毒并释放到血浆中[8,9]。一些学者认为在进行1年抗病毒治疗后DNA下降[10],而一些学者则认为经过几年的抗病毒治疗后DNA仍处于稳定水平[11]。我们研究发现在AIDS患者在接受HAART治疗长达52个月后外周血中仍可以检测出HIV-1前病毒DNA,并且经过HAART治疗后虽然CD4+T细胞数量得到不同程度的提高但各组之间HIV-1前病毒DNA拷贝数没有差异,同时HIV-1前病毒DNA拷贝数与HAART持续治疗时间无相关性,提示经过长时间HAART治疗HIV-1前病毒DNA可能处于稳定状态,进一步结论需要对HAART后血浆HIV-1前病毒DNA拷贝数进行动态追踪观察。
在本次研究中我们同时监测了HIV-1 RNA血浆拷贝数、T细胞绝对计数、T细胞相对计数。在HIV/AIDS临床检测中应将HIV RNA病毒载量、T细胞亚群绝对计数和相对计数三者结合起来。例如在HIV RNA病毒载量保持在检测限的情况下即使出现CD4+T细胞绝对计数的较大下降,应该参考其他相关数值例如CD4+T细胞相对计数和CD4/CD8比值,这些数值通常更稳定,更少受到影响。
CD28分子是T细胞的协同刺激信号受体,它通过与抗原提呈细胞上的B7分子结合,促进T细胞增殖发挥特定功能。在T细胞实现其正常免疫功能中起着重要作用,若不表达CD28分子,T细胞则不能完成其正常的免疫功能,故CD28分子的表达比例可以作为CD4+T细胞功能的间接评价指标[12]。正常人CD4+T细胞95%以上都表达CD28分子,AIDS疾病进展过程中表达比例逐渐下降。研究表明经过HAART治疗后CD4+T细胞提高至200~349和大于350(cells/μ l)的AIDS患者的CD4+CD28+T细胞的绝对、相对计数明显高于CD4+T细胞<200(cells/μ l)的患者(P <0.01),同时CD4+T细胞 ≥350组的CD4+CD28+T细胞绝对计数高于CD4+T细胞在200~349(cells/μ l)之间的患者(P<0.01)的患者。结果提示我们AIDS患者经过规律HAART后随着CD4+T细胞的增加,CD4+CD28+T细胞的绝对计数和相对计数也随之增加。同时可以推测CD28分子在CD4+T细胞上的表达和CD4+T细胞数呈正相关。
CD45RO和CD45RA是CD45分子的两种异构体。CD4+CD45RA+T细胞为初始 CD4+T细胞,CD4+CD45RO+T细胞为记忆CD4+T细胞。CD4+CD45RA+T细胞是未接触过特异抗原刺激的T淋巴细胞,初始CD4+T细胞和记忆CD4+T细胞在正常人各占约50%,初始CD4+T细胞经特异抗原刺激可变为记忆淋巴细胞[13]。HIV感染进程中CD4+初始T细胞亚群和记忆细胞亚群的变化十分复杂,总的趋势是二者均在不同程度的丢失[14]。已有研究表明HAART开始后CD4+T细胞数量的恢复过程分为两个时相:第一个时相发生在治疗开始后的前两个月,随着病毒载量的快速下降主要为CD45RO+T细胞群增殖,同时可以观察到较少的CD45RA+T细胞亚群增殖。第二时相发生在治疗开始2~3个月后,CD4+T细胞数量将持续1年或更长缓慢而稳定的上升,主要是初始CD4+T细胞的增加[15]。本研究发现经过HAART治疗HIV-1 RNA被有效抑制后CD4+T细胞提高至200~349和CD4+T细胞≥350(cells/μ l)的患者的CD4+CD45RA+和CD4+CD45RO+T细胞绝对计数明显高于CD4+T细胞 <200(cells/μ l)的患者(P<0.01);当CD4+T细胞≥350(cells/μ l)时CD4+CD45RA+和CD4+CD45RO+T细胞绝对计数高于CD4+T细胞在200~349(cells/μ l)之间的患者(P<0.05);CD4+T细胞 在200~349之间和CD4+T细胞大于350(cells/μ l)的CD4+CD45RO+相对计数高于CD4+小于200(cells/μ l,P<0.05)的患者。结果提示我们AIDS患者经过规律HAART后随着CD4+T细胞的增加,CD4+CD45RA+T细胞的绝对计数、CD4+CD45RO+T细胞的绝对计数和表达比例随之增加。同时研究发现HIV-1前病毒DNA的log拷贝数与CD4+CD45RA+T细胞绝对计数和相对计数呈明显负相关(P<0.05,0.01),但各组之间HIV-1前病毒DNA拷贝数没有差异,这提示我们HIV-1前病毒DNA拷贝数的降低可能只是CD4+CD45RA+T细胞绝对计数和相对计数增加的原因之一,可能更多与CD4+T细胞绝对数量有关。
CD38和HLA-DR是处于激活状态的T细胞表达的标志性细胞膜表面分子。HIV感染后能诱导形成特异性细胞毒性,CD8+T细胞上的CD38和HLADR表达比例增高[16]。HIV感染后T细胞激活与病毒复制水平的升高可能是互相促进的,一方面病毒复制速率越快产生的病毒抗原越多,为T细胞激活提供更多的刺激信号;反过来T细胞的异常激活又为病毒复制提供更多的宿主细胞,促进病毒的复制。另一方面激活的CD8+T细胞可以破坏HIV感染的CD4+T细胞,引起CD4+T细胞计数的减少[17]。已有研究证实经HAART有效治疗的患者体内T淋巴细胞亚群的CD38、HLA-DR表达减少[18]。我们的研究发现CD4+T细胞绝对计数较大的 B、C组的CD8+CD38+T细胞绝对计数高于CD4+T细胞绝对计数较小的A组(P<0.05);C组的CD38+T细胞绝对计数高于A组(P<0.05)。CD8+CD38+T细胞和CD38+T细胞的相对表达比例在各组间并未出现明显的差异。意味着CD8+CD38+T细胞和CD38+T细胞的相对表达比例和CD4+T细胞绝对计数可能没有正相关性。同时我们研究发现HIV-1前病毒DNA的log拷贝数与CD38+T细胞绝对计数呈正相关(P<0.05),表明在HIV-1 RNA有效抑制的情况下机体免疫的异常激活与HIV-1前病毒DNA的持续表达有关,意味着只有控制HIV-1前病毒DNA的表达才能控制CD8+T细胞、CD4+T细胞等免疫细胞异常活化。HAART后HIV-1 RNA被有效抑制下随着CD4+T细胞的增加T细胞免疫激活和CD4+T细胞之间的关系有待我们深入研究。
HIV/AIDS患者在接受HAART治疗后T淋巴细胞亚群在数量和功能上能得到一定程度的恢复,血浆病毒载量得到有效控制,减少了机会性感染和肿瘤的产生。但现有的HAART治疗策略包括早期介入、长期使用及HAART联合IL-2等都无法清除HIV潜伏储存库,在HIV感染者及AIDS患者外周血和组织器官都能检测出 HIV-1前病毒 DNA[19]。HAART是目前抑制HIV病毒复制和感染最有效的手段,那么如何实现抗病毒治疗的最终目的即延长病人生命,同时尽可能保持最好的健康和生活质量,如何综合评价HAART治疗过程中病毒学、免疫学和临床标准的成功与否都是值得从事HIV/AIDS临床工作者和药物研究人员进一步思索和关注的。
1 Chun T W,Fauci A S.Latent reservoirs of HIV:Obstacles to the eradication of virus[J].Proc Natl Acad Sci USA,1999;96:10958-10961.
2 Viard J D,Burgard M,Hubert J B.Impact of 5 years of maximally successful highly active antiretroviral therapy on CD4 cell count and HIV-1 DNA level[J].AIDS,2004;18:45-49.
3 Burgard M,Izopet J,Dumon B et al.HIV RNA and HIV DNA in peripheral blood mononuclear cells are consistent markers for estimating viral load in patients undergoing long-term potent treatment[J].AIDS ResHum Retroviruses,2000;10:1939-1947.
4 Garrigue I,Pellegrin I,Hoen B et al.Cell-associated HIV-1 DNA quantification after HAART-treated primary infection in patients with persistently undetectable plasma HIV-1 RNA[J].AIDS,2000;14:2851-2855.
5 Ngo-Giang-Huong N,Deveau C,Da Silva I et al.Proviral HIV-1 DNA in subjects followed since primary HIV-1 infection who suppress plasma viral load after year of highly active antiretroviral therapy[J].AIDS,2001;15:665-673.
6 Pellegrin I,Caumont A,Garrigue I et al.Predictive value of provirus load and DNA human immunodeficiency virus genotype for successful abacavirbased simplified therapy[J].J Infect Dis,2003;187:38-46.
7 Saitoh A,Hsia K,Fenton T et al.Persistence of human immunodeficiency virus(HIV)type 1 DNA in peripheral blood despite prolonged suppression of plasma HIV-1 RNA in children[J].J Infect Dis,2002;15:1409-1416.
8 Chun T W,Stuyver L,Mizell S B et al.Presence of an inducible HIV-1 latent reservoirduring highly active antiretroviral therapy[J].Proc Natl A-cad Sci USA,1997;94:13193-13197.
9 Finzi D,Blankson J,Siliciano J D et al.Latent infection of CD4+T cells provides a mechanism for lifelong persistence of HIV-1,even in patients of effective combination therapy[J].Nat Med,1999;5(5):512-517.
10 Aleman S,Visco-Comandini U,Lore K et al.Long-term effects of antiretroviral combination therapy on HIV type 1 DNA levels[J].AIDS Res Hum Retroviruses,1999;15:1249-1254.
11 Hockett R D Jr,Saag M S,Kilby J M et al.Stability in the HIV DNA pool in peripheral CD4+T cells of untreated patients by single tube quantitative PCR[J].J Virol Methods,2000;87:1-12.
12 邱志峰,李太生,阮桂仁 et al.有效抑制HIV复制下A IDS患者CD4+T淋巴细胞的动态变化[J].中国医学科学院学报,2006;28(3):386-390.
13 Smiatacz T.Immune mechanisms in HIV infection and their role in an tiretroviral therapy[J].Przegl Epidemiol,2003;57(2):309-316.
14 Nokta M A,Li X D,AI-Harthi L et al.Entrapment of recent thymic emigrants in lymphoid tissues from HIV-infected patients:association with HIV cellular viral load[J].AIDS,2002;6:2119-2127.
15 Pakker N G,Motermans D W,Deboer R J et al.Biphasie kineties of peripheral blood T cells after triple combination therapy in HIV-1infetion:composite redistribution and proliferation[J].Nature Med,1998;4:208-214.
16 Ondoa P,Koblavi-Demes,Borget M Y et al.Assessment of CD8 T cell immune activation markers to monitor response to antiretroviral therapy among HIV-1 infected patient in coted'Ivoire[J].Clin ImmunoI,2005;140(1):138-148.
17 Messele T,Brouwer M,Girma M et al.Plasma levels of viroimmunological markers inHIV infected and noninfected Ethiopians:correlation with cell surface activation markers[J].Clin Immunol,2001;98(2):212-219.
18 Badley A D,Parato K,Cameron D W et al.Dynamic correlation of apoptosis and immune activation during treatment of HIV infection[J].Cell Death Differ,1999;5:420-432.
19 温 敏,赵 竞,马克坚 et al.HIV存储库:清除HIV的目标与障碍[J].中国皮肤与性病学杂志,2011;25(4):327-329.
