Trim22 B细胞表位预测及多克隆抗体制备与鉴定①
2011-07-30孙大康安新业周晓生滨州医学院临床学院滨州256603
孙大康 安新业 李 勐 周晓生 (滨州医学院临床学院,滨州256603)
目前在人类已发现70多种Trim(Tripartite motif,三基序)家族成员,其具有重要的抗病毒作用,并参与细胞的增殖、分化、肿瘤发生、凋亡及转录等方面的调节[1,2]。IFN(Interferon,干扰素)可以诱导Trim5α、Trim6、Trim 19、Trim21、Trim22 等多种Trim 蛋白在巨噬细胞或淋巴细胞的表达[3]。有意思的是,Trim22可以影响HIV-1病毒复制的多个环节,抑制病毒颗粒的产生。HIV-1的gag基因产生55 kD的衣壳蛋白前体p55,p55由病毒编码的一个蛋白酶切成四个小蛋白:MA(p17基质)、CA(p24衣壳)、NC(p9核衣壳)和p6。Trim22能与HIV的衣壳蛋白结合,抑制HIV病毒颗粒的形成[4]。在HIV感染细胞模型中过表达Trim22之后,发现HIV的衣壳蛋白弥散地分布于胞浆中,不能正常地定向转移至细胞膜附近,从而抑制HIV的出芽过程[4]。目前虽然已有商品化的抗Trim22抗体,但抗体效价较低。同时,Trim家族成员之间同源性很高,用外源性Trim22全长蛋白作为抗原免疫动物,制备得到的抗体特异性并不理想。通过生物信息学分析,我们选取“382KSSGFAFDPSVNYSKV397”作为抗原表位,人工合成多肽与BSA偶联后作为免疫原,制备抗Trim22多克隆抗体,这对于研究内源性Trim22与HIV-1衣壳蛋白及其前体相互作用的分子机制具有重要意义。
1 材料与方法
1.1 材料 HEK293T细胞株为本室保存;健康雄性新西兰大白兔均由本院实验动物中心提供;福氏佐剂购自Sigma公司;Lipofectamine、Opti-MEM 无血清培养基购自Invitrogen公司;DMEM购自Gibco公司;FLAG鼠源单抗、抗人actin兔源多抗购自Sigma公司;HRP标记的二抗anti-rabbit IgG购自Southern Biotechnology Associates公司;HRP标记的二抗anti-mouse IgG购自R&D公司;硝酸纤维素膜(NC)购自BIO-RAD公司;ECLPlus购自Thermo公司,多肽由吉尔生化(上海)有限公司合成。
1.2 方法
1.2.1 Trim22合成肽的设计 由Pubmed获取Trim22氨基酸序列(Genbank登录号:BC035582),利用lasergene7.0和Vector NTI Advance 11软件分析,综合各参数预测结果,确定382~397区段氨基酸作为抗原表位,合成多肽序列:KSSGFAFDPSVNYSKV。
1.2.2 Trim22合成肽与BSA的偶联 将10 mg BSA溶于1.0 ml的pH8.0、50mmol/L的硼酸钠盐缓冲液中,加入5 mg的合成肽,将二者混匀。边振荡边缓慢加入新鲜配制的0.15%戊二醛溶液1 ml,于室温条件下温和混匀2小时。加入0.25 ml的1 mol/L甘氨酸以封闭未反应的戊二醛。4℃下在4 L的pH 8.0、50 mmol/L的硼酸钠盐缓冲液中透析过夜。更换硼酸钠盐缓冲液后继续透析4小时,储存于4℃。
1.2.3 Trim22抗体的制备 取1 mg多肽-BSA交联物溶于1 ml的PBS,与等量完全福氏佐剂充分乳化。每只兔子免疫接种1 ml乳浊液,在皮下多个位点接种,每个位点100~200μl。3周后,免疫原剂量同前,用不完全福氏佐剂充分乳化后,皮下多点注射。加强免疫共2次,间隔时间3周,经耳缘静脉采血测定抗体的效价,符合要求时,立即颈动脉取血。分离血清后,经饱和硫酸铵沉淀法纯化,分装保存于-70℃备用。
1.2.4 间接ELISA法效价测定 用Trim22合成多肽(2 mg/L)包被 ELISA板,每孔加入 100μl,4℃过夜。用洗涤液洗3次后,加人1%gelatin室温封闭2小时。甩干后,依次加入倍比稀释的兔抗血清(37℃,孵育30分钟,洗涤5次),然后加入1∶10 000的HRP-羊抗兔IgG孵育及洗涤。最后加TMB底物液显色,终止反应后,读取吸光值。
1.2.5 转染 将Trim22、Trim22缺失突变体、Trim5α、Trim6和 Trim34α的 5′-Flag-pcDNA3.1(+)真核表达载体分别用 Lipofectamine转染HEK293T细胞,抗Flag抗体能特异性识别Flag标签。参照Invitrogen公司Protocol,具体操作如下:细胞在转染20~24小时前种入24孔培养板中。当细胞汇合度达到约80%,将细胞培养液换成Opti-MEM无血清培液(200 μl/well)。用Opti-MEM无血清培液分别稀释上述质粒DNA(0.4μg/well)和 Lipofectamine试剂(0.8μl/well),将两者混合后,室温放置30分钟。将上述混合物加入细胞中,5小时后换为含血清的细胞培养液。
1.2.6 蛋白印迹鉴定抗体特异性 转染24小时后收集细胞,用冷PBS洗一次,尽量弃去残余的PBS;用适量体积预冷1×细胞裂解液(1.0%Nonidet P40,20 mmol/:Tris-HCl,pH8.0,10%(vol/vol)甘油,150 mmol/L NaCl,1 mmol/L NaF,2 mmol/L sodium orthovanadate,1 mmol/L sodium pyrophosphate and a protease inhibitor‘cocktail'Roche)。冰上放置15分钟,充分裂解细胞。将细胞裂解液4℃11 372 r/min离心15分钟,上清为获取的细胞总蛋白。蛋白定量后,将同等总蛋白量的不同处理样品进行8%~10%SDS-聚丙烯酰胺凝胶电泳。电泳后,300 mA恒流转移蛋白至硝酸纤维素膜;转膜完毕后,用含5%脱脂奶粉的TBS(Tris-buffered saline)在室温下封闭1小时。然后用TBST洗涤一次,加入抗Flag抗体或抗Trim22抗体,摇床孵育1小时。用TBST洗3次,每次5分钟。加入HRP-二抗,摇床孵育1小时,用TBST洗3次,每次5分钟。将等体积适量增强化学发光显色液A液和B液混匀,覆盖膜30秒~2分钟,于暗室中曝光显影。
2 结果
2.1 Trim22的B细胞抗原表位分析 通过进化树分析及氨基酸序列比对,我们发现在Trim家族中Trim22、Trim5、Trim6、Trim34 的同源性很高,而且均可在干扰素或LPS刺激下诱导性表达[3]。“Vector NTIAdvance 11”序列比对结果显示,上述四种蛋白在氨基端和羧基端的相似性很高,仅在(340~350)及(380~400)区段存在明显的序列差异(图 1A、1B)。用Lasergene软件,参照Jameson-Worf综合预测方案进行分析。根据二级结构预测、亲水性(Hydrophilicity)、可塑性(Flexible)、抗原指数(Antigenic index)及表面可及性(Accessibility)等指标,选择(380-400)区段中多肽序列“KSSGFAFDPSVNYSKV”,作为Trim22的B细胞抗原表位(图1C)。
2.2 效价测定 间接ELISA法检测表明,抗Trim22抗体的效价为1∶16 000。
2.3 对外源性Trim22的识别 把表达载体5′-FlagpcDNA3.1(+)-Trim22经Lipofectamine转染HEK293T细胞,提取蛋白样品进行蛋白印迹检测。结果发现:转染Trim22组在约55 kD处有抗Trim22抗体特异性识别的蛋白条带;转染空质粒组对应位置无条带显示(图2)。
2.4 对内源性Trim22的识别 干扰素刺激U937细胞后,提取蛋白样品进行蛋白印迹检测。结果发现:干扰素刺激组在约55 kD处有抗Trim22抗体特异性识别的蛋白条带,而未刺激组对应位置无条带显示(图3)。
2.5 对Trim22缺失突变体的识别 把5′-Flag-pcDNA3.1(+)-Trim22(1-498)及其缺失突变体Trim22(61-498)、Trim22(132-498)、Trim22(1-282)表达载体经Lipofectamine转染HEK293T细胞,提取蛋白样品进行蛋白印迹检测。由于抗 Trim22抗体是针对(382-397)区段氨基酸序列设计,理论上该抗体可以识别包含该区段的Trim22缺失突变体。结果发现:抗Trim22抗体可以识别Trim22(1-498)、Trim22(61-498)、Trim22(132-498)缺失突变体,却不能识别Trim22(1-282)缺失突变体(图4)。
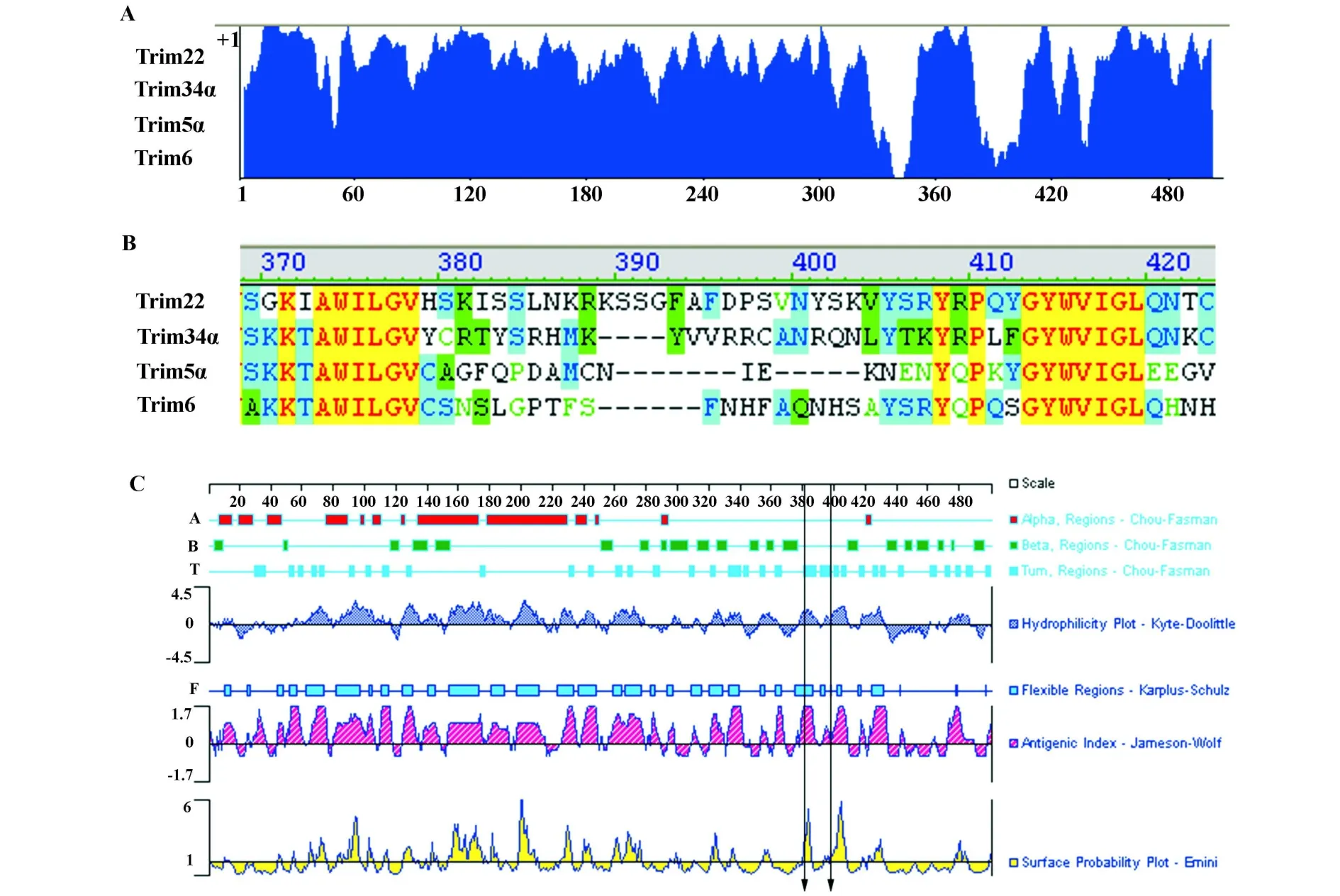
图1 Trim22的B细胞抗原表位分析Fig.1 The analysis result of Trim22 antigen epitope

图2 检测外源性Trim22的表达Fig.2 Detection of the exogenous Trim22 expression

图3 检测内源性Trim22的表达Fig.3 Detection of the endogenous Trim22 expression
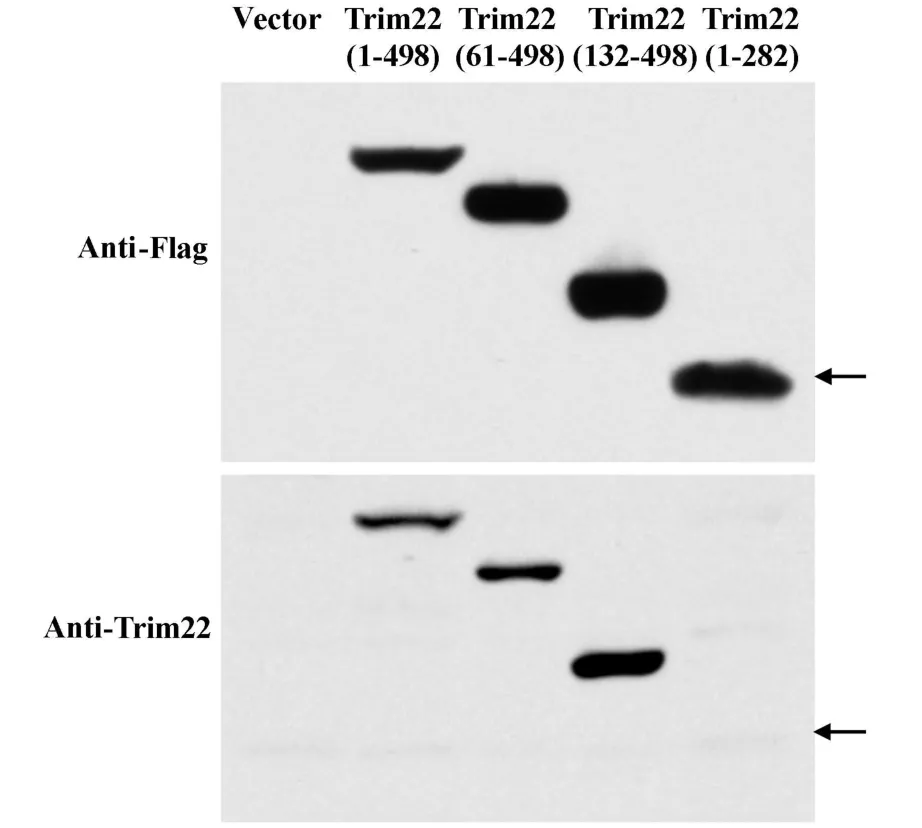
图4 抗Trim22抗体对Trim22缺失突变体的特异性识别分析Fig.4 Analysis of specificity of anti-Trim22Ab to Trim22 truncation mutant

图5 抗Trim22抗体对Trim22旁系同源分子的识别Fig.5 Analysis of specificity of anti-Trim22Ab to Trim22 paralogous molecule
2.6 对Trim22旁系同源分子的识别 把5′-FlagpcDNA3.1(+)-Trim22及其旁系同源分子Trim5α、Trim6、Trim34α表 达 载 体 经 Lipofectamine转 染HEK293T细胞,提取蛋白样品进行蛋白印迹检测。结果发现:抗Flag抗体可以特异性识别质粒Trim5α(494aa)、Trim6(517aa)、Trim22(498aa)、Trim34α(488)表达的蛋白;抗Trim22抗体只能识别Trim22,无法识别质粒Trim5α、Trim6、Trim34α表达的蛋白(图5)。
3 讨论
Trim家族蛋白最显著的特点是具有高度保守的RBCC结构域。Trim蛋白结构由三大部分组成:RING结构域、1~2个B-box结构域和Coiled-coil结构域,Trim家族也因此而得名[5]。在后生生物中,Trim家族蛋白均有表达,但不同种属之间Trim分子的种类有一定的差异。譬如,在人的基因组中有70多个成员,在小鼠中有64个成员远远超过蠕虫(20左右)和果蝇(小于10),由此说明Trim家族成员随着物种的进化而不断丰富[1]。
Trim22在抗HIV-1中的作用正引起人们的极大兴趣,成为Trim5α之后新的研究热点[6,7]。最初,人们发现在COS-7细胞中过表达Trim22,会抑制HIV-1长末端端重复序列相关报告基因的表达[8]。Ⅰ型、Ⅱ型IFN、LPS等均可诱导Trim22的表达[9]。在单核细胞来源的巨噬细胞中过表达Trim22,会抑制HIV-1的感染及复制。Trim22会导致感染细胞分泌的HIV-1衣壳蛋白下降,影响HIV-1生活周期晚期的病毒包装或释放过程[9]。最新研究发现,与健康人相比HIV-1阳性患者外周血单个核细胞(PBMC)高表达IFN-β、MxA、Trim22,并且 Trim22 表达水平与HIV-1病毒载量呈负相关,与CD4+T细胞呈正相关[10]。体外实验证明,HIV-1可以诱导健康人PBMC表达Trim22。在Jurkat细胞中抑制Trim22表达后,HIV-1病毒颗粒的释放及复制显著增强[10]。目前,尚不清楚Trim22通过何种机制影响HIV-1生活周期晚期的病毒包装或释放过程[11]。另外,Trim22还可以抑制其他多种类型的病毒。Trim22通过其E3泛素连接酶活性可以抵抗脑心肌炎病毒的感染;Trim22还作用于HBV病毒核心启动子区域,抑制HBV的转录过程[12,13]。
Trim22包含氨基端的RBCC结构域(RING、B-box、Coiled-coil)和羧基端的B30.2结构域,大约有30多种Trim家族中成员具有这样的组成形式。通过进化树及序列比对分析,我们发现Trim22与Trim5α、Trim6、Trim34α的同源性很高。用“Vector NTI Advance 11”进行氨基酸序列比对,结果显示:Trim22与Trim5α等在氨基端和羧基端都有很高的同源性。如果以Trim22两端的序列设计多肽抗原,其虽然具有较好的表面可及性,但制备抗体的特异性可能受到较明显的影响。
Trim22 与 Trim5α、Trim6、Trim34α的比对结果提示,在(380~400)区段存在明显的序列差异。通过Lasergene软件以“Chou Fasman”方案对Trim22的二级结构预测,在(380~400)区段无α螺旋和β片层结构,有β转角结构。以“Gamier Robson”方案对Trim22的二级结构预测,在(380~400)区段无α螺旋,有β转角结构及无规则卷曲结构。α螺旋、β片层结构规则,形态固定,一般不能作为抗原表位,β转角结构或无规则卷曲结构为凸出结构,多出现在蛋白质抗原表面,利于与抗体嵌合,成为抗原表位的可能性大。进一步分析发现(380-400)区段还具有较好的亲水性、可塑性、抗原指数及表面可及性,因此我们选择“382KSSGFAFDPSVNYSKV397”合成多肽。由于多肽抗原普遍存在免疫原性较低的现象,通常这种激发作用比较弱,需要与载体蛋白偶联,以达到比较理想的免疫应答水平。通常根据免疫原性、溶解性以及是否能形成较多的偶联基团,进行载体的选择。多种不同种类的载体蛋白与多肽偶联后可以作为良好的免疫原。目前最普遍使用的载体是匙孔戚血蓝蛋白(KLH)、牛血清白蛋白(BSA)和OVA(卵清白蛋白)。KLH的免疫原性最强,可偶联的基团也较多,但它的溶解性较其他二者为差。本研究中采用Trim22合成肽与BSA偶联,作为抗原免疫动物。制备的兔源性抗Trim22抗体经纯化处理后,鉴定发现:该抗体具有良好的效价,并且可以特异性识别包含该多肽序列的Trim22缺失突变体,而不能识别未包含该多肽序列的Trim22缺失突变体。同时,该抗体可以特异性识别Trim22,而无法识别Trim22旁系同源分子 Trim5α、Trim6、Trim34α载体表达的蛋白。上述结果均表明该兔源性抗Trim22抗体具有很好的特异性,并且该抗体可用于免疫共沉淀,检测与内源性Trim22相互作用的靶蛋白(结果未显示)。
综上所述,通过本研究获得了高效价的抗人Trim22多克隆抗体,该抗体可以特异性识别内源性及外源性Trim22蛋白,为我们进一步研究Trim22与HIV-1衣壳蛋白的相互作用机制奠定了基础。
1 Ozato K,Shin DM,Chang T H et al.TRIM family proteins and their emerging roles in innate immunity[J].Nat Rev Immunol,2008;8(11):849-860.
2 McNab F W,Rajsbaum R,Stoye J P et al.Tripartite-motif proteins and innate immune regulation[J].Curr Opin Immunol,2010;23(1):46-56.
3 Carthagena L,Bergamaschi A,Luna JM et al.Human TRIM geneexpression in response to interferons[J].PLoS One,2009;4(3):e4894.
4 Barr SD,Smiley J R,Bushman F D.Theinterferon response inhibits HIV particle production by induction of TRIM22[J].PLoS Pathog,2008;4(2):e10000072.
5 Nisole S,Stoye J P,Saib A.TRIM family proteins:retroviral restriction and antiviral defence[J].Nat Rev Microbiol,2005;3(10):799-808.
6 Stremlau M,Owens CM,Perron M J et al.The cytoplasmic body component TRIM5alpharestricts HIV-1 infection in Old World monkeys[J].Nature,2004;427(6977):848-853.
7 高 波,段志坚,徐 薇 et al.固有免疫分子TRIM5α对乙型肝炎病毒复制的影响[J].中国免疫学杂志,2009;25(7):601-605.
8 Tissot C,Mechti N.Molecular cloning of a new interferon-induced factor that represses human immunodeficiency virus type 1 long terminal repeat expression[J].J Biol Chem,1995;270(25):14891-14898.
9 Bouazzaoui A,Kreutz M,Eisert V et al.Stimulated trans-acting factor of 50 kDa(Staf50)inhibits HIV-1 replication in human monocyte-derived macrophages[J].Virology,2006;356(1-2):79-94.
10 Singh R,Gaiha G,Werner L et al.Association of TRIM22 with the type 1 interferon response and viral control during primary HIV-1 infection[J].JVirol,2011;85(1):208-216.
11 Kajaste-Rudnitski A,Pultrone C,Marzetta F et al.Restriction factors of retroviral replication:the example of Tripartite Motif(TRIM)protein 5 alpha and 22[J].Amino Acids,2010;39(1):1-9.
12 Eldin P,Papon L,Oteiza A et al.TRIM22 E3 ubiquitin ligase activity is required to mediate antiviral activity against encephalomyocarditis virus[J].JGen Virol,2009;90(Pt 3):536-545.
13 Gao B,Duan Z,Xu W et al.Tripartite motif-containing 22 inhibits the activity of hepatitis B virus core promoter,which is dependent on nuclear-located RING domain[J].Hepatology,2009;50(2):424-433.
