丙酮酸高产菌诱变选育及发酵工艺优化的初步研究
2011-07-25胡浩然
胡浩然,石 勇,陈 雄
(湖北工业大学生物工程学院 发酵工程省部共建教育部重点实验室,湖北 武汉 430068)
丙酮酸(Pyruvic acid),又称2-氧代丙酸、乙酰基甲酸或α-酮基丙酸,为无色至淡黄色液体,呈醋酸香气和愉快酸味,是最重要的α-氧代羧酸之一。丙酮酸不仅在生物能量代谢中具有十分重要的作用,而且是多种有机化合物的前体,因此,在化工、制药等工业领域及科学研究中都有广泛的用途[1]。近年来,对丙酮酸及其衍生系列产品的开发利用正日益深入,商业需求持续增长[2]。
早在20世纪90年代,丙酮酸就实现了工业化生产,采用的工艺为酒石酸脱水脱羧法,但丙酮酸产率较低。日本学者经过近40年的研究选育出了丙酮酸高产菌株,并于1989年率先实现了流加培养技术工业化发酵生产丙酮酸,产酸量达67.8 g·L-1。作者在此以光滑球拟酵母(Torulopsisglabrata)为出发菌,通过紫外、化学诱变的方法选育出营养缺陷型丙酮酸高产菌,并对其产酸性能进行了初步的研究。
1 实验
1.1 出发菌株
光滑球拟酵母(Torulopsisglabrata)HB20,自行保藏。
1.2 培养基
(1)斜面培养基:无水葡萄糖 20 g,酵母抽提物 20 g,蛋白胨 20 g,蒸馏水 1000 mL,琼脂 20 g,pH值5.5。
(2)种子培养基:无水葡萄糖 100 g,蛋白胨 30 g,KH2PO41 g,MgSO4·7H2O 0.5 g,蒸馏水 1000 mL,pH值5.5。
(3)发酵培养基:无水葡萄糖 100 g,(NH4)2SO46 g,KH2PO41 g,MgSO4·7H2O 0.5 g,盐酸硫胺素 0.03 mg,盐酸吡哆醇 1.0 mg,生物素 0.03 mg,烟酸 8.00 mg,CaCO340 g,蒸馏水1000 mL,pH值5.5[3]。
(4)溴甲酚绿固体完全培养基:无水葡萄糖 40 g,(NH4)2SO43 g,KH2PO41 g,MgSO4·7H2O 0.5 g,盐酸硫胺素 0.03 mg,盐酸吡哆醇 1.0 mg,生物素 0.03 mg,烟酸 8.00 mg,1% 溴甲酚绿乙醇溶液 20 mL,琼脂20 g,蒸馏水1000 mL,pH值5.5。
(5)基本培养基:葡萄糖10 g,(NH4)2SO40.5 g,KH2PO41 g,MgSO4·7H2O 0.5 g,琼脂20 g,蒸馏水1000 mL,pH值5.5。
1.3 培养方法
从新鲜斜面上接一环菌于种子培养基,在30℃、220 r·min-1下培养24 h后,以10%接种量接入发酵培养基。摇瓶发酵装液量为100 mL/500 mL锥形瓶,转速为220 r·min-1,发酵时间为60 h。
1.4 诱变方法及突变株的筛选
取5 mL培养液于4800 r·min-1离心10 min,收集菌体,用5 mL pH值7.0的磷酸钠缓冲溶液洗2次,然后将菌体重新悬浮于适量的缓冲溶液中,制成细胞浓度为1×107个·mL-1的菌悬液。
UV诱变:开启25 W紫外灯,使光波稳定30 min,备用。吸取8 mL待测菌悬液,移入直径9 cm培养皿中,使液面高度在2 mm左右。距离紫外灯管25 cm处垂直照射一定时间,照射时打开培养皿,并采用电磁搅拌器缓慢振荡。关闭紫外灯,开启红光灯,取0.2 mL UV诱变的菌液涂布于溴甲酚绿培养基平板上。将涂布好的平板用黑纸包好,放入30℃恒温培养箱,培养2~3 d。活菌计数并与对照比较,计算致死率。在最佳诱变剂量下诱变处理原菌,稀释梯度涂布平板,根据变色圈大小初筛出一批菌株,将这些菌株与原菌同时进行摇瓶发酵实验,复筛出产酸量较高的菌株。
DES诱变:吸取700 μL UV诱变菌液加入到装有20 mL缓冲溶液的锥形瓶中,稀释30倍,加入0.2 mL DES,使DES在菌悬液中的体积分数约为1%。38℃振荡处理一定时间,加250 μL 25%硫代硫酸钠到试管中,终止反应,并涂平板。与对照比较,计算致死率。在最佳诱变剂量下诱变处理UV诱变复筛出的菌株,同样根据变色圈大小初筛、摇瓶发酵实验复筛出产酸量较高的菌株。
1.5 分析方法
生物量测定:发酵液稀释至相应倍数,于660 nm可见光下测定其吸光值。
葡萄糖含量测定:采用3,5-二硝基水杨酸法(DNS)[4]。
丙酮酸含量测定:采用2,4-二硝基苯肼比色法[5]。
维生素缺陷型的鉴定:将待鉴定的菌株接到基本培养基平板上,将浸有维生素营养物质混合液的滤纸片贴在平板上,培养2~3 d,观察其生长情况。
2 结果与讨论
2.1 菌株的诱变选育
2.1.1 致死率和正突变率的比较
采用不同的UV和DES诱变剂量对菌株进行诱变处理,所得致死率和正突变率见表1。

表1 UV和DES诱变处理的致死率和正突变率/%
由表1可知,UV诱变40 s和DES诱变16 min的致死率都介于60%~80%之间,且正突变率都较高。因此,选取UV诱变40 s、DES诱变16 min选育菌种。
2.1.2 UV诱变的初筛与复筛
经最佳剂量的UV诱变后,挑取变色圈与菌落直径比较大的单菌落初筛出一批菌株。将这些菌株与原菌同时进行摇瓶发酵实验,比较各菌株的产酸量,复筛出8株产量较高的菌株,其产酸量见表2。
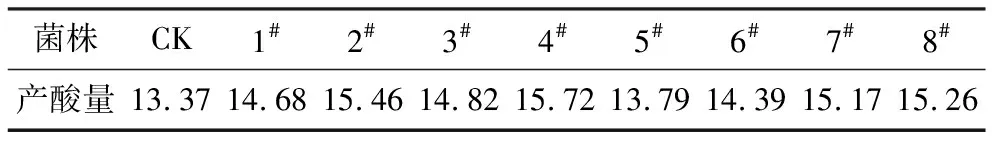
表2 UV突变株与原菌产酸量比较/g·L-1
2.1.3 DES诱变的初筛与复筛
将经UV诱变筛选出的8株突变株经DES诱变处理后,从溴甲酚绿固体完全培养基上初选出5株菌,分别命名为HB301、HB302、HB303、HB304、HB305,把它们与原菌接到发酵培养基中进行摇瓶培养,其产酸量见表3。
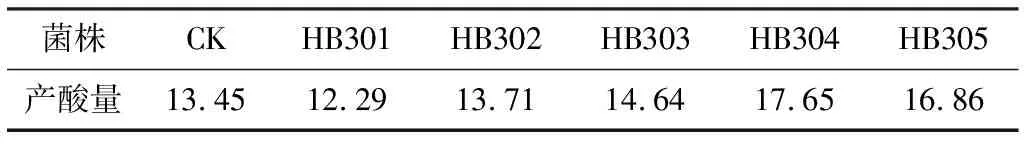
表3 UV-DES突变株与原菌产酸量比较/g·L-1
由表3可知,HB304比原菌HB20产酸量增加了31.2%。
将获得的5株突变株分别转接斜面5代,1、3、5代每代转接3个摇瓶进行发酵实验,考察产酸能力的遗传稳定性,结果见表4。

表4 UV-DES突变株的遗传稳定性/g·L-1
由表4可知,HB304在传代过程中产酸能力稳定,而HB305株菌在传代3次后,产酸能力有所下降。综合考虑菌株的产酸能力和遗传稳定性,确定突变株HB304为进一步研究用菌株。
2.2 产丙酮酸突变株HB304的维生素需求鉴定及分析
对产丙酮酸突变株HB304的维生素需求进行鉴定,结果见表5。

表5 各种维生素对HB304生长的影响
实验发现,在不含盐酸硫胺素、烟酸、盐酸吡哆醇、生物素而含有其它维生素的滤纸片周围无菌落出现,在含有盐酸硫胺素、烟酸、盐酸吡哆醇、生物素而缺少其它维生素的滤纸片周围出现菌落。说明产丙酮酸突变株HB304是盐酸硫胺素、盐酸吡哆醇、烟酸和生物素4种维生素的缺陷型。研究表明,球拟酵母属菌株,特别是维生素营养缺陷型的菌株更能大量地积累丙酮酸。由于丙酮酸脱氢酶系的辅因子为烟酸和盐酸硫胺素、丙酮酸羧化酶的辅因子为生物素、丙酮酸脱羧酶的辅因子是盐酸硫胺素,营养缺陷型菌株自身无法合成这些维生素,因此,当这些维生素的浓度处于亚适量水平时,丙酮酸就得以积累。
2.3 培养基的优化
2.3.1 葡萄糖初始浓度的确定
以葡萄糖为碳源、(NH4)2SO4为氮源,固定(NH4)2SO4浓度为6.0 g·L-1,考察葡萄糖初始浓度对发酵的影响,结果见表6。
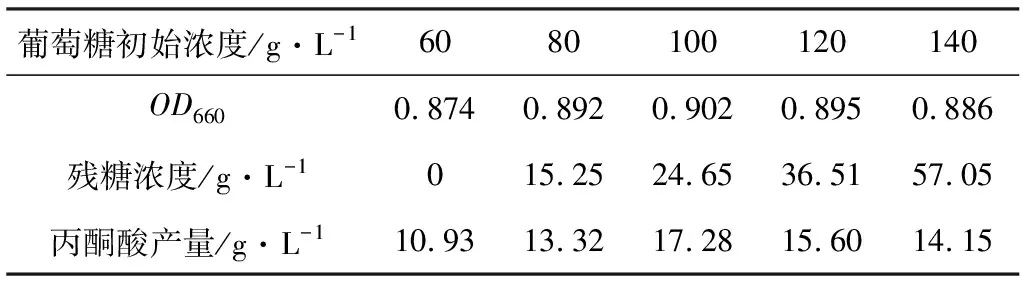
表6 葡萄糖初始浓度对发酵的影响
由表6可知,葡萄糖初始浓度在60~100 g·L-1时,菌体浓度、丙酮酸产量及残糖浓度随其浓度的增加而上升;葡萄糖初始浓度在100~140 g·L-1时,菌体浓度、丙酮酸产量随其浓度的增加而降低,残糖浓度依然上升。这表明过高的葡萄糖初始浓度对菌体生长产生抑制,导致残糖浓度增加,浪费了原料,提高了生产成本;而葡萄糖初始浓度过低又会使发酵过早结束,微生物利用完葡萄糖后又转而利用丙酮酸,导致丙酮酸产量降低。
2.3.2 (NH4)2SO4浓度的确定
固定葡萄糖初始浓度为100 g·L-1,考察(NH4)2SO4浓度对发酵的影响,结果见表7。
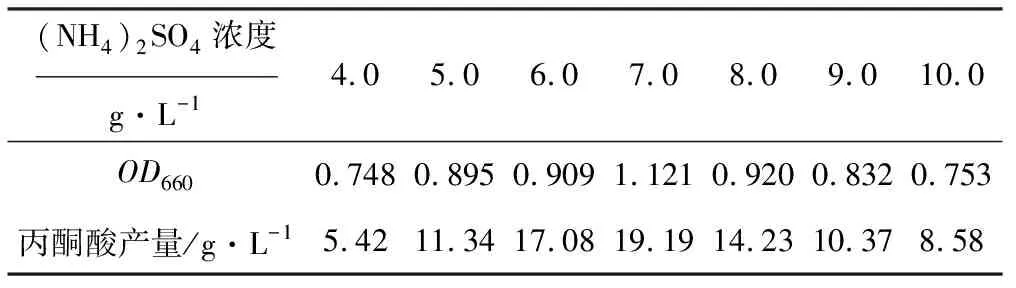
表7 (NH4)2SO4浓度对发酵的影响
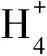
因此,优化的葡萄糖初始浓度为100 g·L-1、(NH4)2SO4浓度为7.0 g·L-1,此时菌体生长较好,丙酮酸产量较高,达19.19 g·L-1,较原菌提高了41.9%。
2.4 讨论
糖酵解途径的最终产物丙酮酸处于代谢途径中的关键代谢支点,在细胞中很容易代谢为其它产物,难以积累。要使其在细胞中积累并分泌到胞外,就只有切断或弱化丙酮酸的进一步代谢。提高丙酮酸产量的方法主要有:(1)在保证细胞正常代谢的前提下,尽可能减少丙酮酸的降解或转化;(2)加快从葡萄糖到丙酮酸的代谢速度,以确保获得丙酮酸的高生产强度[6]。实验中筛选出的HB304是盐酸硫胺素、盐酸吡哆醇、烟酸和生物素的营养缺陷型突变株,而这4种维生素直接影响了丙酮酸在细胞内的代谢。
3 结论
通过诱变育种筛选出的产丙酮酸突变株HB304在培养基未经优化的条件下,摇瓶发酵产酸量较原菌提高了31.2%,通过初步优化培养基初始碳、氮源,摇瓶发酵产酸量较原菌提高了41.9%。作为多种维生素营养缺陷型的HB304具备大量积累丙酮酸的潜力,通过进一步优化培养基成分,提高丙酮酸的产量,最终可望用于工业化生产。
[1] 陈坚,李寅.发酵过程优化原理与实践[M].北京:化学工业出版社,2001:129-130.
[2] 李寅,陈坚,陈燕,等.丙酮酸高产菌株的选育及中试研究[J].工业微生物,2001,31(2):10-13.
[3] Hua Qiang,Araki Minako,Koide Yohko,et al. Effects of glucose,vitamins,and DO concentrations on pyruvate fermentation usingTorulopsisglabrataIFO 0005 with metabolic flux analysis[J]. Biotechnol Prog,2001,17(1):62-68.
[4] 陈毓荃.生物化学实验方法和技术[M].北京:科学出版社,2002:97-100.
[5] 张宗祥.采用微生物发酵制取丙酮酸的研究[D].南京:南京理工大学,2004.
[6] 李寅,陈坚,伦世仪,等.维生素在丙酮酸过量合成中的重要作用[J].微生物学报,2000,40(5):528-534.
