铀-邻苯二胺配合物的合成及表征
2011-07-25何福兰石腾龙徐鹏宇
何福兰,石腾龙,徐鹏宇,王 娟,2
(1.湖北大学化学化工学院,湖北 武汉 430062;2.江西省科学院应用化学研究所,江西 南昌 330029)
金属有机化合物的合成已成为世界各国有机合成和催化学家关注的焦点,其中对含多重键的金属有机化合物的研究尤为引人注意。特别是自20世纪90年代以来,合成了许多高活性、高选择性(包括立体选择性)的多重键(M:X)金属有机化合物催化剂,并被广泛地用于催化有机化学反应。但对于镧系和锕系多重键金属有机化合物的研究报道较少,原因可能是f区金属有机化合物的制备不如d区过渡金属有机化合物简便[1]。金属有机配位化合物由于具有新颖独特的结构以及在生物、吸附和催化等方面的突出性质受到了人们的广泛关注。这些研究主要集中在过渡金属和镧系金属配合物,而有关锕系金属的研究则很少。
作者在此以邻苯二胺、UO2为原料,在水热条件下合成铀-邻苯二胺配合物,并对其结构进行了表征。
1 实验
1.1 试剂与仪器
二氧化铀(UO2),北京核工业地质研究所;盐酸(36%),分析纯,开封东大化工有限公司;邻苯二胺,化学纯,中国五联化工厂;氢氧化钠,分析纯,天津广成化学试剂有限公司。
傅立叶红外光谱仪、λ-17型紫外可见分光光度计、DTA-1700型热分析系统,美国PE公司。
1.2 方法
将0.0564 g(0.2 mmol)UO2加入10 mL的浓盐酸中,待完全溶解后,溶液呈黄色;称量0.0433 g邻苯二胺置于黄色溶液中,搅拌,滴加1.0 mol·L-1NaOH溶液调pH值至4.8;然后按填充度为80%转移到不锈钢反应釜中,于烘箱中150℃下反应5 d;冷却,室温下自然挥发,14 d后析出紫红色针状晶体,即铀-邻苯二胺配合物。
2 结果与讨论
2.1 红外光谱分析
配体邻苯二胺属于一级胺,在3300~3500 cm-1处出现了2个吸收峰,峰值分别为3363.96 cm-1和3385.35 cm-1,归属于N-H 的伸缩振动峰,和文献中一级胺在3300~3500 cm-1范围内只有2个吸收峰基本吻合。一级胺的N-H面外摇摆振动在650~900 cm-1宽区域[2,3]。标题配合物的红外光谱如图1所示。

图1 标题配合物的红外光谱
由图1可看出,标题配合物在3300~3500 cm-1处出现了1个吸收峰,峰值为3384.61 cm-1,归属于N-H 的伸缩振动峰,和文献中二级胺在3300~3500 cm-1范围内只有1个吸收峰基本吻合。说明邻苯二胺的氮原子参与了配位,形成了新的体系。753.37 cm-1处为苯环邻二取代δC-H的面内弯曲振动吸收峰。在1450~1650 cm-1有4个吸收峰,为苯环νC=C骨架吸收峰[4]。
2.2 紫外光谱分析
室温下,用紫外可见分光光度计对标题配合物溶液和邻苯二胺配体分别进行光谱测定,结果见图2。
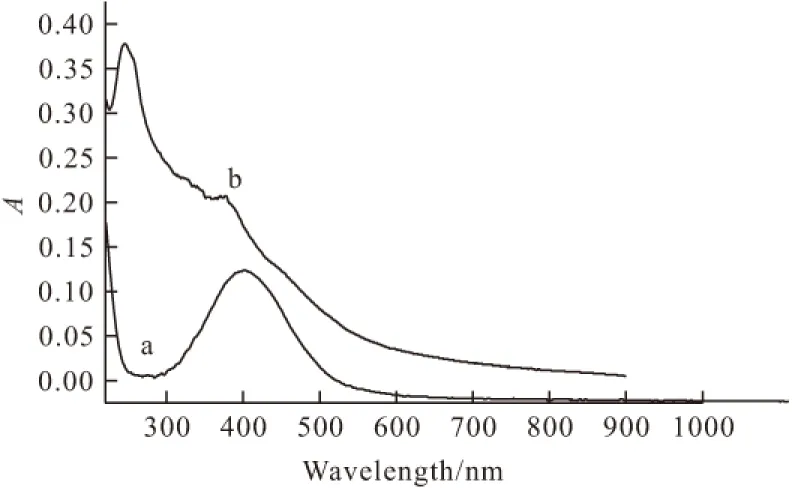
图2 配体(a)及标题配合物(b)的紫外光谱
由图2可看出,邻苯二胺配体的最大吸收在410 nm,主要是因为n-π﹡传递的作用,氮原子周围的孤电子对向苯环偏移形成共轭结构,使得整个体系的共轭程度加强。而配合物的最大吸收在260 nm,这是由于形成配合物以后,中心离子铀和氮原子成键,导致原来的共轭结构降低,使最大峰发生蓝移[5,6]。
2.3 热失重分析(图3)
由图3可知,标题配合物在25~800℃总共失重29.1%。第一步失重在25~70℃,失重7.1%,通过计算可知是苯环上的两个氨基脱去,70~230℃温度基本不变;第二步失重在230~370℃,失重22%,通过计算可知是配合物的苯环脱去;当温度升高到370℃以上,质量基本不变,说明有机配体被完全解离和氧化,只有无机组分残留下来[3]。
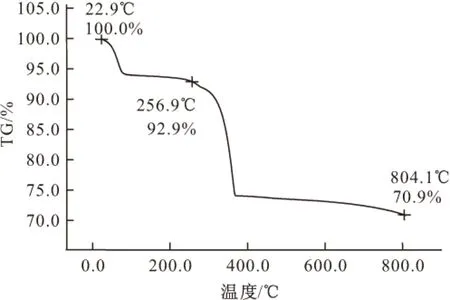
图3 标题配合物的TG曲线
3 结论
以邻苯二胺为配体与UO2通过水热合成得到铀-邻苯二胺配合物,并用红外光谱、紫外光谱、热失重分析等手段对其结构进行了分析。
[1] 陈璋如,金远新.铀矿物学研究现状[J].铀矿地质,2008,24(6):339-346.
[2] 周红波,陈友存.两种过渡金属配合物的合成和光谱表征[J].安庆师范学院学报(自然科学版),2007,13(4):42-44.
[3] 中本一雄,著,黄德和,汪任庆,译.无机和配位化合物的红外和拉曼光谱(第四版)[M].北京:化学工业出版社,1991:253-255.
[4] 董庆年.红外光谱法化学[M].北京:化学工业出版社,1979:194-196.
[5] 常建华,董绮功.波谱原理及解析[M].北京:科学出版社,2001:29-36.
[6] 邓芹英,刘岚,邓慧敏.波谱分析教程(第二版)[M].北京:科学出版社,2007:19-23.
