模拟微重力环境对大肠杆菌形态与表面超微结构的影响研究
2011-07-25薛小平
王 伟,薛小平,杨 慧,谢 琼
(1.西北工业大学生命科学院,陕西 西安 710072;2.中国航天员训练中心医监医保研究室,北京 100094)
随着航天事业的发展,对空间环境的开发和利用已成为各国竞争的重要领域之一。与地面环境相比,空间环境的主要特征包括微重力、宇宙辐射、高真空等物理因素。在近地空间条件下,由于航天器位置调整、轨道高度、航天员活动等因素引起的重力级别一般为10-6~10-4g,因此飞行器中各种物体均处于微重力状态,许多物理现象如对流、浮力、流体静压力、沉降等将会消失,从而对生物体机能产生重大影响。因此,空间失重环境对生物体的影响及其作用机理已成为空间生命科学研究的一项重要内容。
微生物是地球上分布最广泛的生物类群,在人类进入空间飞行的过程中,各种微生物也随同被携带进太空,有研究表明,进入太空中的微生物受微重力等因素的影响,其种群结构、生理生化性状等会发生变化,原本对人体和环境无害的微生物种群会在毒力、致病性、抗生素敏感性等方面发生变异,如不加以控制将严重危害宇航员健康,腐蚀电子元器件、影响航天精密仪器的正常使用。鉴于此,利用微生物开展空间失重生物学效应的研究具有重要的理论和实际意义。
作者采用模拟微重力生物效应回转器处理常见的大肠杆菌(E.coli),利用扫描电镜[1]和原子力显微镜[2~5]研究模拟微重力环境对其形态和表面超微结构的影响,以期为微重力环境下细菌的生物学效应研究奠定基础。
1 实验
1.1 菌株与培养基
大肠杆菌(Escherichiacoli)ATCC 25922,自行保存(西京医院细菌室惠赠)。
LB液体培养基:Tryptone 10 g、酵母膏5 g、NaCl 10 g,加入800 mL蒸馏水后用5 mol·L-1盐酸调节pH值至7.0,用双蒸水定容至1 L,121℃、103.42 kPa下高压蒸汽灭菌20 min,备用。
1.2 仪器
模拟微重力生物效应回转器,中国科学院生物物理研究所;超净工作台,苏州净化设备总厂;生化培养箱,海尔公司;5500 AFM型原子力显微镜,Agilent Picoplus;S-3700N型扫描电镜,Hitachi。
1.3 细菌的培养与模拟微重力处理[6]
将E.coli接种于5 mL液体LB培养基中,于37℃、220 r·min-1过夜培养;取50 μL过夜菌接种于5 mL新鲜LB液体培养基中,振荡培养2 h至对数生长期,按1∶300接种于新鲜LB液体培养基中并充满样品瓶。将样品瓶置于隔水培养箱中的回转器上,打开回转器的开关,于60 r·min-1、37℃下持续培养60 d。对照样品置于培养箱中静置培养。
1.4 扫描电镜样品制备及观察[7]
(1)收集菌体:取培养物1.5 mL,4000 r·min-1离心5 min,弃上清;(2)固定:沉淀中加入1 mL 2.5%戊二醛固定液,固定24 h(以上)→磷酸盐缓冲溶液清洗3次→1%锇酸4~6 h→缓冲溶液清洗3次→乙醇梯度脱水(30%、50%、70%、85%、95%各1次,100% 2次,15~20 min·次-1)→乙酸异戊酯置换2次(20 min·次-1)。每步均需4000 r·min-1离心3~5 min,弃上清,加入下一种试剂,滴管来回吸几下,打散菌块;(3)临界点干燥:将固定、清洗过的细菌放入临界点干燥器样品室,进行CO2临界点干燥。每次可同时处理10~20种不同菌样(需用液态CO2置换2~3次);(4)离子溅射金:将干燥后粉末状纯菌体倒入平皿,轻摇尽量分散。碳导电胶带一面粘在1/4盖玻片上,另一面倒扣轻压在菌体粉末上,翻正后用镊子或牙签将菌体轻轻刮薄铺平。离子溅射金后,即可进行扫描电镜观察。
1.5 原子力显微镜样品制备及观察[8~14]
取1.5 mL培养物加入无菌离心管,4000 r·min-1离心10 min,弃上清,将收集的细菌样本重新悬浮于1 mL 0.9%生理盐水中,4000 r·min-1离心5 min,弃上清,于1 mL 2.5%戊二醛中4℃固定。吸去管中的2%戊二醛,加入1 mL双蒸水重悬菌体,4000 r·min-1离心5 min,洗涤,反复3次,去除杂质,确保不会有盐结晶的出现,1∶1000稀释,吸取少量细菌悬液,小心滴于新鲜剥离的云母片上(没有云母片可用盖玻片代替,盖玻片需用酸泡6 h以上,双蒸水洗净,无水乙醇擦拭表面),待水分自然风干(或37℃干燥)后,即可进行原子力显微镜观察。
2 结果与讨论
2.1 扫描电镜分析[6]
实验发现,对照组菌体为典型的短棒状或短圆柱状,形态均一,菌体饱满、充盈、表面圆润光滑。经模拟微重力回转器处理后,菌体发生了明显的变化,其形态变得多样,长度变短,多呈现出短立方体状,菌体表面凹陷、边界棱角分明,同时,菌体间的丝状粘连物明显增多。
对照组和处理组菌株的扫描电镜照片见图1。

图1 对照组(a)和处理组(b)菌株的扫描电镜照片
2.2 原子力显微镜分析[15~19]
实验发现,正常大肠杆菌为短杆状,大小为0.5 μm×(1~3) μm,周身有鞭毛,但表面相对平滑均匀,经模拟微重力回转器处理后,菌体表面光洁,且有明显的凹凸,菌毛明显减少。
对照组和处理组菌株的平面图见图2。

图2 对照组(a)和处理组(b)菌株的平面图
由图2可以看出,处理前后大肠杆菌表面变化明显。三维立体图直观地将这种变化表现出来(图3)。
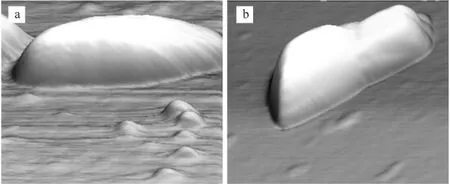
图3 对照组(a)和处理组(b)菌株的三维立体图
对对照组和处理组菌株分别进行剖面分析处理,其长度测量图和长度测量曲线分析见图4、图5。

图4 对照组(a)和处理组(b)菌株的长度测量图
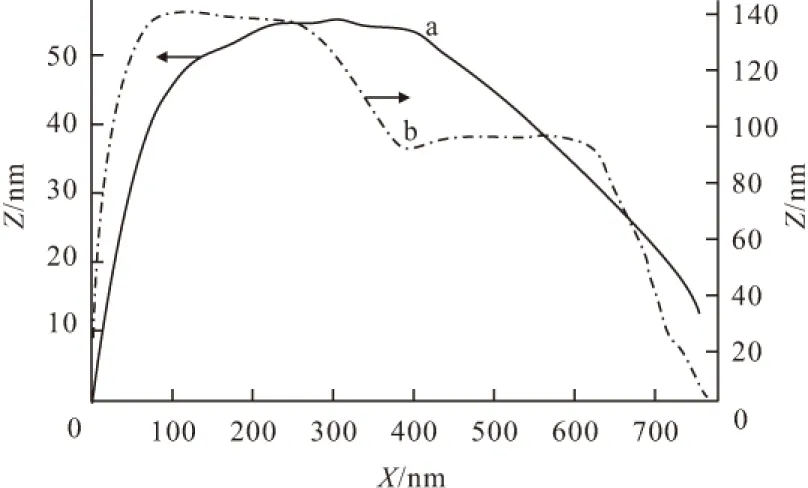
图5 对照组(a)和处理组(b)菌株的长度测量曲线
由图5可知,正常大肠杆菌菌体厚度最大值约为60 nm左右,而处理后大肠杆菌的菌体厚度最大值约为135 nm左右。通过菌体长度对比也发现,处理后大肠杆菌菌体变短。
处理后大肠杆菌的局部放大平面图、三维立体图、长度测量图及长度测量曲线见图6。

图6 处理后菌株的局部放大平面图(a)、三维立体图(b)、长度测量图(c)和长度测量曲线(d)
由图6可知,处理后大肠杆菌的凹陷约有40 nm。
回转器处理后大肠杆菌的原子力扫描图见图7[14,19,20],大小为45 μm×45 μm。

图7 处理后大肠杆菌的原子力扫描图
由图7可知,回转器处理后大肠杆菌的菌体出现凹陷,并不是单一的某个菌体发生突变,而是一个普遍的现象。
2.3 讨论
地球上的生物体总是生活在一定的重力环境中,其周围重力环境的改变(例如:失重)对生物体生长、发育以及繁殖过程等有一定潜在性影响。随着科学技术的进步,对太空环境的探索和开发已成为各国竞争的目标。太空中不可避免地涉及到失重环境,失重环境对生物体有怎样的影响,如何合理利用失重环境,将失重带来的损失降到最小,是各国科学家研究的重点。
任何外界环境(生物、物理或化学)因素作用于生物体,首先引发遗传性变异,继而显现表型性状改变,并且呈现出缓慢、累积的效应,需要通过1~2代、甚至数代的世代交替才能表现出来。微生物除体积微小、结构简单、易于变异外,还具有繁殖速度快、世代交替周期短的特点,因此以微生物为模式生物研究某些特殊和极端环境的生物学效应具有明显的优势。
本研究通过比对实验,观察到失重环境可以影响微生物的整体形态,还可以引起微生物表面超微结构的改变[1,2],这种变化的生物学意义何在,对细菌的致病性、药物敏感性和抗性有何影响,对于人类利大于弊还是弊大于利,还需要进一步深入研究。
3 结论
采用模拟微重力生物效应回转器处理大肠杆菌ATCC 25922,利用扫描电镜和原子力显微镜研究回转器模拟微重力环境对细菌的形态及表面超微结构的影响。结果发现,模拟微重力条件下,处理菌株与对照菌株相比在形态、长宽度、表面超微结构等方面有明显改变。表明微生物的形态和表面超微结构与微重力的变化有关。
[1] Rattner J B,Lin C C. Radial loops and helical coils coexist in metaphase chromosomes[J]. Cell,1985,42(1):291-296.
[2] 石万良,谢志雄,沈萍.原子力显微镜在微生物学领域的应用[J].微生物学通报,2004,31(1):109-113.
[3] 邱文彦,Mu Richard R. 原子力显微镜在细菌学研究中的应用[J].国外医学(口腔医学分册),2002,29(5):284-286.
[4] 李琦,郑琪,丁焰,等.原子力显微镜在染色体研究中的应用[J].遗传,2009,31(6):573-580.
[5] 唐蕊华.单分子/单细胞水平病毒与细胞相互作用中超微结构的研究[D].西安:西北工业大学,2009.
[6] 尹焕才.动态磁场与模拟微重力环境下微生物的生物学效应研究[D].西安:西北工业大学,2009.
[7] 谢家仪,董光军,刘振英.扫描电镜的微生物样品制备方法[J].电子显微学报,2005,24(4):440.
[8] 金花,赵宏霞,任雅清,等.万古霉素与血卟啉单甲醚对金葡菌作用的AFM观察[J].中国抗生素杂志,2009,34(6):367-371.
[9] Amsterdam D. Post-Antibiotic Effect[A]. Lorian V. Antibiotics in Laboratory Medicine (4th ed)[M]. Williams & Wilkins Co.,1996:52-111.
[10] Wickens H J,Pinney R J,Mason D J,et al. Flow cytometric investigation of filamentation,membrane patency,and membrane potential inEscherichiacolifollowing ciprofloxacin exposure[J]. Antimicrob Agents Chemother,2000,44(3):682-687.
[11] 张永青,王睿,朱曼,等.原子力显微镜观察头孢美唑抗生素后效应期间大肠埃希菌形态学特征[J].中国临床药理学与治疗学,2004,9(10):1123-1127.
[12] 王睿,朱曼,张永青.原子力显微镜观察抗生素后效应期间大肠埃希菌形态学变化[J].中华医院感染学杂志,2005,15(3):244-248.
[13] O′Reilly M,McDonnell L,O′Mullane J. Quantification of red blood cells using atomic force microscopy[J]. Ultramicroscopy,2001,86(1-2):107-112.
[14] Moloney M,McDonnell L, O′Shea H. Atomic force microscopy of BHK-21 cells:An investigation of cell fixation techniques[J]. Ultramicroscopy,2004,100(3-4):153-161.
[15] Muller D J. AFM:A nanotool in membrane biology[J]. Biochemistry,2008,47(31):7986-7998.
[16] Dufrene Y F,Boonaert C J P,Gerin P A,et al. Atomic force microscopy,a powerful tool in microbiology[J].J Bacteriol,2002,184(19):5205-5213.
[17] Espenel C,Giocondi M C,Seantier B, et al. Temperature-dependent imaging of living cells by AFM[J]. Ultramicroscopy,2008,108(10):1174-1180.
[18] Kuznetsov Y,Gershon P D,McPherson A. Atomic force microscopy investigation of vaccinia virus structure[J]. J Virol,2008,82(15):7551-7566.
[19] Evangelista V,Barsanti L, Passarelli V,et al. From cells to proteins:Imaging nature across dimensions[C]. Proceedings of the NATO advanced study institute on from cells to proteins: Imaging nature across dimensions. Italy,2005:405-414.
[20] Tomohiko Nishino,Eiko Ikemoto, Kazuhiro Kogure. Application of atomic force microscopy to observation of marine bacteria[J]. Journal of Oceanography,2004,60(2):219-225.
