正交试验比较金银花药材中绿原酸与木犀草苷的乙醇提取工艺
2011-07-25闵春艳游本刚许琼明李笑然唐丽华杨世林
闵春艳, 游本刚, 许琼明, 李笑然, 唐丽华, 杨世林
(1.苏州药品检验所,江苏苏州215002;2.苏州大学医学部药学院,江苏 苏州215213)
金银花系忍冬科植物忍冬Lonicerae japonicae Thunb的干燥花蕾或带初开的花,具有清热解毒、凉风散热之功效[1]。主要成分为有机酸类、黄酮类、挥发油类和皂苷类等[2-3],其中,木犀草苷是金银花用以区别山银花的特征性成分,也是其主要药效成分之一。因此,在原有绿原酸质量控制标准的基础上,新增了木犀草苷作为2005年版、2010年版《中国药典》金银花质量控制指标[4-5]。多年以来,在金银花药材的提取工艺及提取物质量标准研究中,均是以绿原酸为质控指标,而木犀草苷却未引起足够的重视[6-7]。本研究建立了HPLC法同时测定金银花提取物中绿原酸与木犀草苷的方法,同时以两种成分为指标,通过正交试验设计优化并比较了金银花药材的乙醇提取工艺。
1 仪器与试剂
高效液相色谱仪(配备SPD-M20A型二极管阵列检测器,LC-20AT型泵,CTO-10ASVP型温控柱温箱,LC solution型色谱工作站,日本岛津仪器公司);AS20500AT超声波清洗器(天津奥特赛恩斯仪器有限公司);电子分析天平(赛多利斯)。
绿原酸对照品(中国药品生物制品检定所,批号:110753-200413);木犀草苷对照品(中国药品生物制品检定所,111720-200501);金银花药材(苏州市天灵中药饮片有限公司,批号071211-1);乙腈(色谱纯,TEDIA公司);四氢呋喃(色谱纯,国药集团化学试剂有限公司);其余试剂均为分析纯。
2 实验方法与结果
2.1 绿原酸和木犀草苷的测定
2.1.1 对照品溶液的制备
精密称取绿原酸对照品10.18 mg,置50 mL量瓶中,用50%甲醇溶解并定容至刻度,制得质量浓度为203.6 μg/mL的绿原酸贮备液。
精密称取木犀草苷对照品10.06 mg,置50 mL量瓶中,用50%甲醇溶解并定容至刻度,制得质量浓度为201.2 μg/mL的木犀草苷贮备液。
2.1.2 供试品溶液的制备 精密称取金银花提取物样品约20 mg,置10 mL量瓶内,加入50%甲醇溶解、定容至刻度,摇匀,滤过,即得。
2.1.3 色谱条件 Diamonsil C18色谱柱(4.6 mm ×150 mm,5 μm);以乙腈-四氢呋喃(95 ∶5)为流动相 A,0.4% 磷酸为流动相B,采用梯度洗脱:0~8 min,88%B;8~10 min,80%B;10~25 min,80%B~75%B;绿原酸和木犀草苷的检测波长分别为327 nm和350 nm;体积流量1.0 mL/min;柱温 35 ℃;进样量20 μL。
分别取混合对照品溶液及供试品溶液,适当稀释后采用上述色谱条件进样,记录色谱图,结果见图1。

图1 金银花供试液在350 nm(A)和327 nm(B)的液相色谱图及对照品溶液在350 nm(C)和327 nm(D)的液相色谱图
2.1.4 线性关系 精密量取上述两种贮备液适量,用50%甲醇稀释,分别得质量浓度为 10.18、20.36、40.72、81.44、122.16、162.88 μg/mL 的绿原酸系列对照品溶液和质量浓度为 2.012、4.024、8.048、12.072、16.096、20.12 μg/mL 的木犀草苷系列对照品溶液,按2.1.3项下色谱条件进样,以对照品质量浓度C对峰面积A进行线性回归,得绿原酸的标准曲线方程为 A=58026C-120395(r=0.9999),线性范围为10.18 ~162.88 μg/mL;木犀草苷的标准曲线方程为A=55898C-49443(r=0.9997),线性范围为2.01 ~20.12 μg/mL。
2.1.5 精密度实验 精密吸取标准溶液20 μL,在一天内连续进样测定5次,以及连续5 d进样测定,计算得绿原酸和木犀草苷的日内RSD分别为1.32%和1.79%,日间RSD分别为 1.74%和 2.33%。
2.1.6 回收率实验 精密称取已知绿原酸和木犀草苷量的提取物样品适量,置10 mL量瓶内,分别精密加入相当于已知对照品量80%、100%、120%的绿原酸、木犀草苷对照品,加入50%甲醇溶解、摇匀,滤过。将续滤液适当稀释后HPLC进样测定绿原酸和木犀草苷的量,计算得绿原酸和木犀草苷的平均回收率分别为103.29%和102.18%,RSD分别为 1.21%和 1.99%。
2.2 乙醇回流提取法 准确称取干燥的金银花药材50 g,加入一定量的乙醇,浸泡0.5 h后,选用L9(34)正交表进行试验,因素与水平见表1。药材回流提取2次后,合并每次实验的金银花提取液,过滤后减压浓缩、真空干燥后进行HPLC测定,计算绿原酸与木犀草苷的转移率,结果见表2。

表1 因素水平

表2 正交试验安排及结果
以绿原酸转移率为指标直观分析(见表3),影响因素顺序为A>B>C,即含乙醇量>乙醇用量>回流时间;最佳工艺为A1B1C1,即60%乙醇8倍量,回流提取2次,每次0.5 h。方差分析结果表明3个因素对绿原酸的提取效果均无显著性影响。

表3 绿原酸转移率直观分析
以木犀草苷转移率为指标直观分析(见表4),影响因素顺序为C>A>B,即回流时间>含乙醇量>乙醇用量;最佳工艺为A1B2C1,即60%乙醇10倍量,回流提取2次,每次0.5 h。方差分析结果表明3个因素对木犀草苷的提取效果均无显著性影响(P>0.05)。
为兼顾绿原酸和木犀草苷的提取效果,结合两者的转移率计算,总转移率评分=绿原酸转移率/最高值×50+木犀草苷转移率/最高值×50,以总转移率评分为指标来对正交试验结果进行分析(见表5),则影响因素顺序为C>A>B,即回流时间>含乙醇量>乙醇用量;最佳工艺为A1B1C1,即60%乙醇8倍量,回流提取2次,每次0.5h。方差分析结果表明3个因素对两成分的总提取效果均无显著性影响(P>0.05)。

表4 木犀草苷转移率直观分析

表5 总转移率评分直观分析
2.3 乙醇超声提取法 准确称取干燥的金银花药材50 g,加入一定量的乙醇,浸泡0.5 h后,选用L9(34)正交表进行试验,因素与水平表见表6。药材提取后,合并每次实验的金银花提取液,过滤后减压浓缩、真空干燥后进行HPLC测定,计算绿原酸与木犀草苷的转移率,结果见表7。
以绿原酸转移率为指标直观分析(见表8),影响因素顺序为A>B>D>C,即含乙醇量>超声功率>超声时间>乙醇用量;最佳工艺为A1B2C3D2,即60%乙醇12倍量,超声功率240W,超声1.0h。以离差平方和最小的因素项(C项)为误差项进行方差分析,结果表明A、B、D 3个因素对绿原酸的提取效果均无显著性影响(P>0.05)。
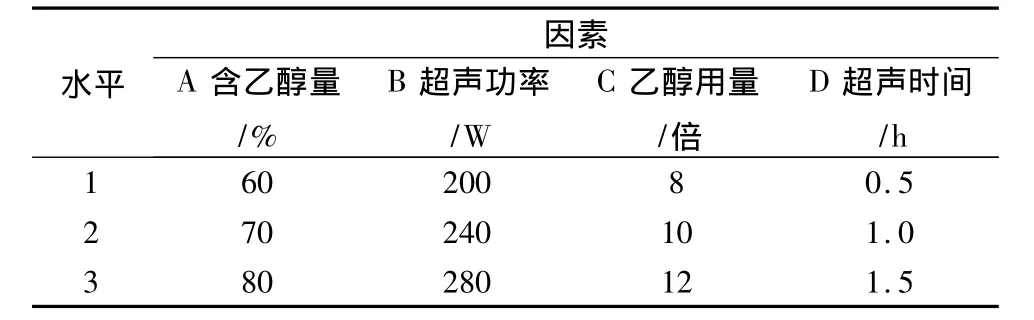
表6 因素水平表
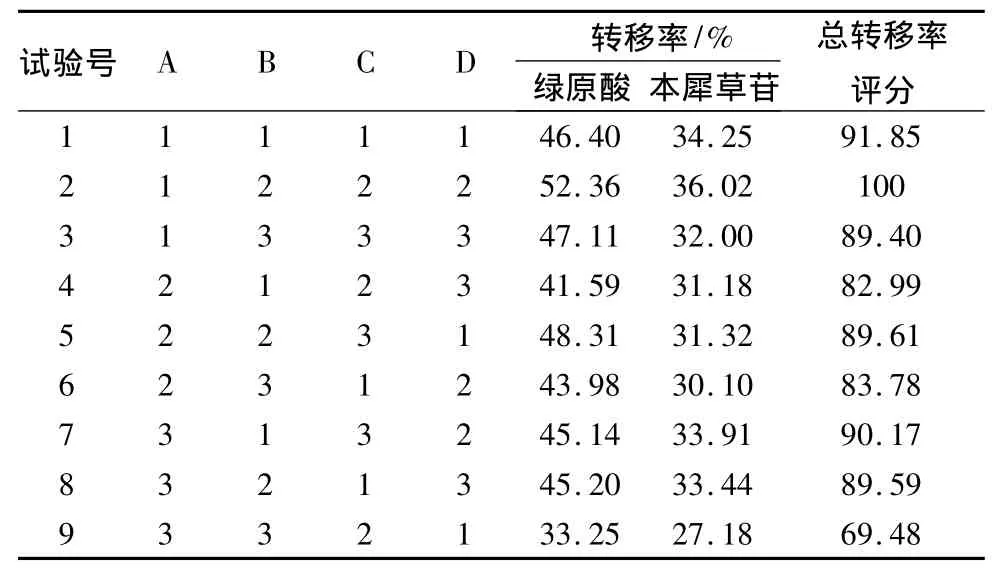
表7 正交试验安排及结果
以木犀草苷转移率为指标直观分析(见表9),影响因素顺序为B>A>D>C,即超声功率>含乙醇量>超声时间>乙醇用量;最佳工艺为A1B2C1D2,即60%乙醇8倍量,超声功率240W,超声1.0h。以离差平方和最小的因素项(C项)为误差项进行方差分析,结果表明A、B、D 3个因素对木犀草苷的提取效果均无显著性影响(P>0.05)。

表8 绿原酸转移率直观分析

表9 木犀草苷转移率直观分析
以总转移率评分为指标直观分析(见表10),影响因素顺序为B>A>D>C,即含乙醇量>超声功率>超声时间>乙醇用量;最佳工艺为A1B2C3D2,即60%乙醇12倍量,超声功率240 W,超声1.0 h。以离差平方和最小的因素项(C项)为误差项进行方差分析,结果表明A、B、D 3个因素对两者的总提取效果均无显著性影响(P>0.05)。

表10 总转移率评分直观分析
2.4 不同工艺的比较 准确称取干燥的金银花药材50 g,按上述两种提取方法的最佳工艺进行提取,制备样品并进行HPLC测定,计算绿原酸与木犀草苷的转移率,结果见表11。
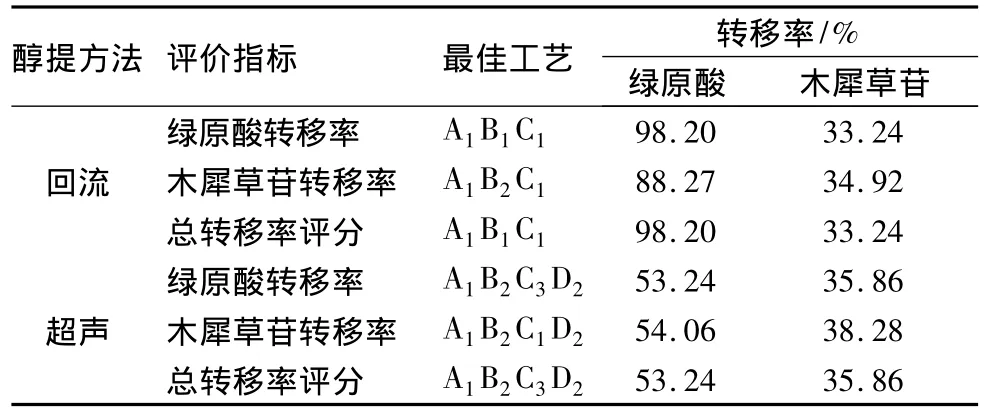
表11 几种最佳工艺提取效果的比较(n=3)
由上表可见,以绿原酸转移率为指标,乙醇回流法显著优于超声法;若以木犀草苷转移率为指标,则超声法略优于回流法。同一提取方法,评价指标不同,得到的最佳工艺也有差异,对两种成分的提取效果略有不同。但以总转移率评分为指标综合评价的结果与以绿原酸转移率为指标一致。
3 讨论
本研究建立的HPLC方法可用于金银花中绿原酸和木犀草苷的同时测定,且含量均符合《中国药典》的要求,是对《中国药典》方法的一个补充。
木犀草苷是金银花用以区别山银花的特征性成分,具有很强的抗呼吸道合胞体病毒活性,也是其抗菌抗病毒有效成分之一[8]。因此,在金银花的提取工艺研究中,不能仅以单一成分为指标进行评价,否则不能反映两种甚至多种成分的综合提取效果,应结合药理学研究结果,选择合理的指标性成分,才能充分保证提取工艺的可行性和提取物的药效[9-10]。
实验结果表明,以绿原酸转移率为指标,回流法显著优于超声法;以木犀草苷转移率为指标,则超声法略优于煎煮法。综合指标评价结果与以绿原酸为指标一致,可能与木犀草苷的提取转移率偏低,对总转移率评分的贡献相对较小有关。另外,本研究中测定的是固体提取物中有效成分的转移率,木犀草苷的转移率偏低且远低于在提取液中的转移率,可能与其浓缩干燥过程中的稳定性有关。如何增加木犀草苷的提取率及改善其稳定性,充分保证金银花提取物的质量,还有待进一步研究。
[1]王天志,李永梅.金银花的研究进展[J].华西药学杂志,2000,15(4):292-298.
[2]Li Xiaoqin,Sun Xiaohong,Cai Shuang,et al.Investigation on the chemical constituents and variation of the flower buds of Lonicera species by UPLC-ESI-MS/MS and principle component ana lysis[J].Acta Pharm Sin.2009,44(8):895-904.
[3]Chai Xingyun,Li Songlin,Li Ping.Quality evaluation of Flos Lonicerae through a simultaneous determination of seven saponins by HPLC with ELSD[J].J Chromatogr A,2005,1070(1-2):43-48.
[4]国家药典委员会.中化人民共和国药典:2005年版一部[S].北京:化学工业出版社,2005:152-153.
[5]国家药典委员会.中化人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:205-206.
[6]刘祥兰,刘重芳,张 英,等.金银花中绿原酸提取工艺的比较和优化研究[J].中成药,2000,22(6):402-404.
[7]梁 丹,欧阳小光,熊万娜,等.星点设计-效应面法优选金银花中绿原酸回流提取工艺[J].广西中医学院学报,2006,9(4):58-60.
[8]马双成,刘 燕,毕培曦,等.金银花药材中抗呼吸道病毒感染的黄酮类成分的定量研究[J].药物分析杂志,2006,26(4):426-430.
[9]何显忠,兰荣德.金银花的药理作用与临床应用[J].时珍国医国药,2004,15(12):865-867.
[10]黄喜茹,刘伟娜,曹 冬.金银花的化学成分药理作用研究评析[J].中医药学刊,2005,23(3):418-419.
