雷氏大疣蛛毒素组分13对人宫颈癌细胞增殖的抑制作用
2011-07-25王恩军郭晓军袁洪水朱宝成
靳 祎, 王恩军, 郭晓军, 袁洪水, 朱宝成
(1.河北大学基础医学院,河北保定071000;2.河北农业大学生命科学学院,河北保定071001)
蜘蛛毒素是由神经毒性肽、蛋白质和低分子量物质所构成的复杂混合物,具有多种活性[1-2]。雷氏大疣蛛Macrothele raveni是最近发现的一种异仿科大疣蛛属蜘蛛新种[3]。有报道它可以抑制人肝癌BEL-7402、HepG2细胞和宫颈癌Hela细胞的增殖,主要是细胞周期相关基因c-myc表达减弱以及诱导p21基因的表达[4-6]。有关蜘蛛毒素抗肿瘤活性蛋白的分离纯化方面的研究,国内尚未见报道。对此,本实验采用反相层析法对雷氏大疣蛛毒素进行了分离纯化,收集到13个组分,通过采用MTT法检测各蛋白组分的抗肿瘤活性,发现具有抗肿瘤活性的组分4个,其中组分13的抑制作用较强,而且峰型较单一,适宜做进一步分离纯化。本实验就此组分对Hela细胞的抑制作用进行了研究,为雷氏大疣蛛毒素作为新型抗肿瘤药物的深入研究及临床应用提供参考依据。
1 材料与方法
1.1 实验材料
1.1.1 人宫颈癌细胞株Hela 由军事医学科学院提供。
1.1.2 试剂 雷氏大疣蛛毒素干粉购自广西南宁南方蜘蛛养殖研究所;胎牛血清购自中国医学科学院生物工程研究所;RPMI-1640培养基和胰蛋白酶购自GIBCO公司;顺铂购自齐鲁制药有限公司;四甲基偶氮唑盐(MTT)、胰蛋白酶、二甲基亚砜(DMSO)、乙二胺四乙酸(EDTA)购自Sigma公司;考马斯亮蓝R-250染液购自北京赛驰生物科技有限公司。
1.2 实验方法
1.2.1 Hela细胞的培养 接种宫颈癌Hela细胞于含10%胎牛血清的RPMI-1640培养基中,置于37℃,5%CO2饱和湿度的恒温培养箱中。细胞贴壁生长,0.25%胰蛋白酶消化,每周传代2次,取对数生长期的细胞用于试验。
1.2.2 雷氏大疣蛛毒素组分13的分离 将雷氏大疣蛛毒素粉末溶于双蒸水,质量浓度为50 mg/mL,14000 r/min离心10 min,取上清液,0.45 μm 滤膜过滤。将样品上样于AKTA explorer 100型蛋白液相色谱仪,采用反相层析法进行分离纯化,分步收集各个组分,将组分13置于超低温冰箱中直至成固态后,再放置于冷冻干燥机中,抽真空浓缩,直至样品完全干燥,置于-20℃冰箱保存。
1.2.3 MTT法检测各分离组分的抗癌活性 取对数生长期的Hela细胞,胰酶消化后充分吹打混匀成单细胞悬液,用RPMI-1640培养基调整细胞数,制成2×104个/mL的细胞悬液,加入96孔板中,每孔加入200μL。细胞贴壁培养24 h。实验分3组,空白对照组加生理盐水,阳性对照组加顺铂(质量浓度为20μg/mL),实验组加入不同质量浓度(分别为5 μg/mL、10 μg/mL、20 μg/mL、40 μg/mL)的毒素分离组分,每个剂量6个复孔,继续培养24h、48h和72h后,取出培养板每孔加入5 μg/μL的MTT液(RPMI1640培养基配制)20 μL,继续培养 4h,弃掉培养基,每孔加入 DMSO 150μL,震荡15 min,充分溶解结晶颗粒,于酶标仪上测定各孔吸光度值(A值),测定波长λ=570 nm,参考波长λ=630 nm,计算各分离组分对Hela细胞增殖的抑制率(Grow inhibitory rate,GIR),并计算活性蛋白组分对Hela细胞半抑制率(IC50)。所有试验均重复3次。
增殖细胞抑制率(%)=(1-实验组A值 /空白对照组A值)×100%
1.2.4 形态学变化 待Hela细胞进入对数生长期以1×105/孔的密度接种于48孔细胞培养板内,置于37℃,5%CO2饱和湿度的培养箱中24 h,实验组加入含20 μg/mL组分13的RPMI-1640培养基,对照组加入含生理盐水的培养基,继续培养48 h后观察细胞的形态学改变并摄片。
1.2.5 活性组分的SDS-PAGE电泳 采用SDS-PAGE检测抗癌活性蛋白组分的纯度和分子质量。分离胶浓度12%,pH8.8,浓缩胶浓度为 4%,pH 6.8,加速剂 N,N,N,N ˊ-四甲基乙二胺(TEMED)10μL,助凝剂10%过硫酸铵(APS)50μL,并且点上标准分子量蛋白。电泳结束后,取出凝胶并作标志,将凝胶放入染色盘中。加入考马斯亮蓝R-250染液染色,37℃保温染色30 min。倒出染色液,用蒸馏水洗胶板数次后加入乙酸、乙醇混合溶液脱色。反复漂洗,直至背景清晰为止,检测样品的分子量及成分纯度。
1.3 统计学方法 应用The SAS system 6.12统计软件进行数据分析。所有数据用均数±标准差表示。两组间数据用t检验。
2 结果
2.1 组分13对Hela细胞抑制作用的量效和时效关系 不同浓度的雷氏大疣蛛毒素组分13作用于体外培养的Hela细胞48h后,MTT结果显示组分13对Hela细胞具有显著的抑制作用,实验组与对照组比较,A值差异有统计学意义(P<0.01)。其抑制率随浓度的降低有所下降,在一定范围内呈浓度依赖性,量效关系良好(见表1)。
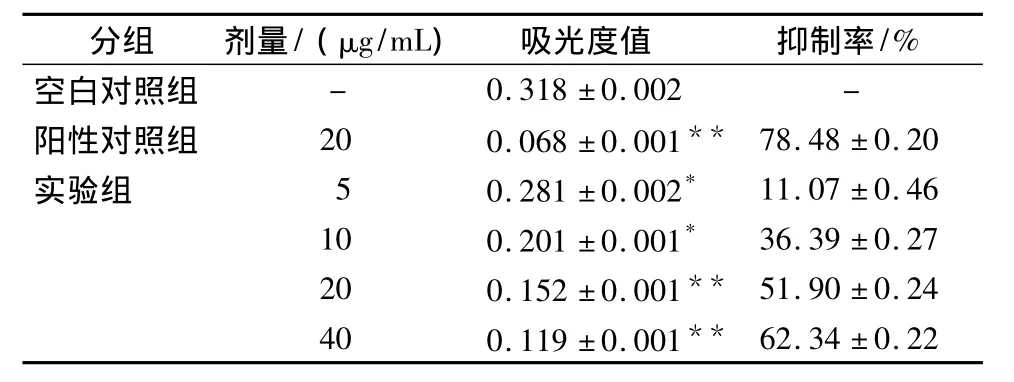
表1 雷氏大疣蛛毒素组分13对Hela细胞增殖的抑制作用
Hela细胞经雷氏大疣蛛毒素组分13作用于24、48、72 h后,结果表明细胞一直处于被抑制状态,且随着作用时间的延长,抑制作用明显增强,时效关系良好(见表2)。
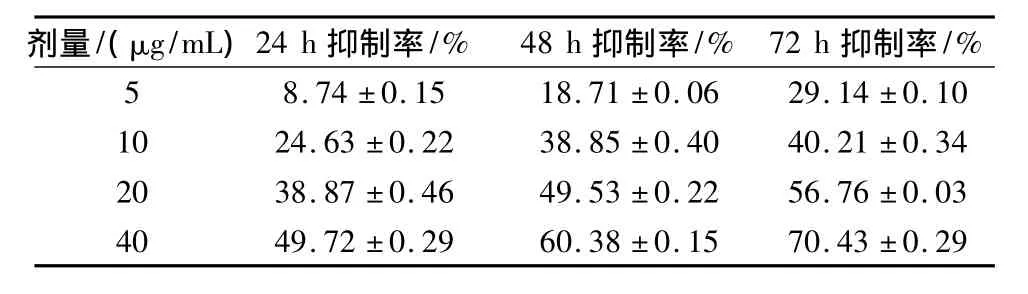
表2 雷氏大疣蛛毒素组分13不同作用时间对Hela细胞的抑制率
2.2 组分13对Hela细胞的IC50通过MTT法作出的Hela细胞生长曲线可以得到雷氏大疣蛛毒素组分13抑制细胞生长50%时的质量浓度为24 μg/mL(48 h)。
2.3 组分13的SDS-PAGE电泳 见图1。对组分13进行SDS-PAGE电泳分析,组分13显示出两个高分子量条带,分子量在大约80KDa左右。
2.4 形态学观察 正常宫颈癌Hela细胞生长良好,密度较大,部分重叠成簇,细胞为长梭形或多角形,隐约可见胞核圆形,位于中央,排列不规则,细胞界限清晰,培养液中仅见少许漂浮的细胞;Hela细胞经组分13处理后,细胞数量明显减少,细胞逐渐变为圆形,体积缩小,胞膜皱缩,细胞间连接消失,与周围的细胞脱离,培养液中有许多漂浮的呈桑葚样细胞,碎片较多。

图1 雷氏大疣蛛毒素组分13的SDS-PAGE电泳图谱
3讨论
宫颈癌是女性最常见的恶性肿瘤之一,在发展中国家排行榜首。中西医综合治疗癌肿是我国肿瘤研究的成就,中医中药治癌副作用小,减轻患者放疗、化疗的毒副反应,提高生存质量,延长生命,降低癌症的死亡率。因此新型抗癌药物的研发倍受人们关注。
蜘蛛毒素在抗癌方面的研究已经证实对多种肿瘤细胞具有明显的抑制作用[4-8],因此在新型抗肿瘤药物的研究方面显示出广阔的开发前景。本试验使用人宫颈癌Hela细胞作为肿瘤细胞模型,采用反相层析法对雷氏大疣蛛毒素进行了初步分离,并检测了各蛋白组分抗癌活性。其中组分13对Hela细胞呈现出较强的抗癌活性,显示较好的量效关系和时效关系。另外,SDS-PAGE电泳表明组分13是由分子量在80KDa左右的蛋白组成,为下一步蛋白的继续分离纯化及新型抗肿瘤药物的开发和研制奠定理论基础。
[1]费 瑞,杨 洋,张丽娇,等.蜘蛛毒素的研究概况及应用[J].吉林大学学报:医学版,2004,30(6):994-996.
[2]张鹏飞,陈 平,肖顺勇,等.大疣蛛毒素-VI的分离纯化及部分生物学活性鉴定[J].生命科学研究,2003,2(6):129-133.
[3]朱明生,李廷辉,宋大祥.中国大疣蛛属(蜘蛛目:异仿蛛科)一新种[J].河北大学学报:自然科学,2000,20(4):358-361.
[4]高 莉,封 巍,单保恩,等.雷氏大疣蛛蛛毒对人肝癌BEL-7402细胞增殖的抑制作用及其机制的研究[J].癌症,2005,24(7):812-816.
[5]Gao Li,Shen Jinbao,Sun Jie,et al.Effect of the venom of the spider Macrothele raveni on the expression of p21 gene in HepG2 cells[J].Acta Physio Sin,2007,59(1):58-62.
[6]Gao Li,Shan Baoen,Chen Jing,et al.Effects of spider Macrothele raven venom on cell proliferation and cytotoxicity in Hela cells[J].Acta Pharmacol Sin,2005,26(3):369-376.
[7]高 莉.雷氏大疣蛛蛛毒对人肿瘤细胞增殖的抑制作用[J].现代肿瘤医学,2005,13(1):10-13.
[8]封 巍,祝淑钗,高 莉.蜘蛛毒素对食管癌细胞株作用机制的初步研究[J].实用肿瘤杂志,2005,20(4):318-320.
