高龄老年人外周血树突状细胞亚群及表面标志的分析
2011-07-23张兴虎万文辉齐玉琴范振芳钱晓明
张兴虎,万文辉,齐玉琴,黄 方,范振芳,钱晓明
0 引 言
DC是已知体内功能最强的抗原提呈细胞,也是唯一能在体内直接激活初始(naïve)T细胞,促进 T辅助细胞和细胞毒性 T淋巴细胞(cytotoxic T lymphocyte,CTL)的生成,并能促进 B细胞生成抗体的免疫细胞,DC处于启动、调控、维持免疫应答的中心环节。在对抗原的摄取、加工、处理及呈递过程中,DC具有一般的共性,同时也表达出一些特有的生物学特性。增龄引起的 DC功能下降减弱了机体免疫防御及免疫监视作用,致使老年人容易患感染、肿瘤和自身免疫性疾病[1]。国外已有人对普通老年个体单核细胞诱生的 DC(MoDC)细胞表面标志和免疫学功能做了一定研究[2],但对高龄老年个体外周血 MoDC未见有相应的报道。本研究应用流式细胞术,检测高龄老年人 MoDC细胞亚群和细胞表面标志的变化,探讨其在免疫衰老中可能的作用。
1 材料与方法
1.1 主要试剂及设备 免疫荧光标记的三色人 DC检测试剂盒(3-color dendritic value bundle)购自美国Becton Dickinson公司,包括 FITC标记的 Lineage Cocktail 1(lin1,由 抗 CD3、 CD14、 CD16、 CD19、CD20、CD56单抗混合组成)、PE标记的抗 CD11c、PE标记的抗 CD123(抗 IL-3Rα)及 PC5标记的抗HLA-DR。流式细胞仪为BECKMAN COULTER公司的CYTOMICSFC500,分析软件 CXPAnalysis。HLA-DRFITC、CD1a-FITC、 CD40-FITC、 CD80-PE、 CD86-PE、CCR-7-FE、CD209-PE、同亚型对照抗体均购自BD-PharMingen公司;树突状细胞培养基 CellGro-DC购自 CellGenix公司;rhGM-CSF、rhIL-4购自上海飞捷公司;淋巴细胞分离液购自 TBD公司;MTT购自上海生工公司;OptiLyse C溶血剂购自 BECKMAN COULTER公司,倒置显微镜(Zeiss Axiovert 40)。
1.2 临床资料 观察组为高龄老年人 30例(≥80岁 ),平均(85.6 ±4.5)岁,其中男 21例,女 9例 ,排除有肿瘤、糖尿病、慢性感染、自身免疫性疾病、服用免疫抑制剂,并未接受免疫增强剂的治疗;普通老年人 30例作为对照组,年龄 60~70岁,平均(64.8±5.1)岁,其中男 18例,女 12例,条件同观察组。
1.3 DC亚群测定
1.3.1 免疫荧光标记 严格按照说明书操作规程,每个样本检测分别取 2管,各加 100μl全血,一管中加入 lin1-FITC、CD123-PE、HLA-DR-PC5,另一管中加入 lin 1-FITC、CD11c-PE、HLA-DR-PC5,闭光 ,室温孵育 15 min,然后每管加入 OptiLyse C溶血剂1m l,放置 5min,用含 1%的牛血清蛋白和 0.1%叠氮钠的 PBS洗涤 2遍重新悬浮,进行流式细胞学检测。
1.3.2 流式细胞仪检测和分析 通过前向散射角(FSC)和侧向散射角(SSC)设门去除死细胞和细胞碎片排除干扰,每个标本计数 50000个细胞,用CXP软件获取及分析 HLA-DR/lin1点图中的 HLADR阳性、lin 1弱阳性和阴性的细胞群体,以 CD11c和 CD123荧光抗体染色阳性细胞百分率记录结果。
1.4 DC体外培养 新鲜采集的高龄老年人和普通老年人抗凝外周全各 20m l,经淋巴细胞分离液梯度离心(20℃,400×g,20 min),取界面细胞。置入50ml离心管中,用无钙镁 PBS(pH7.2)悬浮细胞,离心(650×g,10min)洗细胞 1次,离心(200×g,10 min)洗细胞 2次,洗尽血小板,用 CellGro-DC培养基悬浮细胞,加入 24孔板,每孔 2.5×106细胞 /ml培养基,37℃ 5%CO2孵箱培养 2h后,吸弃上清,用预热的培养基轻轻洗培养板去除非贴壁细胞,即获得贴壁的单核细胞,每孔加 1ml CellGro-DC培养基,rhGM-CSF 100 ng/ml,rhIL-4 500 U/ml,于培养第 7天收集悬浮细胞,即为 DC。
1.5 DC表面标志测定 收集培养第 7天的悬浮细胞,用 PBS悬浮为 1×106细胞 /ml,100μl/管加入流式标记管,分别加入各标记抗体及对照抗体,终浓度5μg/ml,置暗处,4℃标记 30 min,加入 4 ml PBS,200×g离心 10min,去掉上清液,如此洗涤共 2次。流式细胞仪检测细胞表面 CD1a、人类白细胞抗原(human leukocyte antigens,HLA)-DR、CD80、CD86、CD40、趋化因子受体-7(chemokine receptor-7,CCR-7)和 CD209,设立 FSC/SSC,FL1/FL2分析窗口,在FSC/SSC将主细胞群体设门,在 FL1/FL2窗口分析阳性细胞比例,用直方图显示。
1.6 统计学分析 采用 SPSS10.0软件进行数据处理,计量资料用均数 ±标准差(s)表示,2组均数比较用秩和检验,以 P≤0.05表示有统计学差异。
2 结 果
2.1 DC亚群 外周血经抗体标记后,流式细胞仪分析 HLA-DR/lin1点图中的 HLA-DR阳性、lin 1弱阳性和阴性的细胞群体(B门),CD11c荧光抗体染色阳性细胞为 DC1细胞的百分率,CD123荧光抗体染色阳性细胞为 DC2细胞的百分率(图1)。
实验结果显示高龄老年人组 DC1占白细胞总数的百分比较普通老年人组明显低(P<0.05),DC1与 DC2的比值与后组也有明显差异(P<0.05)(表1),而 DC2占白细胞总数的百分比较普通老年人组无明显变化(P>0.05)。
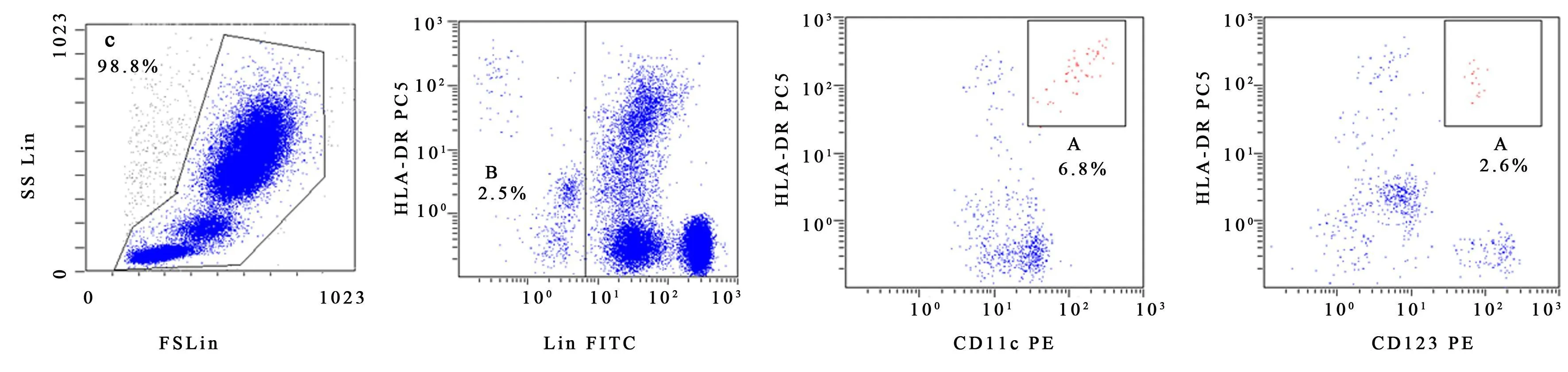
图1 流式细胞术检测 DC 1和 DC 2Figure 1 Detection of DC 1 and DC 2by flow cytometry
2.2 DC表面免疫表型分析 收集培养第 7天的悬浮细胞,流式细胞仪检测表明,高龄老年人组外周血培养获得的细胞表达 DC标志 CD1a的细胞阳性率低,为 5%~38%,而普通老年人组 CD1a细胞阳性率为 33%~92%。高龄老年人组 DC表达 CD40、CD80、CD86、CD209分子的水平均低于普通老年人组,而 2组间 HLA-DR、CCR-7表达无明显差异(表2,图2)。
表1 2组老年人DC亚群均值及比值的比较(s)Table 1 Com parison of the m ean value and ratios of DCs between the aged and elderly groups(s)
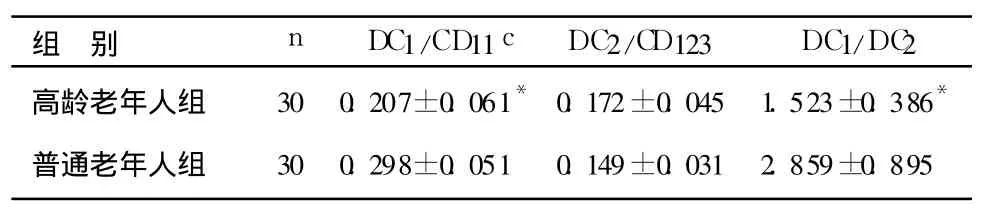
表1 2组老年人DC亚群均值及比值的比较(s)Table 1 Com parison of the m ean value and ratios of DCs between the aged and elderly groups(s)
与普通老年人组相比较,*P<0.05
组 别 n DC1/CD11c DC2/CD 123 DC1/DC2高龄老年人组 30 0.207±0.061*0.172±0.045 1.523±0.386*普通老年人组 30 0.298±0.051 0.149±0.031 2.859±0.895
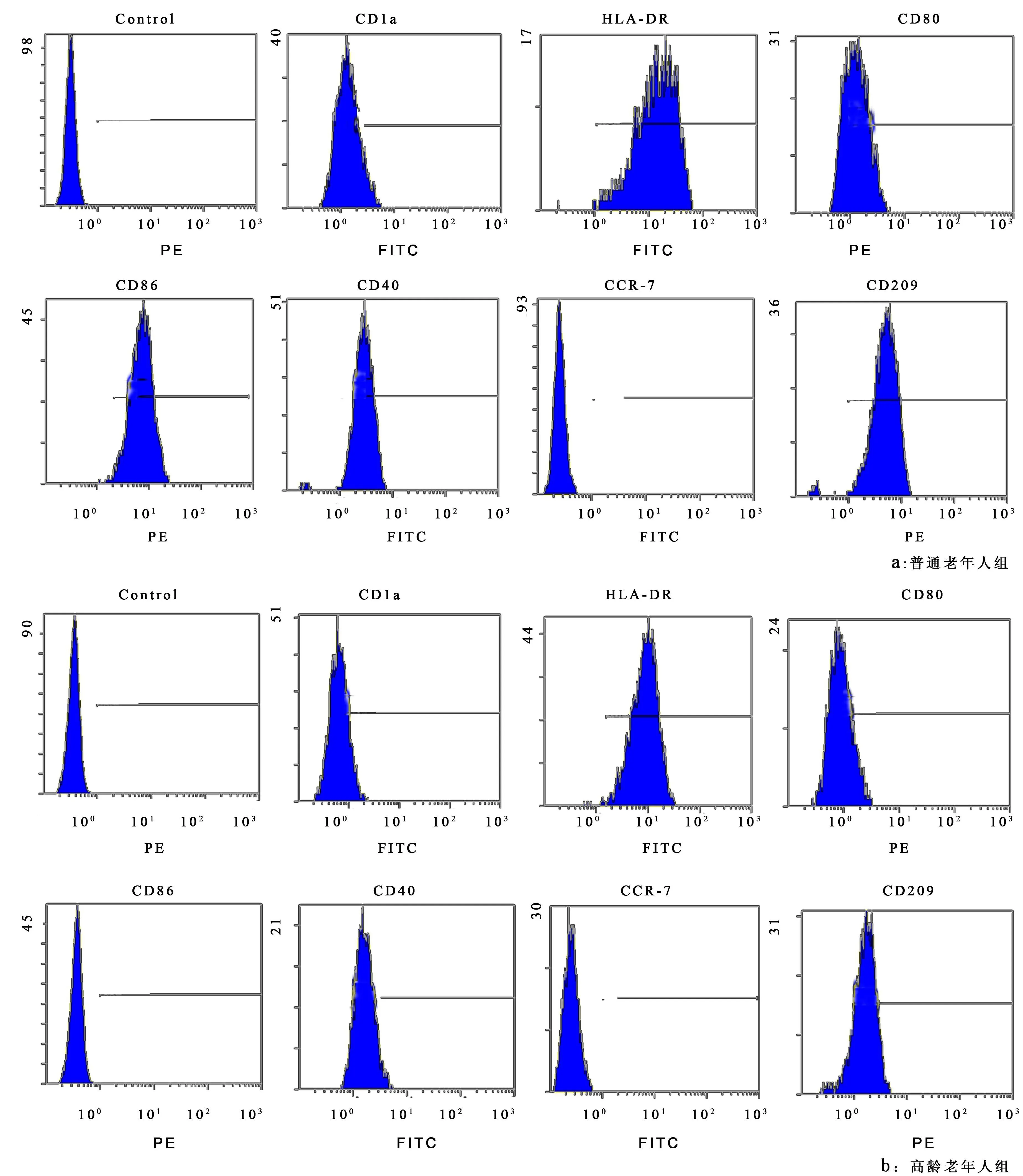
图2 体外培养第 7天时生成DC的免疫表型Figure 2 Imm unophenotypes of DCs at the 7th day of in vitro cu lture
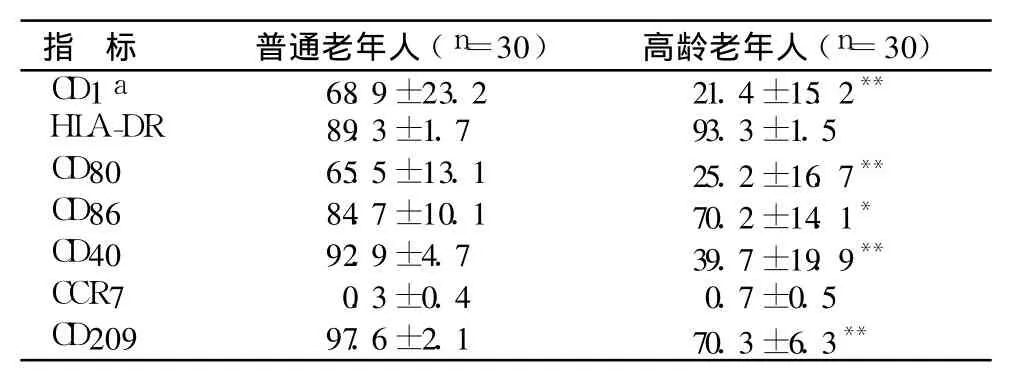
表2 2组 DC表面标志物阳性细胞的表达(%)Table 2 Exp ressions of DC surfacem arkers in the aged and elderly between tw o groups(%)
3 讨 论
免疫衰老是目前老年医学研究的热点之一,有研究表明 T细胞和 B细胞绝对数随着机体老化呈下降趋势,其表现是多样的,DC在摄取抗原或受到某些刺激因子刺激后,可以分化成熟,成熟的 DC迅速失去吞噬活性,并增加主要组织相容性复合物(major histocompatibility complex,MHC)分子与肽复合物的表达和稳定性,上调辅助刺激因子和黏附分子的表达,分泌趋化因子等细胞因子,DC的这一功能有效地将抗原递呈给初始 T细胞并使之激活。而机体衰老过程中 DC的分化和功能的改变已起了人们的关注,然而有关此方面的研究却少有报道[3-4]。
DC不管在其来源、表型还是在功能上都是异质性群体,机体内存在不同的 DC亚群,主要分为 2个DC亚群:DC1亚群为髓样细胞来源(myeloid DC),它以 CD11c+DC前体形式存在于外周血中,在炎症刺激时分化为成熟的 CD11c+DC,产生 IL-12,促进Th0细胞分化为 Th1细胞,介导细胞免疫;DC2亚群为淋巴样细胞来源(lymphoid DC),由其 CD123+DC前体细胞加 IL-3诱导后分化为成熟的淋巴样DC,诱导 Th2应答,介导体液免疫[5-6]。本研究结果显示高龄老年人组 DC1占白细胞总数的百分比较普通老年人组明显低(P<0.05),DC2占白细胞总数的百分比较普通老年人组无明显变化(P>0.05),DC1与 DC2的比值也较后组明显低(P<0.05),高龄老年人的细胞免疫功能明显下降的,TH1和 TH2细胞功能平衡失调,这与高龄老年人许多免疫相关性疾病的发生直接相关。
DC表面标志 CD1a、HLA-DR、CD80(B7-1)、CD86(B7-2)、CD40、CCR-7和 CD209参与了免疫反应的正向调节。CD1a是鉴定DC的最好标志,DC可以应用CD1a来提呈脂类抗原。 CD80、CD86、CD40是 DC表面的协同刺激分子,它们能使 DC有效摄取及加工提呈抗原,同时提供 T细胞活化所需的共刺激信号,从而启动T细胞应答[7],CD40可促进 B细胞的分化、发育、增殖和成熟,促进 T细胞的定向分化。HLA-DR为MHC-Ⅱ类分子,是成熟 DC抗原表面高表达的一类重要分子,主要参与识别和递呈外源性抗原。DC成熟过程中其细胞膜上 CCR7表达上调,在趋化 DC从外周组织迁移到次级淋巴器官中起关键作用[8],并可调控 DC的细胞结构、迁移速度和成熟等。成熟和未成熟的 DC均高表达模式识别受体 CD209(DC-SIGN),识别并帮助 DC捕获吞噬抗原。高龄老年人组外周血培养获得的细胞表达 DC标志 CD1a的细胞阳性率明显较普通老年人组低。高龄老年人组 DC表达 CD40、CD80、CD86、CD209分子的水平均低于普通老年人组,而 2组间 HLA-DR、CCR-7表达无明显差异。从本研究结果看,高龄老年人 DC的亚群和表面标志较普通老年人出现了一定程度的减退,这似乎可以解释临床高龄老人较普通老人更易患感染性疾病和肿瘤,并且DC的上述改变也可能与其他多种老年性疾病的发生有关。
当今世界人口老龄化是一个发展趋势,并且高龄老年人群在老年人群中所占的比例越来越大,高龄老年人的免疫功能低下致使感染性疾病的发病率明显增加,已严重影响了他们的生命质量,如何减少感染性疾病的发生率,提高他们的生活质量成为当今老年病学的一个重要的研究课题。本研究结果为进一步探究高龄老年免疫衰老的发病机制及有效干预提供了一个可靠的实验理论依据。
[1]Grawal A,Agrawal S,Gupta S.Dendritic cells in human aging[J].Exp Gerontol,2007(42):421-426.
[2]Linton PJ,Li SP,Zhang Y,et al.Intrinsic versus environmental influenceson T-cell response in aging[J].Immunol Rev,2005,205:207-219.
[3]Saurein M,Romani N,Grubeck B.Dendritic cells in old age-neglected by gerontology?[J].Mech Aging Dev,2000,121(113):123-130.
[4]Plackett TP,Boehmer ED,Faunce DE,et al.Aging and innate immune cells[J].J Leukoc Biol,2004,76(2):291-299.
[5]Liu YJ.Dendritic cell subsets and lineages,and their functions in innate and adaptive immunity[J].Cell,2001,106(3):259-262.
[6]相小松,李 宁,李秋荣,等.脓毒症过程中树突状细胞的研究进展[J].医学研究生学报,2009,22(6):651-654.
[7]Greenwald RJ,Freeman GJ,Sharpe AH.The B 7 family revisited[J].Annu Rev Immunol,2005,23:515-548.
[8]Pan MR,Hou MF,Chang HC,et al.Cyc looxygenase-2 up-regulates CCR-7 via EP2/EP4 receptor signaling pathways to enhance lymphatic invasion of breast cells[J].J Biol Chem,2008,283(17):11155-11163.
