重组免疫毒素抗 c-Met/PE38KDEL对人大肠癌细胞株增殖及凋亡的影响
2011-07-23朱晓娟张秀华范志宁季国忠
徐 伟,朱晓娟,蔡 楠,张秀华,范志宁,刘 政,季国忠
0 引 言
大肠癌是指起源于大肠黏膜上皮的恶性肿瘤。近几年发病率迅速上升,已成为我国最常见的 5大恶性肿瘤之一,5年生存率 60%左右,但治疗效果 30年来无显著提高[1-2]。李宏武等[3]应用逆转录聚合酶链反应(RT-PCR)法检测到在大肠癌组织中肝细胞生长因子(hepatic growth factor,HGF)及其受体 c-Met mRNA是过量表达的,且与肿瘤分化程度、淋巴结转移密切相关。本研究选择了全人源抗 c-Met单链片段及PE38KDEL表达融合IT,通过选择大肠癌细胞株Colo205及 SW480,观察重组 IT抗 c-Met/PE38KDEL对大肠癌细胞增殖及凋亡的影响,为大肠癌的靶向治疗提供实验依据。
1 材料与方法
1.1 细胞与试剂 大肠癌细胞株 Colo205及 SW480均为本实验室保存。重组 IT抗 c-Met/PE38KDEL为本课题组前期实验构建、表达并鉴定,能够特异性的结合并杀死 c-Met阳性肿瘤细胞株,而对 c-Met阴性细胞无结合活性[4](抗 c-Met单链片段是全人源噬菌体 Fab抗体库筛选出的抗 c-Met的特异性 Fab片段改造得到的,经检测显示抗c-Met保留有完整抗体分子结合抗原的特异性,且其免疫原性弱,是肿瘤导向治疗的理想载体[4]),DMEM细胞培养基购自 Inventrogen公司,胎牛血清购自杭州四季青试剂公司,CCK-8购自Sigma公司,[3H]-亮氨酸购自中国同位素有限公司,caspase检测试剂盒购自 Biovision公司,不含亮氨酸的 DMEM培养基购自北京清大天一生物技术有限公司。
1.2 细胞培养 大肠癌细胞株 Colo205及 SW480均在 37oC、5%CO2条件下,用含 10%胎牛血清(加青霉素 100U/m l、链霉素 100μg/m1)的 DMEM培养液常规培养。
1.3 CCK-8法检测 IT抗 c-Met/PE38KDEL对 2株大肠癌细胞的增殖抑制作用 取对数生长期Colo205及 SW480细胞 0.25%胰酶消化制成细胞悬液,细胞浓度 1×105/ml接种于 96孔板中,每孔90μl,空白孔加入 90μl DMEM,37℃ 、5%CO2培养葙培养 24h后每孔加药 10μl,使 IT终浓度分别为0.01、0.1、1、10、100 ng/ml,对照组加入等体积 PBS液,每个浓度 3个复孔。继续培养 24、48h后,每孔加入 CCK-8 10μl继续培养 4h,酶标仪 450nm波长下测定各孔吸光度 A值,按下列公式计算抑制率,以上实验重复 3次[5]。

1.4 蛋白合成抑制实验 本实验通过[3H]-亮氨酸掺入法检测重组 IT抗 c-Met/PE38KDEL对大肠癌细胞株 Colo205及 SW 480的蛋白合成抑制作用。取对数生长期的Colo205及 SW 480细胞0.25%的胰酶消化悬浮于含 10%胎牛血清的 DMEM培养液中,细胞密度 1×105/m l接种至 48孔板中,每孔加入200μl,37℃、5%CO2孵育箱中培养至细胞处于对数生长期后,更换细胞培养液,加入终浓度分别为0.01、0.1、1、10、100ng/m l的 IT,对照组加入等体积的 PBS液。继续培养 5、24h后,分别用预冷 PBS液及 0.1%胎牛血清洗涤 2遍后,在不含亮氨酸的DMEM培养基中加入[3H]-亮氨酸(终浓度为 2 μCi/m l),继续 37℃培养 45min,终止培养,把培养板放在冰盖上,每孔用 1ml 5%三氯醋酸洗涤 2遍(10min、5 min)后 ,每孔加入 0.5ml 0.1mol/L KOH,室温放置 10~15min。混匀,移入闪烁瓶中,测定每分钟脉冲数(次 /min),每孔 3个复孔,至少测 3遍。以实验组 cmp/对照组 cmp百分比来表示亮氨酸掺入率[6]。LOGTT法计算半数抑制浓度。本实验在南京医科大学同位素实验室完成。
1.5 Caspase活性测定 实验分 IT组及空白对照组。取对数生长期Colo205及 SW 480细胞 0.25%胰酶消化制成细胞悬液,接种至 150ml无菌细胞培养瓶中,37℃、5%CO2孵育箱中培养至对数生长期(细胞浓度为 106/ml),分别加入 IT至终浓度为 100 ng/ml,作用 24h后收集细胞,室温 1000 r/m in离心5min,离心半径 6 cm,弃上清,加入预冷的细胞裂解缓冲液 50μl,冰上孵育 10min,10 000×g,4℃离心1 min,回收上清于 EP管中,置于冰上。每管依次加入 50μl的 2×反应缓冲液(使用前 1m l的 2×反应缓冲液加 1.0mol/L DTT 10μl),再加入 4mm/L的底物 5 μl(终浓度为 200μmol/L)(DEVD-ρNA,caspase3;IETD-ρNA,caspase-8),37℃孵育 1~ 2 h。转移至 96孔板中,以分光光度计 405nm处测定底物裂解产生的荧光强度(均按试剂盒说明进行,以上实验相同条件下重复 3次)。
2 结 果
2.1 重组 IT抗 c-Met/PE38KDEL对大肠癌细胞株增殖抑制作用的影响 IT对 2株大肠癌细胞的增殖抑制作用都呈时间、剂量依赖关系(见图1),并随着 IT浓度的升高抑制作用逐渐增强。48 h 100ng/m l时对 Colo205及 SW480的增殖抑制作用最强,抑制率分别为 80.62%及 77.83%,与阴性对照组相比具有显著性差异(P<0.01)。
2.2 重组 IT抗 c-Met/PE38KDEL对大肠癌细胞株蛋白合成抑制的影响 IT对 2株大肠癌细胞株蛋白合成抑制作用见图2,可以看到,IT对细胞株的蛋白合成抑制呈时间、剂量依赖性。24h IT对Colo205及 SW480的 IC50分别为 6.14 ng/ml与 7.26ng/ml。在 IT(100 ng/ml)作用 24h后 ,对 Colo205及 SW480的的蛋白抑制率分别接近 90%及 85%。
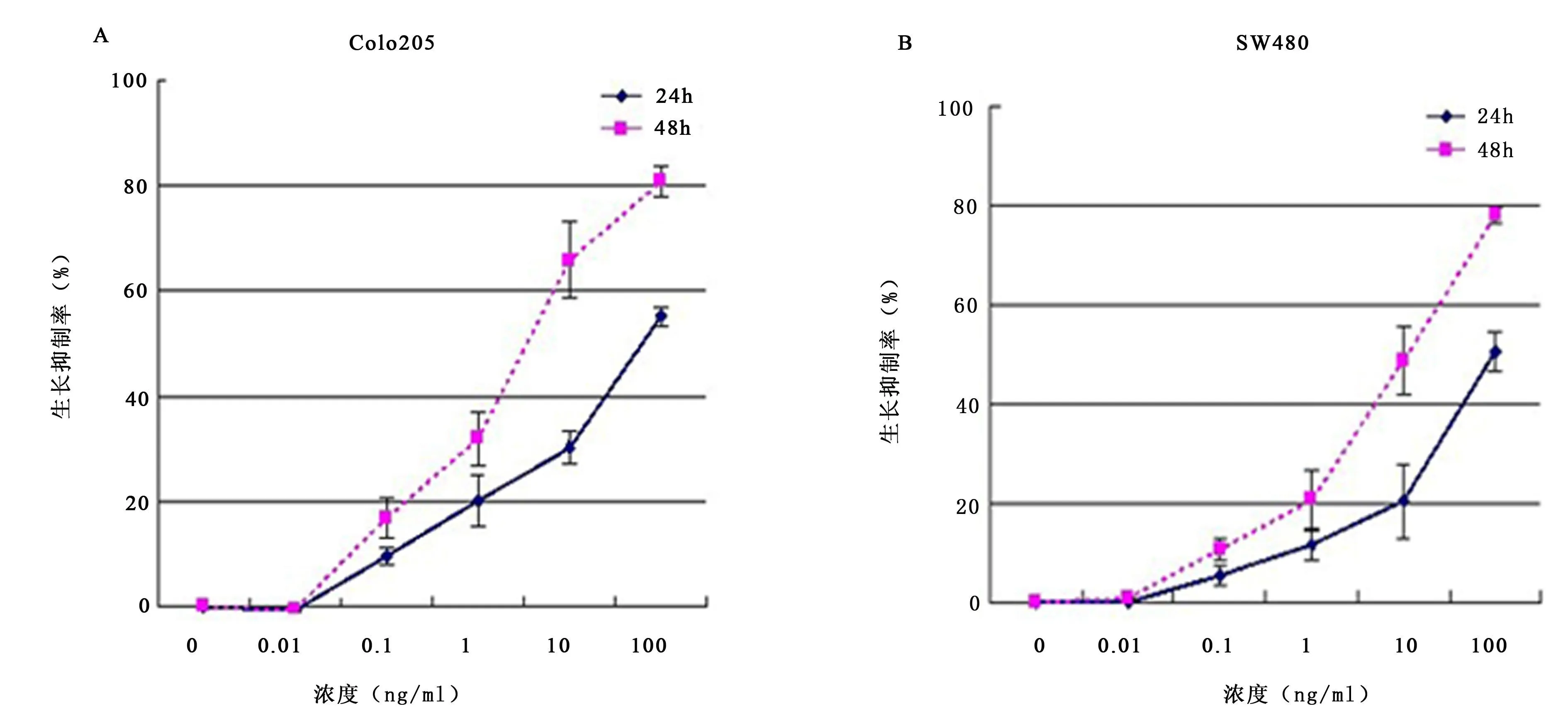
图1 重组IT抗 c-Met/PE 38KDEL对Colo205及 SW 480大肠癌细胞株增殖抑制作用的影响Figure 1 Inhibitory effect of IT anti-c-Met/PE38KDEL on the proliferation of human colorectal cancer cells
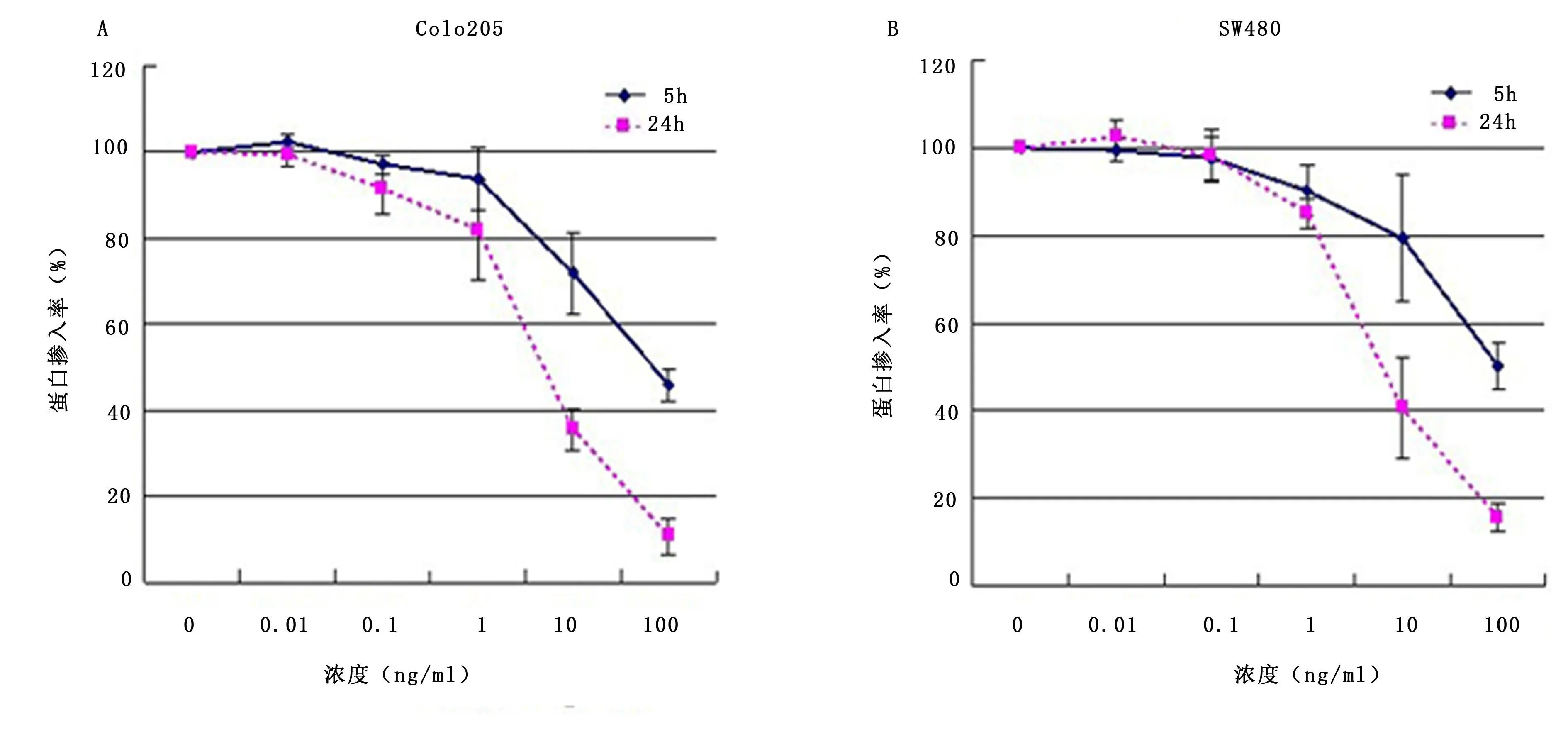
图2 重组IT抗c-Met/PE 38KDEL对大肠癌细胞株蛋白合成抑制的影响Figure 2 Inhibitory effect of IT anti-c-Met/PE38KDEL on the protein synthesis in human colorectal cancer cells
2.3 Caspase-3及 caspase-8活性检测 IT作用于 2株大肠癌细胞 24h后 caspase-3及 caspase8活性的变化见表1。2株细胞 IT组 caspase-3升高显著高于阴性对照组,与对照组比较差异均有统计学意义(P<0.01)。2株细胞 caspase-8蛋白也有轻度升高,提示抗 c-Met/PE38KDEL在诱导大肠癌细胞凋亡的过程中 caspases蛋白酶家族可能起了重要的作用。
表1 IT抗 c-Met/PE 38KDEL对 2株大肠癌细胞 caspase-3、8的影响(s)Table 1 Effect of IT anti-c-Met/PE 38KDEL on human colorectal cancer cell lines caspase-3and-8(s)
与对照组比较:*P<0.05,**P<0.01
细胞 Caspase-3(n=3)Caspase-8(n=3)对照组 IT组 对照组 IT组Colo205 0.101±0.047 0.370±0.093** 0.128±0.019 0.274±0.066*SW480 0.113±0.031 0.346±0.051** 0.119±0.054 0.218±0.089
3 讨 论
目前靶向治疗逐渐受到关注,IT有希望使肿瘤治疗从姑息性治疗转为根治[7]。IT是由特异性的单克隆抗体或生长因子与具有杀伤作用的毒素分子通过化学交联构建而成。与其他抗肿瘤药物相比,IT具有毒性强和特异性高的优点,在肿瘤治疗中显示出巨大的应用前景。c-Met是一种由 c-MET原癌基因编码的蛋白产物,与多种癌基因产物和调节蛋白相关,参与细胞信息传导、细胞骨架重排的调控,是细胞增殖、分化和运动的重要因素,抑制 c-Met的表达可抑制癌细胞的增殖、运动、侵袭和转移[8-9]。因此 c-Met也成为抗肿瘤治疗的重要靶点[10]。本实验观察抗c-Met/PE38KDEL对大肠癌细胞的增殖抑制作用,为大肠癌导向治疗奠定基础。
本研究表明,在 IT抗 c-Met/PE38KDEL作用于2株大肠癌细胞后,蛋白合成有明显的降低,24h后抗 c-Met/PE38KDEL在浓度为 100ng/ml时对 2株细胞的蛋白抑制率就达到了85%~90%,表明IT抗c-Met/PE38KDEL可能是通过抑制癌细胞蛋白合成来发挥抗癌作用的。
在凋亡程序的启动及执行过程中,caspases蛋白酶家族起了非常重要的作用。Caspase-3是caspase级联反应中最关键的效应蛋白酶,通常以酶原的形式存在,激活后通过酶解其特异性底物,使细胞发生凋亡。本实验分析 caspase-3、caspase-8活性在抗 c-Met/PE38KDEL干预前后的变化发现,caspase-3、caspase-8活性较对照组都有升高,提示Caspases蛋白酶家族在抗 c-Met/PE38KDEL诱导大肠癌细胞凋亡的过程起了较为重要的作用。
可以看到,重组 IT抗 c-Met/PE38KDEL对大肠癌细胞株有显著的增殖抑制及诱导凋亡的作用,因此本研究为大肠癌的靶向治疗提供了实验依据。
[1]高晓虹,安庆玉,李晓枫.大肠癌相关因素的条件 logistic回归分析[J].中国卫生统计,2009,26(6):605-607.
[2]杨 昀,蒋永来,季国忠.基质金属蛋白酶与大肠癌侵袭和转移关系的研究进展[J].医学研究生学报,2010,23(7):771-773.
[3]李宏武,单吉贤.人大肠癌组织肝细胞生长因子及其受体c-Met的表达[J].世界华人消化杂志,2004,12(9):2199-2201.
[4]朱晓娟,冯振卿,朱 进,等.重组免疫毒素抗c-Met/PE 38KDEL免疫毒素的构建、表达及纯化[J].南京医科大学学报,2009,29(7):920-924.
[5]任美萍,刘明华,肖顺汉,等.复尔康注射液诱导肝癌 HepG2细胞凋亡的研究[J].中药药理与临床,2008,24(4):52-54.
[6]Andersson Y,Juell S,FodstadØ.Downregulation of the antiapoptotic MCL-1 protein and apoptosis in MA-11 breast cancer cells induced by an anti-epidermal growth factor receptor-Pseudomonas exotoxin a immunotoxin[J].Int J Cancer,2004,112(3):475-483.
[7]Pastan I,Hassan R,Fitzgerald DJ,et al.Immunotoxin therapy of cancer[J].Nat Rev Cancer,2006,6(7):559-565.
[8]Christensen JG,Schreck R,Burrows J,et al.A selective small molecule inhibitor of c-Met kinase inhibits c-Met-dependent phenotypes in V itro and exhibits cytoreductive antitumor activity in Vivo[J].Cancer Res,2003,63(21):7345-7355.
[9]封 冰,陈龙邦.肝细胞生长因子受体/表皮生长因子受体交互作用与肿瘤耐药[J].医学研究生学报,2010,23(5):531-534.
[10]Derksen PW,de Gorter DJ,Meijer HP,et al.The hepatocyte growth factor/Met pathway controls proliferation and apoptosis in multiple myeloma[J].Leukem ia,2003 7(4):764-774.
