肾集合管癌的PET/CT显像诊断
2011-07-23胡裕效王新刚
胡裕效,朱 虹,王新刚
0 引 言
CDC是一种罕见的肾恶性肿瘤,因它具有独特的病理特点和生物学行为,而被WHO分为独立的一类。有关CDC的影像学表现(主要是CT)国内仅有少量案例报道,其采用18F-FDG PET/CT目前国内尚未见报道,现报道3例经病理证实为CDC患者的PET/CT表现(2例为治疗前患者,1例为术后复发患者),对该肿瘤的发病机制、生物学特点、诊断、鉴别诊断及术后随访等方面作初步探讨,以提高对该病的认识。
1 资料与方法
1.1 临床资料 病例1,女,70岁,因不规则发热2个月,左侧腰部不适半个月就诊。2007年4月,患者无明显诱因出现不规则发热,体温38.4~40℃,多于午后体温最高,发热前有畏寒,伴疲劳、乏力,无肉眼血尿、无腰痛和腹部包块,无尿频尿急等尿路刺激症状,无体重减轻。患者在外院行抗感染治疗,且曾接受抗痨治疗1周,治疗效果不明显,仍时有发热。B超显示左肾上极占位,肝肾功能、肿瘤标记物、结核菌素试验均为阴性。患者近2周出现左侧腰部不适,为进一步明确诊断在我科行PET/CT检查。
病例2,男,46岁。因左侧胸背部疼痛1年余就诊。2009年4月,患者无明显诱因出现左侧胸背部隐痛,同年7月单位体检时,胸部透视未发现明显异常,但左侧胸痛症状时有发作,性质同前,未经药业物治疗,休息后好转。2010年8月再次体检,胸部透视发现左侧胸壁占位。病程中患者无发热、咳嗽、咳痰、咯血等症状。为进一步检查,于同年8月在我科行PET/CT检查。
病例3,女,30岁。因反复肉眼血尿伴右侧腰痛8个月就诊。2010年1月,患者无明显诱因出现肉眼血尿,表现为全程血尿,鲜红色,偶伴血凝块,反复发作,偶伴右侧腰部酸痛。双肾CT提示:右肾中上极囊实性肿块,考虑肾癌可能性大。同年5月,在全身麻醉下行腹腔镜下右肾恶性肿瘤根治性切除术,术后病理:右肾CDC,癌组织侵犯右侧肾盂,右输尿管切缘未见癌组织,送检“肾门部淋巴结”示癌结节。同年6月,给予吉西他滨化疗预处理,用法:第1天和第8天,1.2 g/次静脉滴注;同时给予细胞因子诱导的杀伤治疗(cytokine induced killer,CIK),并对肾癌手术区及淋巴引流区适形放疗,剂量为50 GY/(25次·34 d)。为进行疗效观察,于同年9月在我科行PET/CT检查。
1.2 显像方法 使用德国西门子公司Siemens Biograph sensation 16 PET/CT成像仪(CT为16排螺旋CT)。18F-FDG由加拿大EBCO TR19型医用回旋加速器和北京派特生物技术公司PET-FDG-IT-1自动化学合成仪生产,合成效率70%,18F-FDG放射化学纯度>95%。患者禁食6 h以上,测定血糖 <6.30 mmol/L后,经肘静脉注射18F-FDG 8 ~12 mCi,安静避光环境平卧60~70 min后显像,显像包括平扫CT和发射扫描。患者保持平静呼吸,先行全身显像,扫描范围包括颅底至股骨上1/3,共扫描6~7个床位,每个床位3 min;后行脑显像,扫描范围包括颅顶至颅底,1个床位,计10 min,2次PET显像均采用3D采集模式。经衰减校正后行迭代法重建,获得横断,矢状冠状面CT、PET及PET/CT融合图像,层厚5 mm。
1.3 图像分析 所有图像均由2~3名有经验的核医学科医师共同阅片,结合PET/CT融合图像,对PET图像和平扫CT图像进行帧对帧对比分析。先进行视觉观察,主要分析患者病灶的部位、大小、形态、对18F-FDG摄取程度等;随后进行半定量分析,测量病灶的SUV,以SUV≥2.5作为阳性诊断标准(即18F-FDG代谢增高)。
2 结 果
2.1 PET/CT显像表现 病例1,左肾上极见一类圆形软组织密度病变,约4.5 cm ×5.5 cm,呈等密度,内部密度尚均匀,边缘模糊,侵犯左肾髓质及左肾皮质,且与正常肾组织分界不清,18F-FDG代谢明显上升,SUV=11.1,考虑为左肾恶性肿瘤可能性大。
病例2,右肾下极可见一类圆形软组织密度肿块,约2.7 cm×2.4 cm,病灶内部可见点状钙化灶,余病灶密度尚均匀,呈等密度,边缘模糊,侵犯右侧肾髓质,并向右肾实质及右侧肾盂浸润,与正常肾组织分界不清,18F-FDG代谢明显上升,SUV=7.1;另在左侧胸膜可见多发类圆形占位性病灶,最大1枚约4.5 cm ×3.0 cm,边缘光滑,18F-FDG 代谢明显上升,SUV=11.2;考虑为右肾恶性肿瘤伴左侧胸膜多发转移可能性大。见图1。
病例3,右肾癌术后,右肾缺如,见肠管影疝入;右侧后腹膜见结节样增厚,18F-FDG代谢呈结节样增高,SUV=3.9;右侧腰部皮下脂肪内(手术入路)见软组织密度结节,约1.4 cm×1.6 cm,边缘模糊,18F-FDG代谢上升,SUV=3.5;左侧锁骨上窝见2枚肿大淋巴结,较大1枚约2.4 cm ×3.3 cm,18F-FDG代谢上升,SUV=2.6;考虑为右肾癌术后,手术切口及右肾区后腹膜处肿瘤复发伴左锁骨上淋巴结转移可能性大。见图2。
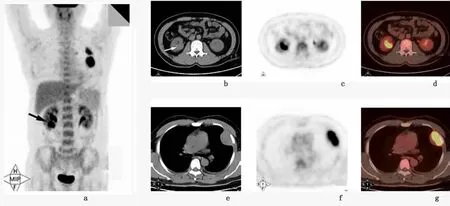
图1 病例2的PET/CT改变Figure 1 PET/CT exam ination of case 2
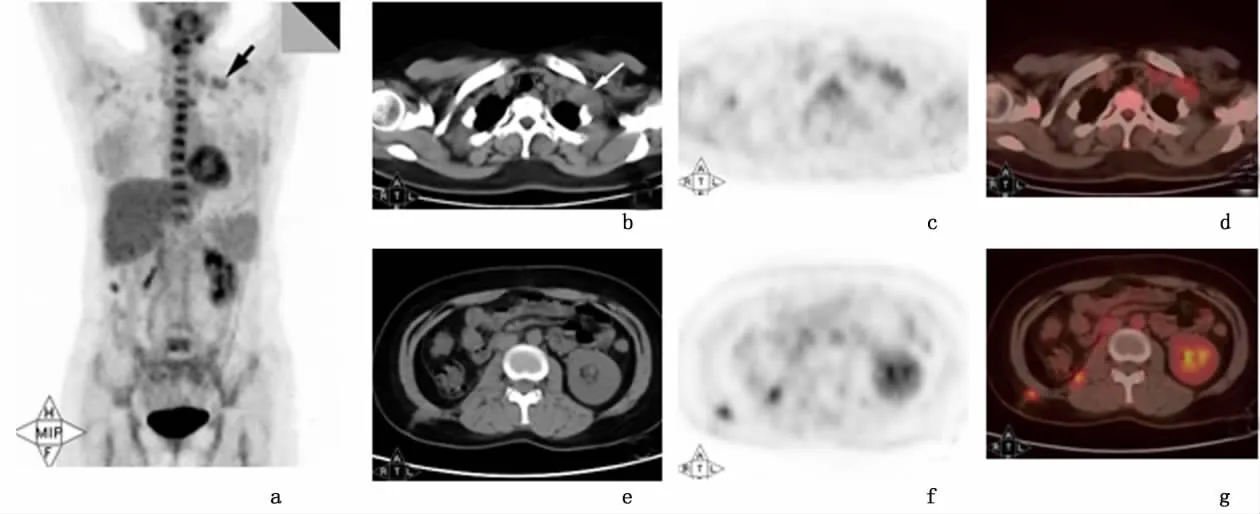
图2 病例3的PET/CT改变Figure 2 PET/CT exam ination of case 3
2.2 最后诊断 病例1,于2007-07-05在全身麻醉下行腹腔镜下左肾癌根治术,术后病理示:左肾集合管癌,输尿管切缘及肾上腺未见癌组织,肾门淋巴结(3/7)见癌转移;免疫组化:34βE12 3(+),CK8/18 3(+),CK19 3(+)。
病例2,先于2010-08-23行左侧胸膜病变活检,病理示:活检组织示恶性肿瘤伴坏死,结合临床和免疫组化标记考虑肾恶性肿瘤转移;免疫组化:Vim 3(+),CD10(+),CK7(-),CK20(-)。后于2010-09-02在全身麻醉下行腹腔镜下右肾癌根治术,术后病理示:“右肾”低分化癌,考虑为集合管癌,输尿管切缘未见癌组织,肾门淋巴结(1/1)见癌转移,免疫组化:Vim 2(+),CK7(-),CD10(-),CD117(-),E-cad(-),Ksp-cad(-)。
病例3,术后病理如前所述,后经临床综合手段证实为肿瘤复发伴转移,加用分子靶向药物舒尼替尼抗肿瘤治疗,现患者病情稳定。
3 讨 论
3.1 CDC的临床及病理特点 CDC是肾癌的一种罕见类型,约占恶性肾肿瘤的1%[1],它起源于肾集合管(Bellini管)上皮细胞,其证据是CDC位于肾髓质,其瘤细胞与肾集合管上皮细胞相似。CDC可表达高相对分子质量的角蛋白(Keratins),这也可证明其起源于集合管上皮。CDC有易向肾内、外浸润以及局部淋巴结转移和远处血行转移的特点,一般发生于20~80岁,平均年龄约53岁,男性多于女性,本文患者中女性多于男性是由于统计样本量少所致。CDC由原发病灶所引起的症状主要包括腹痛(腰痛)、血尿及腹部包块三联征,以上临床症状与其他类型肾癌相似,无特异性。CDC起病隐匿,有时首发症状可以为转移性病灶所致,如病例2。CDC的最后诊断依赖病理学检查[2],其中6条主要诊断标准为:①肿瘤较小时应局限于髓质;②不规则的管状结构伴细胞核高分级;③炎性促纤维反应性间质伴较多的中性粒细胞浸润;④瘤细胞高相对分子质量角蛋白阳性;⑤瘤细胞表达荆豆素;⑥缺乏尿路上皮癌特征。此外还有4条次要标准:①肿瘤较大时位于肾中央区;②伴有促纤维增生性间质的宽乳头状结构;③有广泛的肾内、肾外、淋巴结和静脉侵犯;④肿瘤临近的肾小管上皮有非典型性。
3.218F-FDG在肿瘤细胞中的集聚机制18F-FDG是目前最常用的正电子示踪剂,它是一种葡萄糖类似物,其被细胞摄取和在细胞内代谢的前一阶段与葡萄糖类似,通过细胞膜表面的葡萄糖转运蛋白(glucose transporter;GLUT)转运至细胞内,然后在己糖激酶(hexokinase;HK)的作用下磷酸化,生成18F-FDG-6-磷酸盐,后者既不能继续参与糖代谢反应,又不能自由进出细胞膜而被滞留在细胞内。大多数恶性肿瘤细胞对葡萄糖消耗量明显增加,导致对18F-FDG摄取上升[3-4],其机制已基本明确:①由于癌基因异常调控造成GLUT过度表达;②由于肿瘤细胞内HK含量上升或活性异常。动物实验表明,在已发现的GLUT 5种亚型(分别为GLUT1~5)中,GLUT1相对于细胞总的HK活性对18F-FDG的摄取起主要作用[5-6]。
3.3 PET/CT显像在CDC诊断中的应用
3.3.1 CDC的 PET/CT表现特点 CDC是一种极少见的恶性肾肿瘤,对于它的影像学表现文献报道很少,而且多数集中在CT影像的总结分析,对于PET/CT表现尚未见国内报道。本组总结2例手术前患者的PET/CT表现,并结合有关文献[7],CDC的PET/CT影像学表现具有以下特点:①CDC起源于集合管,多数位于肾髓质,可伴有肾皮质及肾盂侵犯。②CDC兼具浸润性生长和膨胀性生长2种生长方式,表现为肿块无包膜,与正常肾组织分界模糊,并可出现病侧肾轮廓改变。③CDC多数表现为实性或囊实性肿块,部分病灶内部可见钙化(病例2患者瘤灶内即出现钙化灶)。④与最常见的恶性肾肿瘤——肾透明细胞癌不同,CDC一般均表现为18F-FDG代谢明显增高灶[6,8]。⑤CDC 可侵犯肾周组织,表现为肾周筋膜增厚,肾周脂肪囊内出现软组织密度的结节及索条状致密影(本组未见)。⑥CDC可较早出现局部淋巴结转移和远处血行转移,本组2例术前患者均出现肾门淋巴结转移,但PET/CT未见显示,究其原因,可能与淋巴结体积较小有关。
3.3.2 CDC的鉴别诊断 ①与肾透明细胞癌的鉴别:肾透明细胞癌起源于肾皮质的肾小管上皮细胞,大多数呈膨胀性生长,由于肿瘤组织对周围肾组织挤压,引起缺血和纤维组织增生而形成假包膜,故肿瘤常表现为边缘清晰,少有肾被膜、肾周脂肪囊或肾筋膜受累,肿瘤较大时可伴有肾动、静脉侵犯及肾静脉内癌栓形成。肾透明细胞癌与 CDC相比,对18F-FDG摄取程度较低,有部分肾透明细胞癌对18F-FDG摄取甚至低于正常肾组织[8]。②与肾盂癌的鉴别:肾盂癌在早期就有血尿及肾盂、肾盏扩张积水出现。影像学表现为以广基与肾盂内壁相连的菜花样软组织肿块,肿瘤较大时可沿肾盂、肾盏向肾髓质及肾皮质内生长,也可沿输尿管进行种植转移,但其最大截面位于肾盂区。CDC起源于肾髓质区域,可向肾皮质或肾盂侵犯,其最大截面通常位于肾髓质区。当肿瘤体积较大时,对上述2种肿瘤鉴别困难,最终诊断依赖病理检查。③与肾结核的鉴别:肾结核大多有肺结核病史。影像表现为肾轮廓增大,病灶中心见干酪样坏死,钙化常见。病变后期在肾周可形成冷脓肿。
3.4 PET/CT显像在CDC随访中的应用 病例3患者在肾切除4个月后,行PET/CT显像发现,肿瘤复发伴远处淋巴结转移。我们认为,PET/CT显像与传统影像学相比有以下3方面的优势:①PET/CT显像是一种全身性显像方式,检查范围广,容易发现远处淋巴结或组织器官转移,此病例即发现患者左侧锁骨上窝淋巴结转移。如果只按照常规影像方法,给予腹部的CT或MR检查,则会遗漏此病灶。②有助于鉴别肿瘤复发或瘢痕组织增生:患者手术后会形成瘢痕组织,并造成局部解剖形态学改变,传统影像学有时难以区分。但PET/CT显像是一种集解剖影像、功能影像为一体的高端检查设备,在肿瘤复发中呈高代谢,在瘢痕组织中呈低代谢,能有效区分2种病变。此患者在术后多次行腹部CT检查均未发现明显异常,而PET/CT显像发现,手术切口及右肾区后腹膜处肿瘤复发。③有助于发现隐匿部位:诸如脊髓、心肌等处的小转移灶[9-11],本例患者未见。
此外,PET/CT显像在CDC治疗计划的制订与修改、治疗效果监测及预后评估等方面也有积极的作用。
[1]Chao D,Zisman A,Pantuck AJ,et al.Collecting duct renal cell carcinoma:Clinical study of a rare tumor[J].JUrol,2002,167(1):71-74.
[2]郭庆明,何 杰,魏晓莹,等.肾脏集合管癌的诊断和鉴别诊断[J].东南大学学报(医学版),2006,25(2):110-113.
[3]吉蘅山,朱 虹,胡裕效,等.原发性皮肤淋巴瘤18F-FDG PET/CT显像分析[J].医学研究生学报,2009,22(5):559-560.
[4]胡裕效,卢光明,朱 虹,等.PET/CT与磁共振灌注成像在脑胶质瘤分级诊断中的应用[J].医学研究生学报,2010,23(1):67-71.
[5]Chung JK,Lee YJ,Kim C,et al.Mechanisms related to[18F]fluorodeoxyglucose uptake of human colon cancers transplanted in nude mice[J].J Nucl Med,1999,40(2):339-346.
[6]胡裕效,朱 虹.PET显像在原发性肾细胞癌中的研究进展[J].肿瘤学杂志,2008,14(10):852-855.
[7]Pickhardt PJ,Siegel CI,Mclarney JK,et al.Collecting duct carcinoma of the kidney:Are imaging findings suggestive of the diagnosis?[J]AJR,2001,176(3):627-633.
[8]Ye XH,Chen LH,Wu HB,et al.18F-FDG PET/CT evaluation of lymphoma with renal involvement:Comparison with renal carcinoma[J].South Med J,2010,103(7):642-649.
[9]Poggi MM,Patronas N,Buttman JA,et al.Intramedullary spinal cord metastasis from renal cell carcinoma:Detection by positron emission tomography[J].Clin Nucl Med,2001,26(10):837-839.
[10]Gaetani P,Di-Ieva A,Colombo P,et al.Intradural spinal metastasis of renal clear cell carcinoma causing cauda equina syndrome[J].Acta Neurochir(Wien),2004,146(8):857-856.
[11]Garcia JR,Simo M,Huguet M,et al.Usefulness of 18-fluorodeoxyglucose positron emission tomography in the evaluation of tumor cardiac thrombus from renal cell carcinoma[J].Clin Transl Oncol,2006,8(2):124-128.
