过氧化物酶体增殖激活受体γ或α在改善HepG2细胞糖代谢中的作用
2011-07-18宋璐璐萧建中邢小燕杨文英
宋璐璐 ,萧建中,邢小燕 ,张 敏,杨文英*
(1.北京协和医学院 研究生院,北京 100730;2.中日友好医院 内分泌与代谢病中心,北京 100029;3.北京大学医学部 研究生院,北京 100091)
过氧化物酶体增殖激活受体(peroxisome proliferator-activated receptors,PPAR)家族是一组经典的核受体,参与细胞能量代谢、炎症、增殖及分化的控制,尤其是糖脂的代谢。其中PPAR-α和PPAR-γ与代谢的关系更为密切。PPAR-γ主要在脂肪组织表达,也在肝脏、骨骼肌、胰腺及其它组织低表达[1]。主要调节脂质储存,促进糖代谢,抑制炎症及诱导脂联素的合成与分泌[2]。PPAR-α主要在脂代谢活动旺盛的组织表达,如肝脏、脂肪、肌肉等[3],是脂肪酸氧化的调节元件,参与脂肪酸代谢的调控,增加脂肪酸线粒体摄取和β氧化的基因表达,并且促进肝脏糖原合成和酮体的生成,参与脂蛋白的组装。在心脏,PPAR-α还参与糖脂代谢转换的调控[4]。
关于PPAR-γ或PPAR-α在人肝细胞糖代谢中所扮演的角色,尚缺乏直接的证据。HepG2细胞是一种常用的肝癌细胞株,兼具肝细胞和肿瘤细胞的特征,能够表达多种肝脏特异的功能,因此被用于研究肝细胞生理或者作为肝细胞代谢研究的体外模型,也是生物人工肝的细胞源之一,本研究探讨PPAR-α和PPAR-γ受体在HepG2细胞糖代谢调节中的作用。
1 材料与方法
1.1 材料
WY14643,吡格列酮和棕榈酸购自美国Sigma公司;牛血清白蛋白(不含游离脂肪酸)购自德国Cabiochem公司;葡萄糖测定试剂盒(北京康泰临床检验试剂);丙酮酸测定试剂盒和乳酸测定试剂盒 (南京建成生物科技有限公司);Trizol(Invitrogen,美国),Real time-qPCR 试剂盒(Toyobo,日本)。WY14643和吡格列酮溶于二甲基亚砜,棕榈酸按6.8:1的比例与不含游离脂肪酸的牛血清白蛋白共轭耦合。
1.2 细胞培养
HepG2细胞在5%C02、37℃条件下培养于含10%胎牛血清、L-谷氨酰胺、丙酮酸钠、青霉素、链霉素和1g/L葡萄糖的DMEM培养基。细胞复苏传至第3代后进行分组实验。
1.3 葡萄糖消耗实验
以0.25%胰蛋白酶和0.02%EDTA消化细胞,将细胞悬液接种于96孔培养板,细胞生长至70%~80%密度后更换为含胰岛素(10-7M)的无血清无酚红低糖(1g/L)DMEM培养基,分别加入吡格列酮(10μM),WY14643(10μM),每组设 6 个平行孔,每孔100μl培养基,孵育24h后以葡萄糖氧化酶法测定培养基上清中葡萄糖浓度,计算绝对葡萄糖消耗量。然后每孔加入20μl MTT试剂,37℃孵育4h,DMSO充分溶解后测定吸光度,以此代表细胞活力,计算相对葡萄糖消耗量(绝对葡萄糖消耗量/细胞活力)。
1.4 胰岛素抵抗(IR)模型
IR的细胞模型建立参照文献[5]。HepG2细胞生长至50%~60%融合,更换含高浓度FFA(0.5 mmol/L)的低糖 DMEM 培养基培养24h,于4℃条件下用预冷0.01mol/L磷酸盐缓冲液(PBS)洗涤细胞3次,即成为具有IR的细胞模型,测定培养液中葡萄糖含量作为模型鉴定指标。模型建立后,分别用吡格列酮(10μM),WY14643(10μM),测定胰岛素刺激后的葡萄糖消耗量。
1.5 糖酵解产物测定
细胞种于96孔板,24h后无血清无酚红无丙酮酸钠的低糖DMEM培养基,分别加入吡格列酮(10μM),WY14643(10μM),继续孵育 24h,检测培养基中丙酮酸和乳酸含量。另外将细胞种于12孔板,每组设6个平行孔,给予药物处理24h后,以胰酶收获各瓶中全部细胞。离心,仅保留细胞沉淀,加入低渗盐溶液,使各样品细胞终浓度均为1×106/m1,反复冻融3次,用超声波振荡器处理1min,离心后保留上清,测定丙酮酸和乳酸含量。
1.6 总RNA提取和RT-qPCR
细胞种于12孔板,分别给予不同药物处理24h后,收集细胞提取总RNA。将1g总RNA,65℃变性5min,反转录得到cDNA,进行实时荧光定量PCR,检测糖酵解相关基因醛缩酶(ENO1),磷酸果糖激酶(PFKL),磷酸甘油酯激酶(PGK1)和丙酮酸激酶(PKM2)的mRNA表达。采用NCBI在线引物设计软件设计引物,序列如下:PPAR-γ正义引物5'-CAG CCA CCC ACT GTT CAT CAT-3',反义引物5'-CGG AAT GCA CCA TGC ACT T-3';PPAR-α 正义引物 5'-ATG GGT ATT GGT CCT GTC CCT-3',反义引物5'-TCC TGC TTT CTT CAG TGC CC-3';ENO1正义引物 5'-GCT CTA GCT TTG CAG TCG TG-3',反义引物5'-TGA GGC GAG AAA AAC AAT GA-3';PFKL 正义引物 5'-GTCCGCAGCACTCAGACTACG-3',反义引物5'-GTT GTT GCT GAT GGT GGC TG-3';PGK1正义引物 5'-AGC CCA CAG CTC CAT GGT AG-3',反义引物5'-TCA AAA ACC CAC CAG CCT TCT';PKM2 正义 引物 5'-GCCATGGCTGACACATTCCT-3',反义引物5'-TGAATCAATGTCCAGGCGG-3'。Real-Time PCR条件:95℃ 1min,95℃ 15s,60℃ 15s,72℃ 45s,40 个 循环,以GAPDH作为内参照。
1.7 数据处理
所有数据采用SPSS11.5软件统计,组间比较采用单因素方差分析。
2 结果
2.1 吡格列酮和WY14643对PPAR-γ或PPAR-α表达的影响
吡咯列酮组PPAR-γmRNA表达与对照组相比增加7%,无统计学差异。WY14643组PPAR-α表达轻度减低(11%),无统计学差异。
2.2 吡格列酮和WY14643均增加葡萄糖消耗
各实验组经细胞活力测定校正后,吡格列酮组HepG2细胞葡萄糖消耗量增加了150%(P<0.01),WY14643 组增加了 20%(P<0.05)。
图1示,IR模型组HepG2细胞葡萄糖消耗量较正常组明显减少,约为正常组的40%(P<0.01),吡咯列酮明显增加葡萄糖的消耗,较模型组增加 1.4 倍(P<0.01),WY14643 组葡萄糖消耗量较模型组增加 45%(P<0.05)。
2.3 PPAR-γ对HepG2糖酵解基因表达的调控
HepG2细胞糖代谢以糖酵解途径为主,因此我们检测了4个糖酵解相关基因。图2示,吡格列酮显著上调PFKL、PGK1和PKM2的表达,分别比对照组增加7.7倍、4.5倍和4.2倍(P<0.05);WY14643处理组,ENO1和PKM2基因表达轻度上调,但没有统计学差异。
2.4 吡格列酮、WY14643对糖酵解的影响
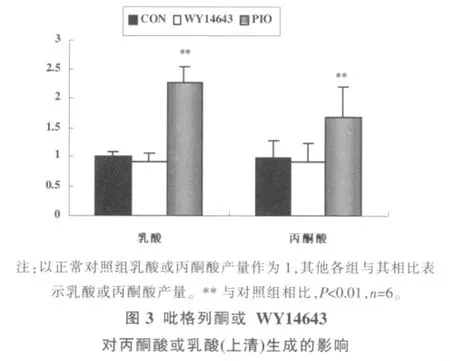
图3示,吡格列酮处理后,相比空白组,培养液上清中丙酮酸水平和乳酸水平分别升高了69%和120%,细胞内丙酮酸水平和乳酸水平分别提高了72%和89%,细胞内和细胞外糖酵解产物水平变化一致。WY14643对细胞内及细胞外丙酮酸和乳酸水平均无显著影响。

3 讨论
PPAR-α和PPAR-γ拥有许多共同的靶点,也有各自独立调控的基因群。动物实验中,噻唑烷二酮增强多个靶器官的胰岛素敏感性,上调肝脏胰岛素信号转导通路的基因表达,减轻胰岛素抵抗,并减少肝糖输出。体外研究发现,HepG2表达PPAR-γ,PPAR-γ 激动剂多对 PPAR-γmRNA 的转录水平没有显著影响,与本研究的结果一致;其主要效应表现为强烈诱导PPAR-γ活化[6,7]。
本研究观察了 PPAR-α和 PPAR-γ在HepG2细胞糖代谢中扮演的角色。PPAR-α激动剂和PPAR-γ激动剂都增加HepG2细胞葡萄糖的消耗量,并且不同程度地改善游离脂肪酸诱导的胰岛素抵抗;吡格列酮部分通过上调糖酵解相关基因增加葡萄糖消耗,而WY14643并调节HepG2糖酵解。
PPAR-γ激动剂增加糖酵解产物丙酮酸和乳酸生成。糖酵解是HepG2细胞糖代谢的起点,因此直接影响其他代谢途径的调控[8]。丙酮酸和乳酸水平升高有可能有3种机制:葡萄糖摄入增加,糖酵解增强以及糖酵解利用减少。本研究中吡格列酮促进HepG2葡萄糖的消耗,Kim等[9]人报道TZDs上调原代培养的肝细胞GLUT2基因表达,增加葡萄糖的摄取。本研究检测了糖酵解相关基因的表达,发现PPAR-γ激动剂至少上调3种参与糖酵解的基因表达,表明PPAR-γ激动剂也促进HepG2细胞糖酵解。
PPAR-α主要和脂质代谢有关,动物实验发现PPAR-α激动剂能够改善胰岛素抵抗,降低血糖[10,11],但在临床研究中没有得到同样的结果[12]。本研究表明,激动剂轻度增加HepG2细胞葡萄糖消耗,并改善胰岛素抵抗,但对糖酵解基因的诱导和糖酵解途径的激活没有作用。PPAR-α激活可能调节葡萄糖摄取或其他代谢途径,有文献报道PPAR-α激动剂GW7467促进大鼠心肌细胞葡萄糖的摄取[13]。
PPAR-γ和PPAR-α在肝细胞及心肌细胞的作用与在脂肪细胞的作用完全不同。罗格列酮对分化成熟的人脂肪细胞GLUT4表达无明显作用,对其糖摄取和糖酵解的影响也无统计学差异[4]。而PPAR-α抑制分化成熟的脂肪细胞糖酵解,减少丙酮酸和乳酸生成,抑制糖酵解相关基因的表达;抑制葡萄糖的摄取[4]。这与在HepG2细胞中得到的结果完全不同。
综上所述,本研究发现在HepG2细胞PPAR-γ和PPAR-α受体都有促进糖代谢的作用,并且可不同程度地改善棕榈酸诱导的胰岛素抵抗,其作用机制可能与增强葡萄糖摄取或糖酵解有关。关于PPAR-γ和PPAR-α在正常肝细胞糖代谢中的作用有待进一步探讨。
[1]Imai T,Takakuwa R,Marchand S,et al.Peroxisome proliferator-activated receptor gamma is required in mature white and brown adipocytes for their survival in the mouse[J].Proc Natl Acad Sci USA,2004,101(13):4543-4547.
[2]Lazar MA.PPAR gamma 10 years later[J].Biochimie,2005,87(1):9-13.
[3]Mandard S,Muller M,Kersten S.Peroxisome proliferator-activated receptor alpha target genes[J].Cell Mol Life Sci,2004,61(4):393-416.
[4]Ribet C,Montastier E,Valle C,et al.Peroxisome proliferatoractivated receptor-alpha controloflipid and glucose metabolism in human white adipocytes[J].Endocrinology,2010,151(1):123-133.
[5]Ruddock MW,Stein A,LandakerE,etal.Saturated fatty acids inhibit hepatic insulin action by modulating insulin receptor expression and post-receptor signalling[J].J Biochem,2008, 144(5):599-607.
[6]Klopotek A,Hirche F,Eder K.PPAR gamma ligand troglitazone lowers cholesterol synthesis in HepG2 and Caco-2 cells via a reduced concentration of nuclear SREBP-2[J].Exp Biol Med (Maywood),2006,231(8):1365-1372.
[7]Davies GF,McFie PJ,Khandelwal RL,et al.Unique ability of troglitazone to up-regulate peroxisome proliferator-activated receptor-gamma expression in hepatocytes[J].J Pharmacol Exp Ther,2002,300(1):72-77.
[8]Iyer VV,Yang H,Ierapetritou MG,et al.Effects of glucose and insulin on HepG2-C3A cell metabolism[J].Biotechnol Bioeng, 2010,107(2):347-356.
[9]Kim HI,Ahn YH.Role of peroxisome proliferator-activated receptor-gamma in the glucose-sensing apparatus of liver and beta-cells[J].Diabetes,2004,53(Suppl)1:S60-65.
[10]Kim H,Haluzik M,Asghar Z,et al.Peroxisome proliferatoractivated receptor-alpha agonist treatment in a transgenic model of type 2 diabetes reverses the lipotoxic state and improves glucose homeostasis [J].Diabetes,2003,52 (7):1770-1778.
[11]SchaferSA,Hansen BC,VolklA,etal.Biochemicaland morphological effects of K-111 a peroxisome proliferatoractivated receptor (PPAR)alpha activator in non-human primates[J].Biochem Pharmacol,2004,68(2):239-251.
[12]Steiner G.Altering triglyceride concentrations changes insulin -glucose relationships in hypertriglyceridemic patients. Double-blind study with gemfibrozil with implications for atherosclerosis[J].Diabetes Care,1991,14(11):1077-1081.
[13]Xiao X,Su G,Brown SN,etal.Peroxisome proliferatoractivated receptors gamma and alphaagonistsstimulate cardiac glucose uptake via activation of AMP-activated protein kinase[J].J Nutr Biochem,2010,21(7):621-626
