肝硬化患者血清内毒素与心脏超声改变的关系研究
2011-07-13向恢利毕向军
向恢利,毕向军
(阳新县人民医院,湖北 阳新 435200)
肝硬化性心肌病(cirrhotic cardiomyopathy,CCM)是指肝硬化患者心脏结构和功能的改变,是肝硬化的一种常见并发症[1]。内毒素血症是肝硬化的一种常见征象,内毒素可以通过直接和间接的方式影响心血管系统。本研究通过检测肝硬化患者血清内毒素、肿瘤坏死因子α(TNF-α)水平和心脏超声指标,分析内毒素对肝硬化患者心脏结构和功能的影响。
1 资料与方法
1.1 一般资料
经临床明确诊断的肝硬化而无明显感染征象的住院患者70例,诊断按2000年西安全国病毒性肝炎会议制定的标准。其中男61例,女9例,年龄43.5±6.8岁,均无原发性心脏病史,检查前两周未使用影响心脏功能的药物。对照组50例均为我院体检中心体检健康者,其中男43例,女7例,年龄44.2±6.6岁,均无肝脏病史或原发性心脏病史,检查前两周未使用影响心脏功能的药物。
1.2 方法
血清LPS水平检测采用生化法,试剂盒由上海医学化验所提供。TNF-α用放射免疫法检测,参照试剂盒说明书进行(试剂盒由晶美公司提供)。应用HP5500型彩色多普勒超声诊断仪测定左、右心房的内径、左室射血分数,计算左室输出量。
1.3 统计学处理
2 结果
2.1 肝硬化和对照组血清内毒素水平和心脏超声指标测定结果比较
肝硬化患者左、右心房内径均明显大于对照组(P<0.01),心输出量、内毒素水平也明显增高(P<0.01),见表1。肝硬化和对照组患者血清TNF-α 分别为 32.25 ±14.36ng/L 和 21.38 ±12.74ng/L,两组比较有显著性差异(P<0.01)。
表1 正常人和肝硬化患者血清和心脏超声指标测定结果比较()
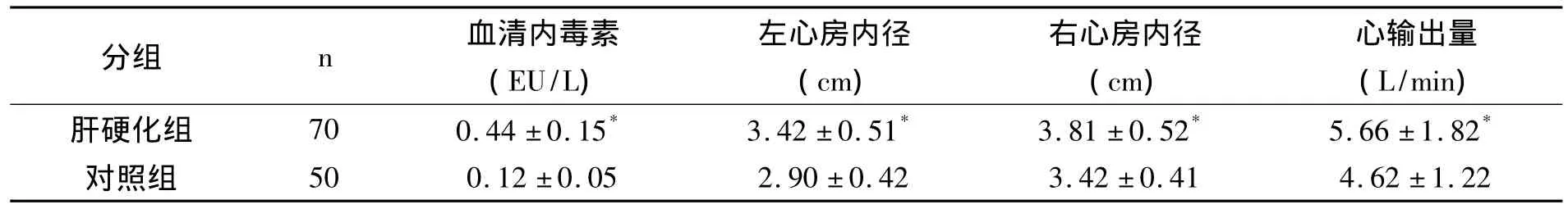
表1 正常人和肝硬化患者血清和心脏超声指标测定结果比较()
与对照组比较,*P<0.01
分组 n 血清内毒素(EU/L)左心房内径(cm)右心房内径(cm)心输出量(L/min)肝硬化组 70 0.44 ±0.15* 3.42 ±0.51* 3.81 ±0.52* 5.66 ±1.82*50 0.12 ±0.05 2.90 ±0.42 3.42 ±0.41 4.62 ±1.22对照组
2.2 肝硬化患者血清内毒素水平与心脏超声指标测定结果
Spearman等级相关分析提示:肝硬化患者血清内毒素水平与左、右心房内径、心输出量明显存在相关性,P 均<0.01,r值分别为 0.582、0.497、0.634。
3 讨论
CCM继发于肝硬化基础上,患者基础心脏排血量增加而心肌应急反应低下,心脏舒缩功能异常但静息时无明显左心衰,心脏电生理可以出现Q-T间期延长等病理反应[1]。
目前对CCM的发病机制研究主要集中于以下几个方面:心肌β肾上腺素受体密度和敏感性下降[2];心肌细胞膜流动性下降[3];NO 等血管活性物质合成异常[4]。血清内毒素增高而形成的内毒素血症对CCM形成的影响研究报道较少。内毒素血症是肝硬化患者常见的一种现象,由于门静脉高压、肠道淤血、肠道细菌过度生长,内毒素进入血液增多,而肝脏解毒功能减退所致。对感染性休克和多脏器功能衰竭研究发现内毒素血症可以对心血管系统产生直接和间接的影响。本研究提示:在肝硬化患者中,血清内毒素水平明显高于对照组,肝硬化患者内毒素水平与两侧心房内径、心输出量均有明显相关性;说明内毒素血症在CCM的发生发展过程中起一定的作用。
内毒素是革兰阴性菌细胞壁中的脂多糖成分(LPS)。LPS与内毒素受体CD14相互作用可激活前炎症细胞因子系统而介导细胞毒反应,进而导致细胞凋亡和坏死,最终导致脓毒性休克甚至多器官功能障碍综合征。LPS通过干扰心肌细胞和血管内皮细胞的能量代谢等方式[5],可以导致细胞凋亡。在心肌肥大以及心力衰竭的实验研究中发现,内毒素可使心肌细胞的α-肌动蛋白明显减少,从而减低心肌收缩力,同时可激活前炎症因子,介导细胞毒反应,引起心肌细胞的凋亡和坏死,可能与激活前炎症因子TNF-α等有关[6]。
TNF-α是一种具有多种生物学活性的细胞因子,主要来源于单核细胞和巨噬细胞,淋巴细胞、中性粒细胞、肥大细胞及内皮细胞在一定条件下也能产生TNF-α,正常水平的TNF-α可以参与抵抗细菌、病毒和寄生虫的感染,促进组织修复,引起肿瘤细胞凋亡等。但TNF-α在体内的大量产生和释放则会破坏机体的免疫平衡,与其他炎症因子一起产生多种病理损伤。
本研究显示肝硬化患者血清TNF-α明显高于对照组,提示TNF-α可能参与内毒素对心肌损伤的病理过程。TNF-α被认为是在内毒素休克病程中最早释放且起关键作用的介质,是LPS进入体内首先动员的炎症因子,是激起机体级联反应过程中的关键因子[7],其作用主要为诱导NO的合成、诱导内皮素的合成与释放、介导血小板活化因子、前列腺素等脂类介质及白介素1、白介素6、干扰素γ等多肽介质的产生,诱导氧自由基的产生及脂质过氧化作用。内毒素可使血循环及心肌内TNF-α过度分泌,TNF-α可以诱导NO合成酶的生成,合成过量的NO,使心肌cAMP/cGMP比例失衡,蛋白质合成的信号传导障碍,心肌细胞线粒体空泡变性,能量代谢出现障碍,心肌细胞兴奋—收缩偶联受到抑制,从而增加心肌细胞的凋亡和坏死,同时TNF-α有直接的细胞毒作用。临床观察发现TNF-α与多种心脏疾病有关,不稳定型心绞痛患者血清TNF-α水平明显升高,12周后发生心肌梗死的患者血清TNF-α水平明显高于无心肌梗死者,血清TNF-α可作为冠心病预后的参考指标。急性心肌梗死后血浆TNF-α及C-反应蛋白水平持续升高,TNF-α与充血性心力衰竭发生发展密切相关,其水平可能反映病变程度。
综上所述,内毒素可能在肝硬化性心肌病中起一定作用,TNF-α可能参与此过程。提示在临床工作中,处理肝硬化性心肌病可以考虑进行抗内毒素治疗以改善心肌状况。
[1]Baik SK,Foard TR,Lee SS.Cirrhotic cardiomyopathy[J].Orphanet J Rare Dis,2007,3(2):1172
[2]Ma Z,Meddings JB,Lee SS.Role of altered β-adrenergic receptor function in cirrhotic rats[J].Am J Physiol,1994,267(7):G87
[3]Ruiz del arbol L,Monescillo A,Jimenez W,et al.Paracentesis induced circulatory dysfunction:mechanism and effect on hepatic hemodynamics in cirrhosis[J].Gastroenterology,1997,113(5):579
[4]Azoulay D,Castaing D,Dennison A,et al.Transjugular intrahepatic portsystemic shunt worsens the hyperdynamic circulatory state of the cirrhotic patient:preliminary report of prospective study[J].Hepatology,1994,19(2):129
[5]Lopaschuk GD,Belke DD,Gamble J,et al.Regulation of fatty acid oxidation in the mammalian heart in health and diseasel[J].Biochim Biophys Acta,1994,1213:2632
[6]王虹,潘静坤,陈睿,等.地塞米松对内毒素血症幼年大鼠心肌肌动蛋白及其mRNA表达的影响[J].中国医科大学学报,2006,35(3):237
[7]Murphy K,Haudek SB,Thompson M,et al.Molecular biology of septic shock[J].New Horizons,1998,6(2):181
