自身免疫性胰腺炎的MRI表现研究
2011-06-19倪瑞军许顺良阮翎翔王伯胤
倪瑞军 ,许顺良,阮翎翔,王伯胤
(1.浙江大学医学院附属第一医院,浙江 杭州 310003;2.绍兴市人民医院,浙江 绍兴 312000)
自身免疫性胰腺炎(AIP)是一种临床少见的、与自身免疫有关的炎症病变,是慢性胰腺炎的一种亚型[1],其形态、预后都与普通慢性胰腺炎明显不同,口服甾体类激素抗免疫治疗可取得良好疗效[1-2]。有关AIP的MRI征象报道甚少,本文主要分析8例AIP病变胰腺的MRI表现,并结合文献进行归纳、总结。
1 材料和方法
1.1 AIP组和对照组
AIP组:浙江大学医学院附属第一医院2008年1月~2010年11月确诊的有完整MR资料的AIP,共8例。所有病例均有胰腺肿大,且经口服甾体类激素抗免疫抑制治疗后经CT或MR复查胰腺明显缩小,其中3例有穿刺活检病理资料。8例AIP中男6例,女 2 例,年龄 49~80 岁,平均(60.8±10.6)岁。
对照组:25例,男 21例,女 4例,年龄 53~70岁,平均(62.1±5.1)岁。胰腺的MR征象无明显异常、无胰腺疾病的相关临床症状。
1.2 AIP组和对照组MRI动态增强扫描
MR检查仪为GE公司Signa Excite 1.5T超导型医用磁共振仪。常规轴位扫描,视野360mm×280mm,层厚6mm,层间距为0/2mm,采集矩阵224×168,重建矩阵512×512;分析的MR影像序列如下:①快速恢复快速自旋回波序列FRFSE[TR/TE(6666.67/92.92ms)]采集的T2WI(包括抑脂与不抑脂);②抑脂或不抑脂的快速扰相梯度回波序列FSPGR 采集的 T1WI[TR/TE(145/1.44ms)]以及 T1W同、反相位图像;③施加脂肪抑制技术的三维快速扰相梯度回波序列 3D/FSPGR[TR/TE(4.97/1.81ms)]进行动态增强扫描采集的各期图像,对比剂为欧乃影,用量为0.2ml/kg体重,经肘前静脉用压力注射器注入,注射速度2.0~2.5ml/s。动态增强扫描注射对比剂前均有同序列的平扫T1W图像,注射对比剂后分别于动脉期(20s)、门脉期(55s)、延迟期(110s)时采集3个时期的影像。
1.3 图像分析和数据采集
图像分析:所有病例均在美国Radinfo公司研发的 PACS系统上进行分析。分析内容为:①AIP病变胰腺的T2WI、T1WI、同反相位影像信号特点;②观察动态增强扫描时病变胰腺内微结构的变化情况;③定量分析动态增强扫描各期 (包括注射对比剂前的平扫,共4期)病变胰腺的信号特点及其变化趋势,并与对照组比较。
数据采集:测量AIP组与对照组动态增强扫描各期(包括平扫,下同)的信号强度,每例的各期至少测量受累胰腺的3~5个感兴趣区(ROI)的信号强度值;ROI面积尽可能大,至少包含病变胰腺2/3横径,避免ROI包含血管及胰外组织,多个ROI平均值作为该期的信号强度值。同一病例不同时相的ROI的部位、大小相同。用同样方法测量对照组胰腺增强扫描各期信号强度。
1.4 数据分析
AIP组与对照组各期的信号强度值以平均值±标准差(mean±SD)表示;用Excel表格绘制两组在动态增强扫描时平均信号强度值的折线图,比较AIP组与对照组平均信号强度值的变化趋势。
2 结果
8例AIP病例总体情况见表1。
2.1 胰腺受累部位、病变胰腺形态及胰外情况
病变仅累及胰尾部1例(图1);病变累及胰尾、胰体2例;整个胰脏全部受累5例(图2,3)。病变段胰腺的外形均为沿胰腺长轴方向的弥漫性肿胀、增粗,增粗程度不一,边缘羽毛样结构消失。3例节段性AIP的病变胰腺与正常胰腺间分界欠清,呈移行改变(图1a);5例全胰弥漫性AIP,胰周围有明显假包膜包绕(图2b),病变胰腺轮廓较光整,1例隐约可见假包膜。6例有假包膜的AIP,其中3例假包膜厚度均匀(图 2b),3 例不均匀(图 1c,4a)。 8 例 AIP 的病变胰腺内均未见主胰管显示。
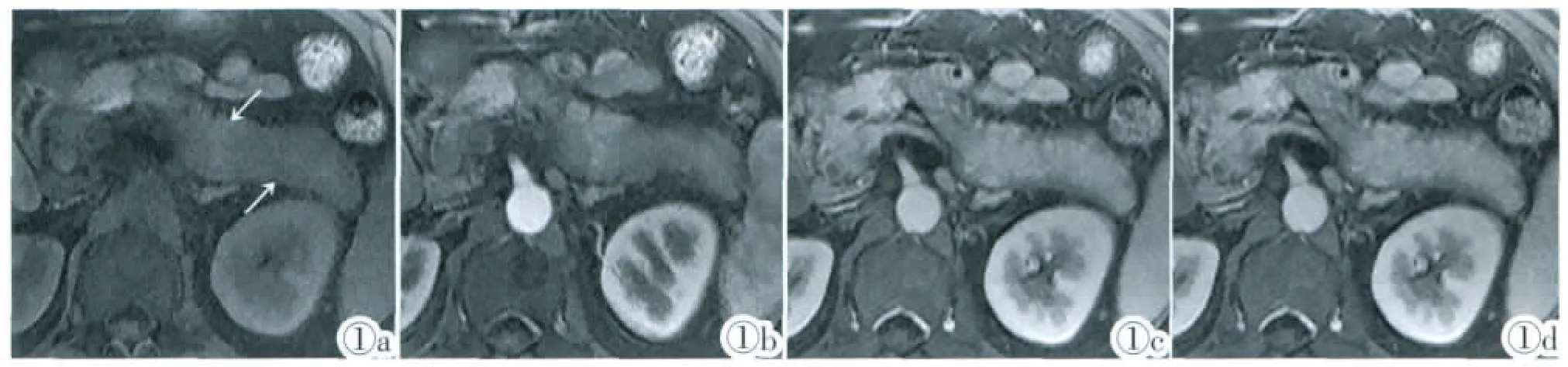
图1 胰尾部节段性AIP,胰尾部沿胰腺长轴方向的弥漫性肿胀,图1a~1d依次为T1W动态增强扫描平扫、动脉期、门脉期、延迟期。图1a示平扫时病变胰腺信号低于未受累胰腺组织,与正常胰腺组织分界欠清,呈移行改变。图1b示动脉期病变胰腺与正常胰腺信号强度均增加,但病变胰腺信号强度低于正常胰腺。图1c示门脉期病变胰腺信号进一步增高,而正常胰腺较动脉期略降低,病变胰腺与正常胰腺信号接近,仔细观察病变胰腺内部结构,可见有规律排列的索状影;胰尾部腹侧和背侧假包膜开始强化而显影。图1d示延迟期病变胰腺信号强度略高于门脉期,略高于正常胰腺,与强化的假包膜有融合之势,从而假包膜显示不如图1c,胰腺内索状影也变得模糊不清。Figure 1.Plain scanning,arterial phase,portal venous phase and delayed phase MR images in turn of one patient with segmental AIP involving pancreas tail.MR images show that the enlarged pancreas is along the long axis of pancreas.Figure 1a:The signal of involved pancreas is lower than normal part on plain scanning,and the interface is not clear.Figure 1b:The signal of both normal and abnormal tissue increased in arterial phase,however the extent of increased signal intensity of abnormal tissue is lower than that of normal tissue.Figure 1c:The signal of abnormal pancreas remains increasing in portal venous phase,whereas the signal of normal tissue is slightly lower than in arterial phase,no obvious difference in signal between the normal and abnormal tissue.Some regularly arrayed funicular structure can be seen in the abnormal pancreatic tissue.The rim-like capsule around the pancreatic tail enhanced.Figure 1d:The signal of abnormal pancreatic tissue is slightly higher than normal and than in portal venous phase;the abnormal pancreatic tissue and the enhanced rim-like capsule seems to be being integrated,the regularly arrayed funicular structure becomes vague.
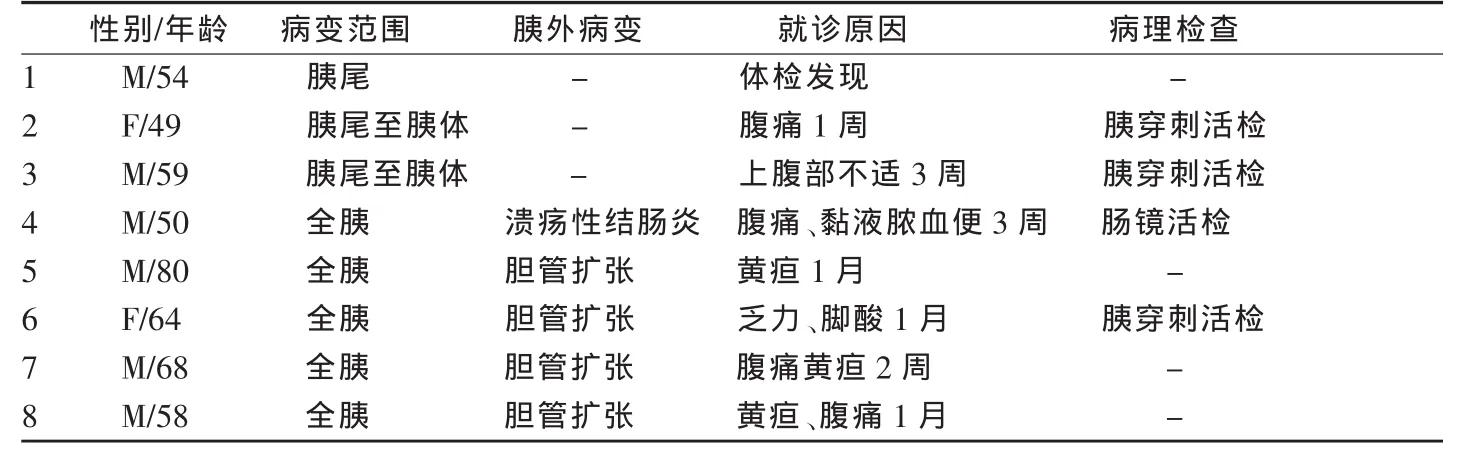
表1 8例AIP情况一览表
胰外器官受累及胰周情况:4例AIP患者合并胆管扩张(图2),其中1例仅为胆总管扩张,另3例为肝内外胆管扩张。3例伴有脾肿大(图3)。1例伴有溃疡性结肠炎。1例AIP胰尾部周围见少量渗出,左侧肾前筋膜略增厚(图3)。腹膜后均未见肿大淋巴结或淋巴结样肿块。
2.2 AIP患者病变胰腺的MR信号特点
在所有序列上,8例AIP病变胰腺均未见坏死、囊变、出血等信号。在脂肪抑制T1WI上,3例节段性AIP的病变胰腺与未受累胰腺比较,呈均匀低信号,与未受累胰腺分界欠清(图1a);5例弥漫性AIP中,有1例整体均匀低信号,仅在胰体、尾部见由细小索条影排列成的斑片状偏高密度影(图3);另4例为中等信号,信号不均匀,其内见索状和/或细小结节状相对略高信号影(图4a)。在未抑脂T1W图像上,8例AIP病变胰腺都为不同程度的低信号,信号强度较均匀(图2c)。在抑脂和非抑脂T2WI上,8例AIP病变胰腺都表现为较均匀的低信号,信号强度略有不同,与正常胰腺的T2W信号接近。在T1W图像的同、反相位影像上,胰腺信号强度无明显变化 (图2c,2d)。
假包膜:8例AIP中,5例有明确假包膜,在抑脂T1WI上假包膜较胰腺组织信号为高 (图2b),在非抑脂T1WI上,难以辨别假包膜与病变胰腺组织的信号强度差异(图2)。在T2WI上假包膜表现为低信号(图 2a)。
2.3 增强扫描AIP病变胰腺内部信号特点
8例AIP中有6例在动脉期或门脉期能分辨病变胰腺内有规律排列的索条状、细小结节状先期强化影,随时间的推移,索条影之间的间隔信号强度增加,索条状先期强化影变得模糊而不能分辨 (从图1c至1d和从图4a至4d)。不同病例之间索条状、细小结节状先期强化影粗细不同,滞后强化的间隙宽度不同,图1c与图4b比较。

图2 全胰弥漫性AIP,整个胰腺沿胰腺长轴方向弥漫性肿胀,合并肝内外胆管扩张。图2a为未抑脂的T2W图像,胰腺呈均匀低信号,未见局灶性更低信号或高信号,边缘包膜呈线样低信号,较光整。图2b为抑脂T1W图像,胰腺组织呈均匀低信号,边缘见信号稍高的厚度均匀的假包膜,胰周脂肪间隙清晰。图2c,2d分别为同相位T1W图像和反相位T1W图像,在两个相位的T1W图像上,胰腺信号强度未见明显变化。图3 另一病例的抑脂T1W图像,弥漫性AIP病例,合并肝内外胆管扩张、脾肿大,图示胰腺弥漫肿胀增粗,胰腺体、尾部信号不均匀,其内见索状影排列成的斑片状偏高信号区,胰尾周围有少量渗出,脂肪间隙信号增高。Figure 2. A patient with diffuse AIP,accompanying dilate extra-and intrahepatic bile duct,MR images show that the global pancreas is widened along the long axis of pancreas.Figure 2a:T2W image shows the homogeneous hypointensity signal of abnormal pancreas with smooth periphery,the signal seen in abnormal pancreatic parenchyma is homogeneous.Figure 2b:Fat-suppressed T1W image shows that the abnormal pancreas manifests homogeneous hypointensity signal with regular pseudocapsule being slightly hyperintense.Figure 2c,2d:In-and out-phase T1W images show no significant difference in signal intensity of abnormal pancreatic parenchyma. Figure 3. Another patient with diffuse AIP,accompanying dilated extra-and intrahepatic bile duct and swollen spleen,fat-suppressed T1W image shows heterogeneous signal of abnormal pancreas,the slightly patchy signal seen in pancreatic tail;there is some exudation around the tail of pancreas.

图4 平扫抑脂T1WI(不是动态增强的首期平扫)、增强扫描动脉期、门脉期和延迟期,弥漫性AIP,合并肝内外胆管扩张。图4a:病变胰腺信号降低,但信号不均匀。图4b:动脉期胰腺内见先期强化的有规律排列索状高信号影。图4c:索状信号影变模糊、隐约可见。图4d:图4b、4c所见索状或微小结节状结构已不能分辨。图4b~4d所示的病变胰腺内信号强度依次增高;病变胰腺周围假包膜渐进强化。 图5 为对照组同一对象,示正常胰腺,在抑脂T1WI上胰腺为高信号(图5a),图5b示胰腺在抑脂T2WI上呈低信号。Figure 4.A patient with diffuse AIP accompanying the dilated extra-and intrahepatic bile-duct,fat-suppressed T1WI(not the image in 1st phase of dynamic contrast-enhanced),arterial phase,venous phase and delayed phase MR images in turn.Figure 4a:The signal of abnormal pancreatic tissue decreases disproportionally in comparison with the normal tissue in Figure 5a.Figure 4b:Some regularly arrayed funicular or/and micro nodular structure enhanced ahead of that in the abnormal pancreas.Figure 4c:The regularly arrayed funicular or/and micro nodular structure becomes vague.Figure 4d:The aforementioned micro-structure cannot be differentiated.The signal intensity of abnormal pancreas and pseudocapsule surrounding the abnormal pancreas is increasing from Figure 4b to 4d. Figure 5.One patient of the control group.MR images show the hyperintense signal of normal pancreas on T1WI(Figure 5a)and hypointense signal on T2WI(Figure 5b).
2.4 AIP组与对照组动态增强扫描强化特点比较
影像特点:从平扫至延迟期,8例AIP的病变胰腺的信号强度均依次增高,呈渐进强化,图1a至1d、4b至4d所示;在动脉期,3例节段性AIP的病变胰腺信号均低于未受累胰腺,至门脉期时与未受累胰腺接近,至延迟期略高于未受累胰腺(图1b至1d的受累胰腺与未受累胰腺比较)。
定量分析:AIP组和对照组胰腺各期总体平均信号强度值测量结果见表2,平均信号强度的变化趋势见图6。从平扫至延迟期,AIP组的平均信号强度值依次增高,而对照组则在动脉期达到最大值,后两期逐渐下降;在平扫、动脉期,AIP组信号强度低于对照组,至门脉期和延迟期,AIP组信号强度高于对照组。从表2可知,AIP组与对照组在各期的信号强度值变化范围均较大,两组的信号强度值有很大程度的重叠。
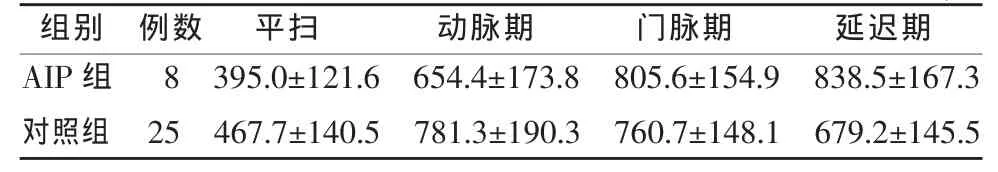
表2 增强扫描AIP组与对照组胰腺信号强度(mean±SD)
3 讨论
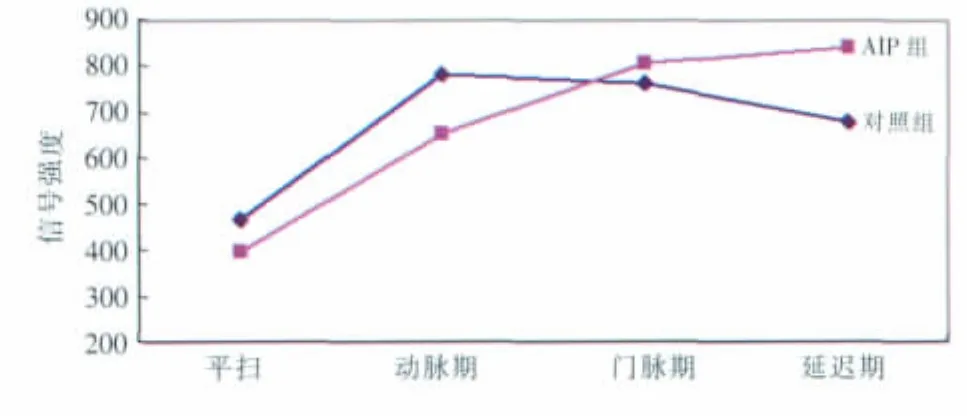
图6 MR动态增强AIP组与对照组强化趋势比较。
AIP在外形上类似于胰腺癌,尤其是节段性病变,在影像学上易误诊,本组病例中有2例首次CT检查时被误诊为胰腺癌,后经对病变胰腺进行多针多处穿刺后均未见恶性肿瘤细胞,后经抗免疫治疗后胰腺形态恢复正常。
3.1 AIP的临床表现
文献报道AIP好发于老年男性,最常见的临床症状为间隙性或进展性黄疸,体重下降[2],本组病例与文献报道基本符合,年龄、性别组成基本一致,临床症状以腹痛为主,7例有腹痛,仅4例伴有黄疸,1例体重明显下降;而1例有慢性腹泻、粘液脓血便症状,是因为伴有溃疡性结肠炎。
3.2 AIP的组织病理改变
AIP的病变胰腺外观为弥漫性肿大、增粗,质地坚硬,组织病理学上的显著特征是导管周围肌纤维细胞大量增生,小叶间隔增厚,胰导管狭窄[4],增生的纤维组织内淋巴细胞和浆细胞浸润,多数是CD4+和CD8+T淋巴细胞,以及少量的B淋巴细胞,少有中性粒细胞,因而属于慢性增生性炎症。本组3例进行胰腺穿刺活检的病例,综合其组织病理检查结果如下:①胰腺小叶结构存在,腺泡上皮分化正常,不同程度萎缩;②腺泡周围间质大量纤维组织增生;③增生的纤维组织内大量淋巴细胞浸润,少有中性粒细胞,与文献研究结果相同。AIP患者常合并胆管、肾、肺、唾液腺受侵,IgG4+浆细胞在胰腺及受累组织均可发现,胃、十二指肠及结肠通过内镜组织学检查也证实有局部浸润[5-6]。
3.3 AIP胰腺受累部位、病变胰腺的外形
AIP可以是节段性和弥漫性的。本组病例全胰弥漫性肿大占多数(5/8),节段性AIP的病变均位于胰尾部和胰体、尾部。多数文献报道的AIP以弥漫性肿大为主,如Sheng等[7-9]的报道。而Song等[9]报道了一组25例AIP中,有18例为胰头部肿块,叶枫[10]
报道的6例AIP中有1例首诊时AIP病变位于胰头部,2月后病变发展为全胰弥漫性病变。表明节段性AIP也不在少数,弥漫性AIP在初始阶段可能是节段性病变。文献报道的AIP以弥漫性为主,有可能是因为对AIP的认识不足,节段性AIP误诊为其它病变而未受到关注。节段性和弥漫性AIP的病变胰腺外形都有共同特点,即病变胰腺的长轴均与主胰管一致,多呈腊肠状改变,本组病例的外形均表现为此外形特征,很多文献已描述了此特点[7-12],从附有影像资料的文献可知,局灶性病变也可呈梭形或椭球形[10]。
3.4 AIP病变胰腺的MR信号特点
对正常胰腺的组织特点及MR信号模式的理解有助于理解AIP病变胰腺的MR信号模式。正常胰腺的腺泡、导管中含有大量的消化酶,胰液中的水分子多处于结合水状态,T1、T2弛豫时间缩短,在抑脂
T1WI上呈高信号(图5a),在T2WI上呈低信号(图5b),由于不同个体的胰腺功能差异大,胰液含量不一,所以正常胰腺T1W高信号强度变化范围也很大。正常胰腺的腺泡、导管排列紧密,在MRI影像上不能区分单个腺泡(和/或腺泡团)、小导管结构(重度萎缩、脂肪浸润除外),如图5a。
3.4.1 AIP病变胰腺的MR平扫信号与病理学特点的关系
AIP的病理组织学特点提示,病变胰腺的腺泡、导管受压萎缩,胰腺内、外分泌功能不同程度受损,腺泡和导管内胰液明显减少[13],因而在未抑脂的T2W、T1W图像上,AIP病变胰腺均表现为低信号,是纤维组织增生和胰液分泌减少的结果。在抑脂T1W图像上,与正常胰腺组织比较,虽然均表现为下降,但不同的病例下降的程度不同,同一病例不同区域下降程度也可能不同;这也是因为病变胰腺纤维组织增生的程度不同、腺泡的分泌功能受损情况不一以及腺泡和胰导管的萎缩程度不同,导致胰腺信号下降程度各异,在抑脂T1W图像上的索状、细小结节状影则有可能代表了未完全萎缩的腺泡和导管,而显著均匀低信号则提示此区胰腺腺泡、导管极度萎缩或消失,外分泌功能丧失殆尽。未见有文献对此MR影像特点进行描述、讨论。在未抑脂的T2WI、T1WI上,由于周围脂肪信号过高,胰腺内这种实质与间质的信号强度差异难以分辨,因而表现为均匀低信号。
抑脂T1WI还能清晰显示AIP病变胰腺边缘的假包膜,呈等偏高信号,多位于胰体、尾部周围,是AIP的一种重要征象,假包膜出现有利于AIP的诊断,病变不同发展时期以及不同的病例,假包膜的厚度、厚度均匀度不同,如图1c,2b,3d所示。假包膜的形态与其发生、发展过程的关系尚难定论。
T1WI的同、反相位比较,可以了解胰腺内脂肪浸润及脂肪变性情况。本组病例中病变胰腺的信号强度在同、反相位上均无明显差异,提示病变胰腺内不含脂肪组织、无脂肪变性病理改变。本组所有病例的病变胰腺内均未发现局灶性高T2W、低T1W水样信号,表明病变胰腺内无坏死、液化发生,与AIP病理特点相符合[4],掌握AIP病变胰腺的“均质、T2W低信号”特点有利于与胰腺的其它占位病变进行鉴别。
3.4.2 MR动态增强扫描对AIP诊断的意义
前已提及了抑脂T1WI能在一定程度上反映AIP病变胰腺的微结构损伤情况,MR动态增强扫描能更准确、更清晰显示AIP病变胰腺微结构的变化。本组病例中有6例AIP在动脉期或门脉期,病变胰腺内可见有规律排列的索条状、细小结节状先期强化影,笔者认为这代表了腺泡和导管结构,而索条状、细小结节状先期强化影之间的低信号间隙,则代表了导管周围增生的纤维组织。这是由于纤维组织增生位于腺泡和导管周围,胰腺间质微血管首先受到挤压而管腔变窄,而腺泡和导管内微血管数量、管腔直径的改变则相对较轻,因而对比剂可较早到达腺泡和导管,使之先期强化,周围间质则滞后强化,当间质发生强化后,与腺泡、导管信号强度的差异逐渐缩小,从而使索条状、细小结节影之间隙变得模糊而分界不清。不同病例的先期强化影的粗细、间隔的宽度不同,提示AIP处于不同发展阶段,显然,腺泡和导管越粗、间隙越窄,则病变处于较早阶段,反之亦然。MR动态增强扫描在AIP的影像诊断中的价值是显而易见的:①为AIP的首次诊断提供有力证据,减少误诊;②反映AIP病变胰腺的病变程度;③监测AIP抗免疫治疗的效果。尚未见有文献对此方面的征象进行描述、讨论。
3.5 MR动态增强扫描AIP组与对照组间的差异
3.5.1 AIP组与对照组间强化趋势的差异
无论从影像特点还是从测量的数据来看,本组病例在动态增强扫描时均表现为渐进强化,从平扫至延迟期,病变胰腺的信号强度逐渐增高。文献[8,10-11]报道结果显示:从平扫经动脉期、门脉期、延迟期,AIP病变胰腺的CT密度逐渐增高,强化趋势与本组病例相似。文献[10-11]将这种强化方式称之为延迟强化,笔者认为此概念有失准确,与肝海绵状血管瘤的延迟强化易产生混淆,从动脉期开始时AIP病变区便有对比剂进入,信号强度是逐渐增高,而肝海绵状血管瘤的病变中央区是在延迟期才有对比剂进入,其CT密度或MR信号是在延迟期从最低值突变到最高值,因而用渐进强化来描述AIP的强化特点更为合适,更能体现AIP病变胰腺的血流动力学特点。
AIP的强化模式是由其病理特点决定的,病变内纤维组织增生、微血管受压变细,血液流速减慢,对比剂通过时间延长,因而不难理解AIP病变胰腺呈渐进强化的特点。而正常对照组胰腺的强化方式为速升速降,于动脉期信号强度值最高,从动脉期经门脉期至延迟期信号强度值表现为连续下降,是其血供丰富、血流速度快、对比剂通过时间短的反映。仅从动态增强扫描影像上观察,有时难以确定AIP信号强度如何变化,因而测量其信号强度值就显得必要。
3.5.2 AIP组与对照组间信号强度值的意义
单纯测量AIP病变胰腺动态增强扫描某一期的信号强度值,并无可靠意义。从表2可以看出,病变胰腺、正常胰腺的信号强度变化范围都很大,AIP组与对照组的信号强度值有很大重叠,是由于不同个体正常胰腺的功能状态差异较大、病变胰腺的炎性增生程度及腺泡和导管的萎缩程度差异较大所致。因而难以从AIP病变胰腺的信号强度值这个角度与正常胰腺和其它病变进行鉴别,动态增强扫描时测量各期信号强度值的意义在于明确病变胰腺强化特点、信号强度变化趋势,有利于与胰腺其它占位病变进行鉴别。
3.6 合并胰外器官病变及实验室检查
AIP只是系统性自身免疫疾病中的胰腺侵犯,实验室检查IgG4明显增高,常合并其它部位或器官的炎性增生病变,胰外器官病变表现多种多样,已有大量文献进行了报道,如Dushyant[13]就对胰外病变进行了详细的描述,本文不再赘述。
3.7 鉴别诊断
全胰弥漫性AIP的形态具有特征性,无需与其它疾病鉴别。节段性AIP须与胰腺癌、淋巴瘤、胰岛细胞瘤等占位病变鉴别,综合AIP外形特征以及在MR各序列影像上的信号特点、动态增强扫描时强化模式,不难进行鉴别。
综上所述,AIP在MR影像上具有特征性改变,综合平扫各序列的影像表现,可推论病变区病理改变的基本情况,脂肪抑制T1WI、动态增强扫描能反映AIP病变胰腺的微结构变化情况,结合病变胰腺的大体形态改变,大多可作出AIP的肯定性诊断,部分不典型病例也可作出提示性诊断。
[1]Kim KP,Kim MH,Kim JC,etal.Diagnostic criteria for autoimmune chronic pancreatitis revisited [J]. World J Gastroenterol,2006,12(4):2487-2496.
[2]OkazakiK,Kawa S,Kamisawa T,etal.Clinicaldiagnostic criteria of autoimmune pancreatitis: revised proposal [J]. J Gastroenterol,2006,41(7):626-631.
[3]刘全达,周宁新,宋扬,等.自身免疫性胰腺炎23例临床分析[J].中国全科医学,2007,10(24):2084-2086.
[4]Finkelberg DL,SahaniD,DeshpandeV,eta1.Autoimmune pancreatitis[J].N Engl J Med,2006,355(25):2670-2676.
[5]Takeda S,Haratake J,Kasai T,et al.IgG4-associated idiopathic tubulointerstitial nephritis complicating autoimmune pancreatitis[J].Nephrol Dial Transplant,2004,19:474-476.
[6]Uchiyama-Tanaka Y, Mori Y, Kimura T, et al. Acute tubulointerstitialnephritis associated with autoimmune-related pancreatitis[J].Am J Kidney Dis,2004,43:e18-e25.
[7]Sheng QS,Chen DZ,Lang R,et al.Autoimmune pancreatitis:reportoftwo casesand literature review [J].Hepatobiliary Pancreat Dis Int,2009,8(6):653-656.
[8]TakahashiN,FletcherJG,Hough DM,etal.Autoimmune pancreatitis:differentiation from pancreatic carcinoma and normal pancreas on the basis of enhancement characteristics at dualphase CT[J].AJR,2009,193(8):479-484.
[9]Song Y,Liu QD,Zhou NX,et al.Diagnosis and management of autoimmune pancreatitis:Experience from China [J].World J Gastroenterol,2008,14(4):601-606.
[10]叶枫,赵心明,石素胜,等.自身免疫性胰腺炎的CT诊断[J].中国医学影像技术,2008,24(8):1223-1226.
[11]丛冠宁,秦明伟,有慧,等.自身免疫性胰腺炎的影像学表现[J].中国医学科学院学报,2008,30(4):479-484.
[12]SarnerM.Pancreatitis:definitionsand classification.In:Go VLW,ed.The exocrine pancreas:biology,pathobiology,and diseases.New York,NY:Raven,1986.459-464.
[13]Sahani DV,Kalva SP,Farrell J,et al.Autoimmune pancreatitis:imaging features[J].Radiology,2004,233(11):345-352.
