阿托伐他汀对CLP大鼠模型的保护作用
2011-06-18曲茂兴李春树吕慧怡
曲茂兴,于 健*,李春树,吕慧怡
脓毒症(Sepsis)是由感染引起的全身炎症反应,发病率有逐年上升趋势,是ICU患者死亡的主要原因之一[1]。阿托伐他汀是临床常用的调脂药,大规模临床试验证明,它可显著降低心血管疾病的致残率和死亡率[2-5],同时具有抗炎[6-11]、改善内皮细胞功能和NO活性等作用[12-14]。本实验采用盲肠结扎穿孔术(CLP)建立脓毒症大鼠模型,观察阿托伐他汀对大鼠血浆一氧化氮(NO)和肝组织匀浆丙二醛(MDA)的影响,探讨阿托伐他汀的临床应用价值。
1 材料和方法
1.1 仪器设备 DS-88型电子秤(武汉自动化仪表厂),TG16WS高速台式离心机(长沙科学仪器厂),UV-2100 Spectrophotometer紫外/可见分光光度计(日本岛津公司),XW-80A旋涡混合器(上海青浦沪西仪器厂),HH-W21-600电热恒温水浴箱(上海医用恒温设备厂)。
1.2 试剂和材料 阿托伐他汀(辉瑞制药有限公司生产,批号:081128);一氧化氮(NO),微量丙二醛(MDA)试剂盒购自南京建成生物工程研究所。
1.3 动物分组及给药 75只健康雄性SD(Sprague-Dawley)大鼠,体质量184~202 g,购于大连医科大学实验动物中心。按照随机排列表法分为3组,每组25只。对照组用食用淀粉40 mg/kg加入2mL生理盐水,制成混悬液,连续灌胃5 d,第6日行假手术。脓毒症组同样用食用淀粉灌胃,第6日行CLP,用丝线结扎盲肠总长度的30%[15],在盲肠游离端选2个相距3mm点分别刺穿盲肠,术后置笼内活动,不禁饮食。阿托伐他汀组,用阿托伐他汀40 mg/kg[16]溶于2mL生理盐水,制成混悬液,连续灌胃5 d,第6日行CLP。
1.4 标本收集及检测 分别在术后0、2、6、10、24 h时间点眼眶采血,肝素抗凝管静置30min,4℃、3000 r/min离心15min,取血浆于-20℃冰箱中保存。剪取肝脏组织在冰冷的生理盐水中漂洗,滤干,称湿重约0.1 g倒入玻璃匀浆管中,加入1mL 0.86%冷生理盐水研磨,使组织匀浆化,4℃、2000 r/min离心15min,取上清于-20℃冰箱中保存。用分光光度计检测血浆NO、肝脏组织匀浆MDA的含量。24 h时间点取心脏、肺、肝脏、空肠标本,置10%甲醛溶液中固定,依次常规脱水,石蜡包埋,制成切片,苏木精-伊红(HE)染色,光镜下检查组织病理学改变。
1.5 统计学方法 采用SPSS 11.5统计软件,计量资料以表示,正态分布变量多组间比较用方差分析,3个处理组均数的两两比较用LSD-t检验法,以P<0.05为差异具有统计学意义。
2 结果
2.1 各组血浆NO的比较 2 h时对照组与脓毒症组(P=0.029)和阿托伐他汀组(P=0.038)比较,差异有统计学意义(P<0.05)。脓毒症组在术后6 h明显升高,24 h达到峰值(329.04±21.15)μmol/L;阿托伐他汀组在术后10 h明显升高,在24 h达到峰值(209.53±10.68)μmol/L。在0 h和2 h时间点,阿托伐他汀组与脓毒症组比较,差异无统计学意义(P >0.05),在 6 h、10 h、24 h时间点,阿托伐他汀组与脓毒症组比较,差异有统计学意义(P<0.01),见图1。
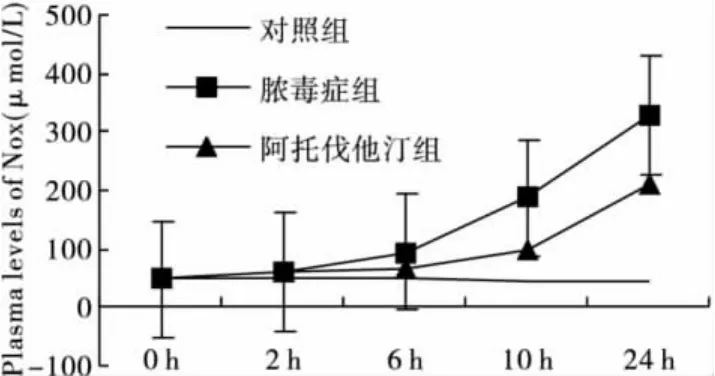
图1 各组血浆NO浓度的比较
2.2 各组肝组织匀浆MDA的比较 脓毒症组和阿托伐他汀组MDA含量在术后2 h升高,6 h、10 h无明显变化,于24 h再度回升并分别达到峰值(8.22±0.54)nmol/mgprot和(6.32±0.35)fnmol/mgprot。在 2 h、6 h、10 h、24 h,阿托伐他汀组MDA含量均低于脓毒症组,差异有统计学意义(P<0.05或P<0.01)。见图2。

图2 各组肝组织匀浆丙二醛水平的比较
2.3 光学显微镜检查 心脏:对照组无明显病理改变或间质血管充血(图3A)。脓毒症组部分心肌变性,血管充血明显(图3B)。阿托伐他汀组少量心肌变性,间质血管充血(图3C)。肺:对照组肺泡间隔无增宽,无炎性细胞浸润(图4A)。脓毒症组肺泡间隔明显增宽,淋巴细胞、浆细胞浸润,血管扩张充血,其周围炎细胞浸润明显(图4B)。阿托伐他汀组肺泡间隔略增宽,少量淋巴细胞、浆细胞浸润(图4C)。空肠:对照组肠粘膜正常(图5A)。脓毒症组肠粘膜部分上皮脱落,重度炎症(图5B)。阿托伐他汀组肠粘膜中度炎症(图5C)。肝脏:对照组无明显病理改变或肝细胞轻度水肿,汇管区少量淋巴细胞浸润(图6A)。脓毒症组肝细胞高度水肿、变性(图6B)。阿托伐他汀组肝血管略充血,肝细胞水肿较轻(图6C)。
3 讨论
本次试验采用CLP复制脓毒症大鼠模型[17-18]。CLP模型操作简单,通过外科处理使动物腹腔存在失活组织的同时,少量持续溢入混有多种细菌的肠内容物,引起腹腔感染,与临床上阑尾炎穿孔形成的憩室炎极为相似[19-20],既可以使脓毒症得到充分发展,也可以保证脓毒症大鼠模型在24 h内的存活率。进入腹腔的细菌释放,刺激单核细胞、巨噬细胞和内皮细胞等产生多种促炎细胞因子,可迅速活化不同组织器官的细胞,导致机体代谢、激素水平和神经内分泌改变,造成细胞功能异常和器官功能衰竭。内毒素也激活生理状态下没有活性的诱导型一氧化氮合酶(iNOS)并大量表达,产生过量的NO,促使大量的中性粒细胞活化,引起“呼吸爆发”,产生大量的氧自由基,促进炎性渗出和组织损伤。MDA是体内自由基代谢产生的脂质过氧化产物,可以反映脂质过氧化自由基的存在及反应的程度[21]。他汀类药物能抑制iNOS的表达,下调NO的合成,从而改善脓毒症的预后。
本次试验中,脓毒症组血浆NO浓度在术后6 h显著升高,24 h达到峰值(329.04±21.15)μmol/L。在阿托伐他汀干预后,血浆NO的浓度在术后10 h才显著升高,术后24 h达到峰值(209.53 ±10.68)μmol/L。在6 h、10 h、24 h时间点,阿托伐他汀组大鼠血浆中NO的浓度较脓毒症组明显降低(P<0.01)。阿托伐他汀可以降低脓毒症大鼠血浆中NO的浓度。在脓毒症组,术后24 h肝组织匀浆MDA含量的峰值为(8.22±0.54)nmol/mgprot,阿托伐他汀组为(6.32±0.35)nmol/mgprot,在术后 2 h、6 h、10 h、24 h,阿托伐他汀组肝组织匀浆MDA含量均低于脓毒症组(P<0.05或P<0.01),说明阿托伐他汀也可以降低脓毒症大鼠肝组织匀浆中MDA的含量。与脓毒症大鼠高浓度的NO和MDA相对应,24 h后光镜下检查发现,脓毒症组心脏﹑肺﹑肝脏﹑空肠有明显病理改变,炎细胞浸润,组织充血、坏死、渗出,表现为重度炎症,提示脓毒症时心脏﹑肺﹑肝脏﹑空肠都可能受累。阿托伐他汀干预后,心脏﹑肺﹑肝脏﹑空肠光镜下的病理改变较脓毒症组有一定程度的改善。说明阿托伐他汀可能减轻脓毒症大鼠模型的炎症反应,因此,推测在脓毒症患者中应用他汀类药物可能具有一定的临床意义。

图3 光学显微镜下大鼠心脏24 h病理改变(HE×400)

图4 光学显微镜下大鼠肺脏24 h病理改变(HE×200)

图5 光学显微镜下大鼠空肠24 h病理改变(HE×200)

图6 光学显微镜下大鼠肝脏24 h病理改变(HE×200)
“拯救脓毒症战役”(SSC)会议推荐早期集束化治疗:液体复苏,血管活性药物,控制血糖,小剂量激素,机械通气以及重组人体活化蛋白 C(rhAPC)用于治疗脓毒症休克等,但目前仍没有特效治疗方法。虽然FDA批准他汀类药物仅作为调脂及抗动脉粥样硬化使用,也许它的保护作用可以给我们新的启发和思路。
[1]李轶男,周立新,誉铁鸥,等.ICU重度脓毒症患者死亡危险因素分析[J].实用医学杂志,2007,23(24):3875-3877.
[2]周卿,陈天适,刘晓红,等.阿托伐他汀对老年冠状动脉严重病变患者左心室功能的影响[J].中国医药,2010,5(1):1-4.
[3]Kumana CR,Cheung BM,Lauder IJ.Simvastatin reduced mortality and vascular events in high-risk patients[J].ACP J Club,2003,138(1):2-3.
[4]Cannon CP,Braunwald E,McCabe CH,et al.Intensive versus moderate lipid lowering with statins after acute coronary syndromes[J].N Engl J Med,2004,350:1495-1504.
[5]吉世军.阿托伐他汀治疗急性冠脉综合征的疗效[J].实用药物与临床,2011,14(1):79-80.
[6]曹东来,王志强,韩冷,等.阿托伐他汀对急性冠脉综合征患者血清炎性指标的影响[J].中国临床医学,2010,17(6):791-792.
[7]丁颖.阿托伐他汀短期治疗对脑梗死患者血脂和炎性标志物表达的影响[J].中国临床医学,2007,14(2):158-159.
[8]吴晓琰,陆怡,施小梅.阿托伐他汀治疗老年人代谢综合征[J].中国临床医学,2008,15(4):459-461.
[9]刘时武,王喜玉,马建林,等.瑞舒伐他汀对高胆固醇血症患者炎症细胞因子的影响[J].实用医学杂志,2010,26(13):2419-2421.
[10]余慧文,蒋作锋,韦建瑞.阿托伐他汀钙对高血压病患者血脂异常的疗效及对高敏C反应蛋白的影响[J].中国医药,2011,6(4):393-394.
[11]施中平,林斌,王军.阿托伐他汀对代谢综合征患者部分炎症因子的影响[J].实用医学杂志,2010,26(19):3625-3626.
[12]Bustos C,Hernández-Presa MA,Ortego M,et al.HMG-CoA reductase inhibition by atorvastatin reduces neointimal inflammation in rabbit model of atherosclerosis[J].J Am Coll Cardiol,1998,32(7):2057-2064.
[13]Pruefer D,Scalia R,Lefer AM.Simvastatin inhibits leukocyteendothelial cell interactions and protects against inflammatory processes in normocholesterolemic rats[J].Arteioscler Thromb Vasc Bio,1999,19(12):2894-2900.
[14]Laufs U,Liao JK.Post-transcriptional regulation of endothelial nitric oxide synthase mRNA stability by Rho GPPase[J].J Biol Chem,1998,273(37):24266-24271.
[15]燕晓雯,李维勤,黎介寿,等.通过改变盲肠结扎长度制造不同感染程度的大鼠盲肠结扎穿孔模型[J].中华实验外科杂志,2007,24(11):1340.
[16]刘福英,刘田福.实验动物学[M].北京:中国科学技术出版社,2005:209-210.
[17]乐胜,张舜玲,刘志红,等.p38丝裂原激活蛋白激酶抑制剂对脓毒症鼠心肌损伤的保护作用[J].中国医药,2009,4(5):324-316.
[18]吕杰,杨劲松,安友仲.活血中药对大鼠脓毒症早期循环及活化蛋白 C 的影响[J].中国医药,2010,5(3):212-214.
[19]朱雪琦,刘清泉,姚永明.脓毒症动物模型制备方法的研究进展[J].中国危重病急救医学,2006,18(2):114-116.
[20]李文娟,颜亮,李经华,等.脓毒症大鼠生命体征变化的低应激连续观察[J].实用医学杂志,2008,24(4):531-533.
[21]Gawel S,Wardas M,Niedworok E,et al.Malondialdehyde(MDA)as a lipid peroxidation marker[J].Waid Lek,2004,57(9-10):453-455.
