瘦素对L-02肝细胞甘油三酯沉积及乙酰辅酶A羧化酶表达的影响
2011-06-18周红宇阳学风
周红宇,阳学风
非酒精性脂肪肝(NAFLD)是一种肝组织学改变的临床病理综合征,与酒精性肝病相类似,但与饮酒无明确关系。根据其病理学改变及临床表现,分为单纯性脂肪肝、脂肪性肝炎、脂肪性肝纤维化、脂肪性肝硬化[1]。肝脏所含脂质绝大部分为甘油三酯,各种致病因素均可导致肝细胞内甘油三酯(TG)异常堆积,从而导致FLD的发生。
瘦素是肥胖基因(Obese gene)编码的蛋白产物,受体广泛分布于脂肪、骨骼肌、肝脏、心、肺、胰、卵巢、睾丸等组织。瘦素通过与受体结合发挥作用[2],调节机体脂肪的稳定,抑制食欲、增加能耗和减少体重可能是瘦素的主要作用。本文以人肝L-02脂肪变细胞模型,通过油红“O”染色、RTPCR等方法,对瘦素作用后的脂肪变细胞进行研究,了解瘦素与NAFLD的关系,并初步探讨瘦素对其的治疗作用。
1 实验方法
1.1 非酒精性脂肪变肝细胞模型的建立 人肝L-02细胞株培养接种于50mL培养瓶中,在含体积分数10%的灭活胎牛血清、100 U/mL青霉素和100μg/mL链霉素的 1640完全培养基中,于37℃,5%CO2培养,饱和湿度,贴壁生长。待细胞长满80%瓶底,消化液消化传代。在更换新鲜培养液后加入胎牛血清,使其浓度为50%,继续培养24 h,形成非酒精性肝细胞脂肪变性模型。
1.2 造模是否成功的判断 Lillie氏油红-O染色:将细胞培养于有无菌盖玻片的6孔培养板,用PBS冲洗盖玻片5min(×3次),50%异丙醇固定1min,油红“O”染色10min,蒸馏水冲洗1min(×3次),苏木素染色5min,分色和返蓝后,HPIAS-1000型图像分析系统收集图像。
1.3 RT-PCR法检测人肝L-02乙酰辅酶A羧化酶(ACC)mRNA的表达 以 lμg逆转录产物(cDNA)为模板,通过半定量RT-PCR,以三磷酸甘油醛脱氢酶(GAPDH)作为内参照。
2 结果
2.1 人肝L-02细胞脂肪化 正常细胞(图1)用50%胎牛血清培养基培养24 h后,用油红“O”染色,显微镜下观察,细胞浆内有大量脂滴存在,符合脂肪化肝细胞特点(图2)。

图1 正常肝细胞(油红‘O’×400)

图2 模型组(油红‘O’×400)
2.2 不同瘦素剂量干预后脂肪化人肝L-02细胞的变化 脂肪化人肝L-02细胞分别用10-7mol/L、10-6mol/L、10-5mol/L 瘦素 +1640 完全培养基培养24 h后,用油红“O”染色,显微镜下观察,脂肪化程度逐渐减轻,见图3~图5。
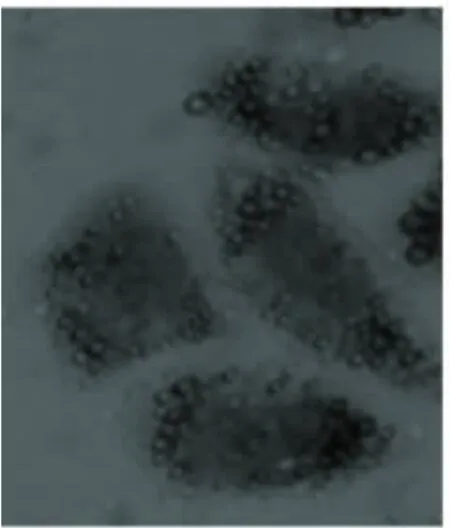
图3 模型组+瘦素10-7mol/L组(油红‘O’×400)

图4 模型组+瘦素10-6mol/L组
2.3 瘦素对人肝L-02脂肪变细胞乙酰辅酶A羧化酶mRNA表达的影响 用RT-PCR检测人肝L-02细胞乙酰辅酶A羧化酶mRNA的表达。结果显示,经瘦素处理的人肝L-02细胞乙酰辅酶A羧化酶mRNA的表达与瘦素呈浓度依赖性递减。模型组、10-7mol/L、10-5mol/L 及10-5mol/L 瘦素处理组目的基因及GAPDH基因灰度值比值分别为0.867、0.745、0.642、0.512,正常组及正常细胞加瘦素组分别为0.460及0.437,见图6。瘦素处理组与模型组相比,差异有统计学意义(P<0.05)。
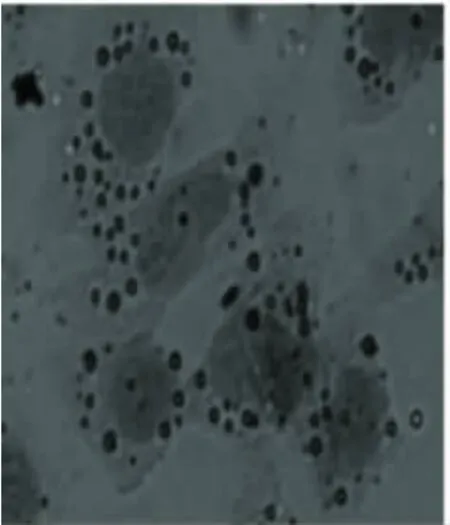
图5 模型组+瘦素10-5mol/L组
图6 不同浓度瘦素处理对人肝L-02脂肪变细胞ACCmRNA表达的影响(灰度值)
3 讨论
近年来,随着生活水平的提高,饮食结构的变化,检测手段的提高,非酒精性脂肪肝(NAFLD)发病率呈逐年上升趋势。自1994年起,一系列研究结果表明,NAFLD的发病无性别差异,在非肥胖和糖尿病人群中也有较高的发病率。特别是发现NAFLD可进展至肝炎、肝纤维化和肝硬化之后[3-4],逐渐为人们所重视。约75%的2型糖尿病患者可发生不同形式的NAFLD;70%的肥胖患者发生脂肪肝,其中18%出现 NASH[5]。NAFLD的发病机制尚不十分清楚,人们广泛认同Day等[6]提出的“二次打击”理论。多因素联合作用诱发胰岛素抵抗(IR),后者通过增加脂肪分解和FFAs转运至肝脏导致第一次打击—脂肪肝形成,并造成肝脏对第二次打击的敏感性增强。氧应激、脂质过氧化等进一步促进IR,加重氧应激和肝细胞损伤,导致炎症反应、肝细胞变性和肝纤维化,即第二次打击。本研究结合文献方法[7],用高脂培养基造模,形成典型的非酒精性脂肪肝细胞模型,主要研究NAFLD形成的第一步肝细胞内脂肪沉积及瘦素干预后的变化。
肝脏是体内参与脂质代谢的重要场所。肝脏脂质代谢稳态的变化是构成各种形式脂肪肝的基础,各种致病因素可通过一个或多个环节导致肝细胞内TG异常堆积。肝细胞不能储存脂肪,TG在肝细胞内,一方面氧化分解供能,另一方面与载脂蛋白B100、载脂蛋白C等以及磷脂、胆固醇结合生成极低密度脂蛋白(VLDL),由肝细胞分泌通过血液循环运输至肝外组织。当肝细胞合成TG增多,TG转运或氧化障碍时,均可导致TG的堆积,形成脂肪肝。
本实验发现肝细胞普遍发生脂肪变性,细胞肿胀,内含较大的脂肪滴,可将细胞核挤压向胞膜,表明高脂环境可引起肝脏脂肪浸润(TG贮存)。而经过瘦素处理后,肝细胞内脂滴明显减少,细胞形态恢复正常,与瘦素呈剂量依赖性关系。说明10-7~10-5mol/L浓度的瘦素对离体脂肪变肝细胞有积极的防治作用。
瘦素是一种主要由白色脂肪组织分泌合成、由167个氨基酸残基组成的蛋白质类激素[8]。主要在白色脂肪组织中表达,通过靶细胞膜上的受体及相应的信号转导体系发挥作用。OB-Rb主要存在于下丘脑中能表达NPY的细胞表面,与瘦素结合后,通过Janus激酶(JAK)以及信号转导和转录激活物(STAT)蛋白发挥信号转导作用,调控核内DNA上leptin效应基因的转录活性。瘦素与特异性运输蛋白结合,通过血脑屏障后与下丘脑特异受体结合,把体脂信号传递给下丘脑。下丘脑再通过一系列神经体液因素调节机体能量代谢,调整体脂,控制体重相对恒定[9]。给OB小鼠脑脊液中注入瘦素后[10],进食明显减少,体重逐渐下降,减少的仅为脂肪组织,且基础代谢率有所升高,说明抑制食欲、增加能耗和减少体重可能是瘦素减肥的主要机制。
瘦素可能从外周直接拮抗肝脂肪变性。瘦素可以激活AMP活化蛋白激酶,减少脂肪沉积[11],还可特异性抑制肝脏的硬脂酰基-辅酶A去饱和酶,使肝脏 VLDL生成和脂肪沉积减少[12]。Unger等[13]认为,非脂细胞瘦素受体发生功能障碍时,细胞内TG含量能增加100倍,而持续表达的异位高瘦素血症能使细胞内TG耗竭;瘦素还干预胰岛素在肝脏中的作用,一方面拮抗胰岛素诱导的PEPCK下调,抑制胰岛素受体底物-1(IRS-1)的磷酸化,影响胰岛素受体后信号转导;另一方面,瘦素通过对PEPCK及糖异生的影响,限制TG的合成,提高肝脏及外周组织对胰岛素的敏感性。Stumvoil等[14]发现,瘦素与脂联素等连用,能促进小鼠肝脂肪燃烧及能量消耗,可逆转缺乏过氧化物酶体增殖受体(PPAR)α的脂肪萎缩小鼠的胰岛素抵抗。
本实验证实细胞内TG明显增加,经过瘦素处理后,肝细胞内TG明显减少,与瘦素呈剂量依赖性关系。说明瘦素能明显减少离体脂肪变肝细胞的TG沉积,与文献[12-15]报道一致。本实验显示,瘦素对离体脂肪变肝细胞具有降低细胞内脂肪沉积的作用,对TG的作用明显。同时,本实验通过油红“O”染色显示,瘦素处理后脂肪变肝细胞内TG量明显减少,瘦素可抑制乙酰CoA羧化酶的表达而抑制TG的合成,可见瘦素可使离体肝细胞内TG合成减少,减少TG沉积,从而减轻肝细胞脂肪化程度。但其对人类非酒精性脂肪性肝脏疾病是否具有治疗意义,以及具体作用机制,有待进一步研究。
[1]周峘,滕香宇,刘伟.2型糖尿病和非酒精性脂肪肝[J].中国临床医学,2007,14(5):675-677.
[2]Day CP.Non-alcoholic steatohepatitis(NASH):where are we now and where are we going[J].Gut,2002,50(5):585-588.
[3]郭宏,许传芬,郭冬.非酒精性脂肪肝患者肝损害程度与代谢综合征各组分的关系[J].中国医药,2010,5(12):1139-1141.
[4]杨秉辉.非酒精性脂肪性肝病与肝癌[J].中国临床医学,2011,18(1):1-2.
[5]Medina J,Fernández-Salazar LI,García-Buey L,et al.Approach to the pathogenesis and treatment of nonalcoholic steatohepatitis[J].Diabetes Care,2004,27(8):2057-2066.
[6]Day CP,James OF.Steatohepatitis:a tale of two“hits”[J].Gastroenterology,1998,114(4):842-845.
[7]徐正捷,范建高,王国良,等.乳果糖对大鼠非酒精性脂肪性肝炎模型形成的影响[J].中华消化杂志,2003,23:97-100.
[8]臧谋圣,徐胜前.瘦素和瘦素受体在类风湿性关节炎及其骨质疏松发病机制中的研究进展[J].中国医药,2010,5(3):281-283.
[9]郑素梅,梁丽霞,郑风颖,等.瘦素与骨代谢[J].中国医药,2009,4(3):238-239.
[10]Le Lay S,Boucher J,Rey A,et al.Decreased resistin expression in mice with different sensitivities to a high-fat diet[J].Biochem Biophys Res Commun,2001,289[2]:564-567.
[11]Minokoshi Y,Kim YB,Peroni OD,et al.Leptin stimulates fatty-acid oxidation by activating AMP-activated protein kinase[J].Nature,2002,415[6869]:339-343.
[12]Oral EA,Simha V,Ruiz E,et al.Leptin-replacement therapy for lipodystrophy[J].N Engl J Med,2002,346:570-578.
[13]Uygun A,Kadayifci A,Yesilova Z,et al.Serum leptin levels in patients with nonalcoholic teatohepatitis[J].Am J Gastraenterol,2000,95(12):3584-3589.
[14]Stumvoil M,Tschritter O,et al.Association of T-G polymorphism in adiponection(exon 2)with obesity and insulin sensitivity:interaction with family history of type 2 diabetes[J].Diabetes,2002,51(1):37-41.
[15]张霞意,郭家伟,罗红彬,等.非酒精性脂肪肝与血清瘦素和可溶性瘦素受体的关系[J].实用医学杂志,2009,25(17):2849-2851.
