肥胖大鼠心肌细胞内游离钙浓度的变化
2011-06-15郝艳坤何志鹏魏韬
郝艳坤,何志鹏,魏韬
肥胖是心血管病的重要危险因素[1],肥胖与心脑血管病的关系已倍受临床重视。本研究选用合成的高脂饲料,成功地建立了肥胖不同易感性动物模型[2]。采用激光扫描共聚焦显微技术检测胞内Ca2+的变化情况。
1 材料与方法
1.1 肥胖易感性动物模型的建立 健康成年雄性SD大鼠60只,体质量180~200 g,由哈尔滨医科大学实验动物中心提供。大鼠给予高脂饲料喂饲2周后,根据体质量增加量排序,选出位于中间的1/4鼠(15只)为基础对照组(基础组),继续给予基础饲料,其余大鼠继续喂饲高脂饲料。在第8周时,再次按照体质量增加量排序,上1/3鼠(15只)为肥胖组,下1/3鼠(15只)为抵抗组,中间1/3鼠(15只)剔除。实验饲料参考了美国分析化学学会(AOAC)配方和美国营养学会(AIN)实验大鼠合成饲料配方[3]。
1.2 血清及体脂肪含量的测定 大鼠用水合氯醛35 mg/kg麻醉后,打开腹腔,自腹主动脉迅速采血2 ml,静置30 min,1000 r/min离心20 min,-80℃保存待用。用血清学试剂盒和血清自动生化分析仪测量血脂浓度指标。留取睾周脂肪组织、肾周脂肪组织和网膜脂肪组织,计算体脂肪含量。
体脂肪含量(%)=(睾周脂肪+肾周脂肪+网膜脂肪)/体质量×100%
1.3 心肌细胞的分离与Fluo-3/AM负载 水合氯醛溶液麻醉后,迅速开胸取出心脏,置于正常台氏液中,修剪组织后,主动脉逆行插管连在Langendorff离体灌流装置上。先用正常台氏液连续灌流5 min,然后用无钙台氏液继续灌流至心脏停搏,最后用浓度为0.02%胶原酶Ⅱ(8 mg/50 ml)和牛血清白蛋白(8 mg/50 ml)的无钙台氏液灌流分离心肌细胞。取分离稳定好的细胞,800 r/min离心3 min,去除上清液。分别用1/8、1/4、1/2、1倍有钙液进行梯度覆盖,每个10 min。用5 μmol/L Fluo-3/AM避光,37℃温箱染色40 min。1000 r/min离心1 min,去除负载液,用正常台式液冲洗2次,再用正常台式液将细胞稀释到所需浓度待用。
1.4 大鼠心肌细胞胞浆Ca2+浓度([Ca2+]i)测定 取分离后的细胞置于自制浴槽中,共聚焦激光扫描显微镜下选取杆状、横纹清晰无颗粒的细胞开始实验。在Time series模式下对XY平面的细胞扫描,每10 s采集一次数据,连续采集30次。基础荧光值按最小噪声最大图像信号人为设定。预扫描获得基础值后,于第2次和第3次扫描之间,在有钙液中加入终浓度为30 mmol/L KCl,在无钙液中加入10 mmol/L咖啡因进行扫描。平均荧光强度以给药后与给药前的荧光强度比值(FI∶FIo)表示[4-5]。
1.5 统计学方法 实验数据以()表示,组间比较采用SPSS 13.0软件进行方差分析。显著性水平α=0.05。
2 结果
2.1 体质量 至第12周时,基础组、肥胖组和抵抗组大鼠体质量分别为(520.57±49.87)g、(553.43±46.21)g、(507.00±40.59)g,肥胖组较抵抗组质量大(P<0.05);基础组、肥胖组和抵抗组体质量增量分别为(312.01±12.24)g、(350.29±12.57)g、(266.77±11.81)g,肥胖组与基础组、肥胖组与抵抗组比较均有显著性差异(P<0.05)。
2.2 体脂肪 肥胖组大鼠睾周脂肪、肾周脂肪、网膜脂肪和体脂比与基础组和抵抗组大鼠比较均有增高(P<0.05)。见表1。
2.3 血脂 肥胖组大鼠血浆血清总胆固醇、三酰甘油和低密度脂蛋白的浓度均高于基础组和抵抗组大鼠(P<0.05);肥胖组大鼠血浆高密度脂蛋白与基础组和抵抗组大鼠比较无显著性差异(P>0.05)。见表1。
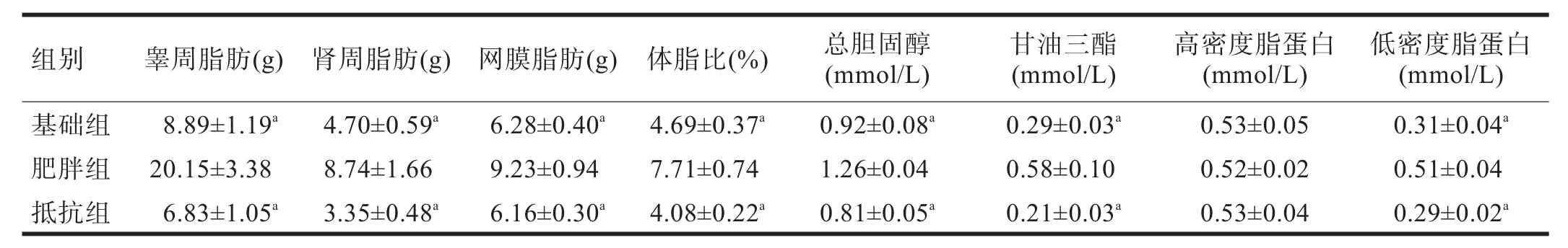
表1 各组大鼠体脂及血脂水平比较(n=15)
2.4 KCl诱导[Ca2+]i的变化 基础组、肥胖组与抵抗组大鼠心肌细胞[Ca2+]i平均荧光强度分别升高(6.33±0.56)、(4.74±0.29)和(9.14±0.57)倍,肥胖组较基础组及抵抗组降低(P<0.05)。
2.5 咖啡因诱导[Ca2+]i的变化 基础组、肥胖组与抵抗组大鼠心肌细胞[Ca2+]i平均荧光强度分别升高(3.54±0.27)、(2.67±0.24)和(4.62±0.28)倍,肥胖组较基础组及抵抗组降低(P<0.05)。
3 讨论
本实验通过高脂饮食筛选出肥胖易感性不同的大鼠,测定发现,在体质量增量、各部位脂肪湿重、体脂肪含量、三酰甘油等指标方面,肥胖组较基础组升;抵抗组动物的各项指标与基础组相近。提示饮食筛选出的肥胖与肥胖抵抗动物模型较为理想。
已有研究提示,肥胖者体内大量脂肪积聚,促进瘦素合成分泌,可导致钙离子通道、钠钙交换体等调控细胞内钙平衡的蛋白质功能紊乱。实验证明,肥胖大鼠心律失常的发生率显著高于正常大鼠[6]。导致肥胖大鼠心律失常易感性增高的因素可能是多方面的,如各种离子通道重构和失衡等都可以导致心肌细胞膜稳定性异常[7]。其中,Ca2+由于其第二信使的功能和介导兴奋-收缩耦联的作用,成为影响心肌电生理和收缩功能的核心离子。细胞内外Ca2+浓度的变化和失衡是形成触发活动,引发早后除极、迟后除极,诱导多种心律失常发生的根本机制。
我们应用共聚焦技术发现,肥胖组大鼠心肌细胞内钙在KCl除极后[Ca2+]i平均荧光强度明显低于基础对照组和肥胖抵抗组大鼠,提示肥胖可使大鼠心室肌内Ca2+浓度发生改变,可能是造成肥胖易发生心律失常的因素之一。
心肌细胞内Ca2+的平衡由内钙释放和外钙内流共同调节[7]。本实验在无钙环境采用咖啡因诱导钙瞬变,与基础对照组和肥胖抵抗大鼠相比,肥胖组大鼠心肌细胞钙瞬变幅度下降,提示肌浆网钙释放量和速率下降可能是由内钙释放降低造成的。
综上所述,肥胖心肌细胞内钙发生显著改变,导致心肌细胞内离子的平衡被打破,可能是肥胖心律失常的机制之一。该研究对今后开发预防治疗肥胖对心血管系统影响具有理论指导意义。
[1]Zacharias A,Schwann TA,Riordan CJ,et al.Obesity and risk of new-onset atrial fibrillation after cardiac surgery[J].Circulation,2005,112(21):3247-3255.
[2]Arias MA,Sanchez-Gila J.Obesity as a risk factor for developing postoperative atrial fibrillation[J].Chest,2006,129(3):828-829.
[3]孙志,张志成,刘志诚.营养性肥胖动物模型的实验性研究[J].中国药理学通报,2002,18(4):466-467.
[4]Chu WF,Sun HL,Dong DL,et al.Increasing intracellular calcium of guinea pig ventricular myocytes induced by platelet activating factor through IP3 pathway[J].Basic Clin Pharmacol Toxicol,2006,98(1):104-109.
[5]陈志勇,王玲,潘振伟,等.三氧化二砷对海马神经元细胞内改离子浓度的影响[J].哈尔滨医科大学校报,2007,41(1):16-18.
[6]郎临川,姜兴,郝艳坤,等.肥胖大鼠血脂和体脂肪变化及心室肌细胞内钙离子强度与心律失常发生的关系[J].中国地方病学杂志,2008,27(6):632-634.
[7]Zaugg M,Schaub MC.Cellular mechanisms in sympatho-modulation of the heart[J].Br J Anaesth,2004,93(1):34-52.
