脑衰反应调节蛋白-2(CRMP-2)促进海马神经元轴突生长
2011-06-14郑红云童永清
郑红云 李 艳 童永清
促进轴突生成不仅可以阻止AD患者脑中神经元轴突退行性变,而且还有可能促进退变轴突的再生。神经元极性是指绝大多数神经元存在一个长的轴突和几个短的树突。胎鼠海马神经元培养是研究神经元极性的良好模型[1,2]。培养的海马神经元的突起中一个突起发展成为长的轴突,剩下的突起则形成短的树突[3]。神经元发生发展到最后成熟需要经历6个阶段[4]:神经元自圆形细胞球开始,胞体周围开始伸出伪足(培养4 h),之后伪足逐渐形成小的突起(培养12~24 h),神经元突起继续生长,众多突起中有一个突起迅速生长成为轴突时,我们称该神经元极性已经形成(培养24~48 h)。因此,神经元极性形成的标志就是其轴突的生成。虽然轴突的运输模式及其正常的生理功能已经被研究得较为清楚,但有关神经元轴突生成的相关机制还知之甚少。
调节微管的脑衰反应调节蛋白2(CRMP-2)广泛高表达于发育神经系统,是CRMP家族5种亚型之一[5]。海马神经元处于生长状态的轴突含有丰富的CRMP-2,其在轴突生长锥中主要以非磷酸化CRMP-2活性形式存在[5]。国外研究发现,CRMP-2与管蛋白异二聚体相互作用而促进微管的聚集[6];CRMP-2通过与Numb以及重组肌丝的相互作用调节某些特异的黏附分子如 L1的内吞[7];CRMP-2可以与驱动蛋白-1轻链作用而将管蛋白异二聚体或Sra-1连接至驱动蛋白-1(Kinesin-1),然后CRMP-2/Kinesin-1复合物可以将管蛋白等运输到轴突远端[8],但国内有关CRMP-2与轴突生长的关系尚无相关研究。
本实验以原代海马神经元培养为研究模型,通过转染野生型或失活型CRMP-2质粒处理极性形成早期的神经元,探讨CRMP-2对海马神经元轴突生长的影响,为神经元极性形成机制提供新的理论基础。
1 材料与方法
1.1 动物 孕18 d的SD大白鼠30只(由华中科技大学同济医学院实验动物学部提供)。
1.2 试剂及抗体 DMSO购于sigm a公司。羊抗EGFP、鼠抗 DsRed均购自 Abcam(Cambridge,MA)、Tau-1抗体购自M illipore(Temecula,CA);Amaxa大鼠神经元核电转试剂盒(Rat Neuron Nucleofector Kit)购自 Lonza(Cologne,Germany);Rhodamine Red-X-,Oregon Green 488购自M olecular Probes(Eugene,OR,USA)。
1.3 质粒来源 The wild-type CRMP2(EGFP-w tCRM P2)and EGFP-T514D CRM P2突变体由美国Dr.K.Kaibuchi馈赠。
1.4 原代海马神经元细胞培养 无菌条件下取出孕18 d胎鼠的完整脑组织,剔除脑膜和血管,钝性分离出双侧海马;将海马剪成1mm3的组织块(以上均在冰上进行),置入解剖液(含3-6%葡萄糖DHanks)中,0.125%胰蛋白酶(Gibco,USA)37℃消化15min,加入种植培养液(含10%胎牛血清的DMEM培养基)终止反应,滴管吹打后经200目筛网滤过,1500r/min离心5m in,加入适当的种植培养液重悬,细胞计数,调至1×107/L,接种于预铺多聚赖氨酸的培养板或培养瓶中,于37℃、5%CO2培养箱中培养;4h后换成维持培养基(1%Glutamate/2%B27/97%Neurobasalmedia)。
1.5 免疫荧光双标标记 处理细胞吸出培养基,PBS漂洗后加入4%多聚甲醛常温固定15~20 min;PBS-0.1%Triton漂洗,然后PBS-0.5%Triton破膜5~10min,PBS-0.1%Triton漂洗,5%BSA封闭1 h,分别滴加羊抗 EGFP(1∶200)、兔抗DsRed(1∶1000)和鼠抗Tau-1(1∶200),于4℃孵育过夜,漂洗后分别加入荧光标记抗于室温孵育1 h,漂洗后50%甘油封片,于双光子共聚焦显微镜下观察。
1.6 核电转技术 原代海马神经元转染率较低,为了得到比较高的转染效率,我们选用了Amaxa Biosysterms公司 NucleofectorⅡ电转仪以及 Rat Neuron Nucleofector Kit对刚分离的海马神经元进行核转染。
1.7 统计学处理 采用SPSS 11.0统计软件,全部数据采用平均数±标准差(±s)表示;采用Image-Prop lus软件统计突起长度。
2 结 果
2.1 CRM P-2促进极性建立期原代海马神经元轴突的生长
原代海马神经元培养24h后采用核电转实验分别转染 EGFP,w tCRM P2[9]和失活型 T514DCRMP2(突变体,模拟磷酸化失活型CRMP-2)[9];第3 d检测CRMP-2对神经元轴突生长的影响;培养72 h固定做荧光三标,分别标记EGFP和轴突标志物Tau-1。转染EGFP载体对照组神经元正常发育,培养至48 h,神经元轴突特异性表达标志物蛋白Tau-1(图1A,右侧为局部放大图)。过表达了野生型CRMP-2的神经元除了生成一条长的特异性表达Tau-1的轴突(图1B,局部放大1)外,另外一条突起也发育成了特异性表达Tau-1的轴突(图1B,局部放大2);而过表达了失活型CRMP-2的神经元发育与正常组相比无差异(图1C),过表达了w t-CRMP-2的神经元平均轴突长度、轴突数目及多轴突神经元所占比例均明显增加,而失活型CRMP-2影响不大(图1D~1F)。
2.2 各组平均轴突长度、轴突数目和轴突所占比例
对照组平均轴突长度为185.4μm、轴突数目为1.1、轴突所占比例为10%;过表达野生型CRMP-2神经元平均轴突长度为250.3μm、轴突数目为2.1、轴突所占比例为40%;而转染突变体CRMP-2的神经元神经元平均轴突长度为180.0μm、轴突数目为0.9、轴突所占比例为9%(表1)。

图1 CRM P-2对神经元轴突生长的影响
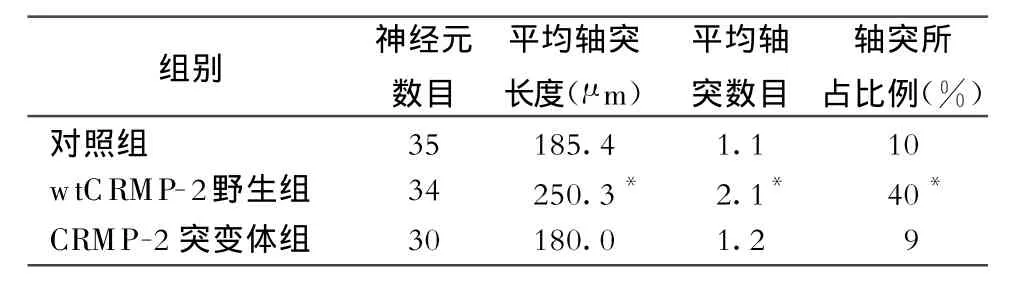
表1 分别转染w tCRMP-2和突变体CRM P-2对神经元轴突长度和数目的影响
3 讨 论
轴突生成是神经元发生发展的必要过程,在许多神经退行性疾病包括AD中,神经元轴突营养不良可能会导致轴突退行性变和神经元大量丢失,最后表现为认知和记忆障碍[10]。因此促进轴突生成不仅可以阻止AD病人脑中神经元轴突退行性变,而且还有可能促进退变轴突的再生。
细胞内神经元突起或轴突生长需要两种细胞骨架重组即肌丝[2]和微管[11]。微管的聚集存在于神经元的胞体和生长锥[12]。微管在轴突聚集通过2种方式:一种是微管聚合物的运输;另一种是微管聚集加尾。这两种方式都可以促进轴突的生长[13]。其中微管相关蛋白,如 Tau、MAP1A、MAP1B等蛋白分子在参与神经元轴突微管聚集和组装过程中起重要作用[14]。但更多与轴突相关的微管相关蛋白在神经元轴突生长中的作用尚不清楚。
CRMPs家族在中枢神经系统的发育过程中高度表达,尤其是脑组织发育的早期表达较多,该家族包括CRMP 1-5共5个成员,它们作为突起生长的信号分子参与神经元的发育过程。国外研究发现:CRM P-2与管蛋白异二聚体相互作用而促进微管的聚集[6];CRMP-2通过与Numb以及重组肌丝的相互作用调节某些特异的黏附分子如L1的内吞[7];CRMP-2可以与驱动蛋白-1轻链作用而将管蛋白异二聚体或Sra-1连接至驱动蛋白-1(Kinesin-1),然后CRMP-2/Kinesin-1复合物可以将管蛋白等运输到轴突远端[8],但国内有关CRMP-2与轴突生长的关系尚无相关研究。我们通过转染外源性DNA上调或下调CRM P-2表达水平,检测了其对神经元轴突生长的影响。研究结果表明过表达野生型CRMP-2可明显促进轴突生长,而磷酸化CRMP-2的突变体则没有显示任何的促进作用。以上结果表明非磷酸CRMP-2可促进神经元轴突生成和神经元极性建立。
1 Dotti CG,Sullivan CA,BankerGA.The estab lishm ent of polarity by hippocam pal neu rons in cultu re.J Neu rosci,1988,8(4):1454-1468.
2 Bradke F,Dotti CG.Establishment ofneu ronal polarity:lessons from cu ltured hippocampal neurons.Curr Opin Neurobiol,2000,10(5):574-581.
3 Craig AM,Banker G.Neuronal polarity.Annu Rev Neu rosci,1994,17:267-310.
4 Fukata Y,K imu ra T,Kaibuchi K.Axon specification in hippocam pal neurons.Neu rosci Res,2002,43(4):305-315.
5 InagakiN,Chihara K,A rim ura N,et al.CRMP-2 inducesaxons in cultured hippocampalneurons.Nat Neurosci,2001,4(8):781-782.
6 Fukata Y,Itoh TJ,Kimura T,et al.CRMP-2 binds to tubu lin heterodimers to promote m icrotubule assembly.Nat Cell Biol,2002,4(8):583-591.
7 Nishimura T,Fukata Y,Kato K,et al.CRMP-2 regulates polarized Numb-mediated endocytosis for axon grow th.NatCell Biol,2003,5(9):819-826.
8 Kawano Y,Yoshim ura T,Tsuboi D,et al.CRMP-2 is involved in kinesin-1-dependent transport of the Sra-1/WAVE1 com plex and axon formation.Mol Cell Biol,2005,25(22):9920-9935.
9 Yoshimu ra T,Kaw ano Y,A rimura N,et al.GSK-3beta regulates phosphory lation of CRMP-2 and neuronal polarity.Cell,2005,120(1):137-149.
10 Bobinski M,de Leon M J,Tarnaw ski M,et al.Neu ronal and volume loss in CA1 of the hippocam pal formation uniquely predicts duration and severity of A lzheim er disease.Brain Res,1998,805(1-2):267-269.
11 Brow n A,Li Y,Slaugh ter T,et al.Composite m icrotubu les of the axon:quan titative analysisof ty rosinated and acety lated tubulin along individualaxonalm icrotubu les.JCell Sci,1993,104(Pt 2):339-352.
12 Brow n A,Slaugh ter T,Black MM.New ly assembled m icrotubules are concentrated in the proximal and distal regions of growing axons.JCell Biol,1992,119(4):867-882.
13 Baas PW.M icrotubu les and axonal g row th.Cu rr Opin Cell Biol,1997,9(1):29-36.
14 Mandell JW,Banker GA.Themicrotubule cytoskeleton and the development of neuronal polarity.Neurobiol Aging,1995,16(3):229-237.
