α-玉米赤霉醇对转APP基因小鼠的影响
2011-06-14潘高峰毛善平董慧敏严明敏付志平
潘高峰 毛善平 张 乾 董慧敏 严明敏 付志平 李 燕
自上世纪90年代初以来,雌激素在防治阿尔茨海默病(A lzheimer's disease,AD)的作用就一直受到人们的关注,但是雌激素易诱发乳腺癌、子宫内膜癌及静脉血栓等副作用,因此限制了雌激素在防治AD中的临床应用。植物雌激素是从植物当中发现的具有雌激素样作用的物质,与雌激素相比更安全,例如白藜芦醇、大豆异黄酮及亚麻木酚素等。α-玉米赤霉醇是一种新型的植物雌激素,为一种选择性雌激素受体调节剂,同时具有雌激素样效应和抗雌激素样效应[1-4],其在防治AD方面尚未见相关报道。本实验应用转APP基因构建AD小鼠模型,应用α-ZAL治疗后,观察小鼠的行为学改变以及血清和脑组织中谷胱甘肽过氧化物酶(GSH-PX)、超氧化物歧化酶(SOD)活性及丙二醇(MDA)含量,以明确α-ZA L在防治阿尔茨海默病的作用以及作用机制,为临床应用α-ZAL防治AD提供实验依据。
1 实验资料
1.1 试剂与药物 α-ZA L(纯度≥98%)购买自sigma公司,超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-PX)及微量丙二醛(MDA)检测试剂盒由南京建成生物工程研究所提供。
1.2 实验仪器 M orris水迷宫购自中国医学科学院药物研究所,UV-7501紫外分光光度仪购自无锡科达仪器厂,RT-1904C生化分析仪由深圳雷杜科技有限公司提供
1.3 实验动物 9月龄转APP基因小鼠14只,体重(50±5)g,购自北京华阜康生物科技股份有限公司(质量合格证号:0187171,使用证号:00014980),9月龄健康与转APP基因小鼠遗传背景相同的C57BL/6J系正常小鼠7只,体重(50±5)g,北京华阜康生物科技股份有限公司(质量合格证号:0203284,使用合格证号:00014980)。
1.4 动物分组及给药 9月龄转APP基因小鼠按照体重、性别和M orris水迷宫测试成绩分层后随即分为2组:模型组、α-ZAL治疗组,每组7只,另选7只9月龄健康与转APP基因小鼠遗传背景相同的C57BL/6系正常小鼠按性别、体重及M orris水迷宫测试成绩组成正常对照组。α-ZA L治疗组从9月龄开始时分别灌胃给予溶于植物油的α-ZA L 1.0 mg◦(kg-1◦d-1,连续40天 。模型组和对照组灌胃等量的植物油连续40 d。
1.5 试验 水迷宫由圆形水池、图像采集系统以及操作分析系统组成。水池直径150 cm,高45 cm,水深32 cm。在一个象限内放置1个直径为5.5 cm,高30 cm的平台,水温保持在25℃左右,平台、水、池壁均染黑以隐蔽平台,水池周围有固定的参照线索供小鼠定位平台。摄像机装于水池上方约3 m处,并与监视器和计算机相连。(1)定位航行实验:给药40 d后开始检测3组动物隐匿平台逃避潜伏期。实验历时5 d,随机从4个不同象限入水,记录小鼠从入水至爬上平台的时间,即隐匿平台逃避潜伏期。爬上平台后停留10 s,超过60 s的记为60 s,每天进行1次。隐匿平台逃避潜伏期反映空间学习记忆能力;(2)空间探索实验:第6 d上午撤出平台,将小鼠随机从某一象限池壁中点面向池壁放入水中,记录60 s内穿越平台部位的次数。
1.6 血清和脑组织中SOD、GSH-PX活力和MDA含量的测定 各组小鼠脱颈处死,眼球取血,离心(3 000 r/min,10 min),分离血清置4℃备用;断头摘全脑以冰冷生理盐水清理血迹,用滤纸吸干,称质量,加入19倍冰冷生理盐水手动制成5%脑匀浆,离心(2 500 r/m in,10 m in),取上清液置4℃备用。GSH-PX、SOD活力和MDA含量测定应用自动生化分析仪和紫外分光光度计严格按照试剂盒说明书操作。
1.7 统计学处理采用SPSS16.0软件。计量资料数据采用均数±标准差(±s)表示,多组间比较采用方差分析,两两组间比较采用LSD-t检验。以P<0.05为有显著性差异,有统计学意义。
2 结 果
2.1 α-ZA L对转APP基因小鼠空间学习记忆能力的影响
2.1.1 定位航行试验 3组小鼠从水迷宫训练第1 d开始,模型组的逃避潜伏期较正常对照组明显延长(P<0.01),且随着训练天数的延长差异更趋于稳定。α-ZA L治疗组与模型组随着时间推移可见有明显差异(P<0.05),尤其在第4d开始就有显著性差异(P<0.01)。3组小鼠随着训练次数增多,寻找平台的时间也在缩短,说明学习锻炼可以增强空间学习记忆能力,但各组小鼠的空间学习记忆能力有差异(表1)。
表1 3组逃避潜伏期变化(±s,s)

表1 3组逃避潜伏期变化(±s,s)
注:与正常对照组比较﹡P<0.05,﹡﹡P<0.01;与模型组比较﹟P<0.05,﹟﹟P<0.01
组别逃避潜伏期第1 d 第2 d 第3 d 第4 d 第5 d模型组 57.29±3.75﹡﹡ 46.12±5.29﹡﹡ 37.49±6.01﹡﹡ 32.23±5.66﹡﹡ 27.23±6.76﹡﹡α-ZAL治疗组 47.21±7.45 34.53±7.27﹟ 25.04±8.32﹟ 18.29±7.36﹟﹟ 13.35±6.06﹟﹟正常对照组 42.93±5.79 29.56±3.41 19.76±6.03 14.40±4.67 8.16±2.62
2.1.2 空间探索实验 模型组与正常对照组之间比较差别有显著性差异(P<0.05),α-ZAL治疗组与模型组之间穿越平台的次数比较差别有显著性差异(P<0.05)(表2)。
表2 3组空间探索实验结果比较(±s,s)

表2 3组空间探索实验结果比较(±s,s)
注:与正常对照组比较,﹡P<0.05;与模型组比较,﹟P<0.05
组别 只数 60 s越平台的次数模型组 7 1.71±0.76﹡α-ZA L治疗组 7 3.86±1.07﹟正常对照组 7 4.43±1.13
2.2 小鼠血清中SOD、GSH-PX活性和MDA含量的测定 α-ZAL治疗组SOD、GSH-PX活性明显高于模型组,MDA含量明显低于模型组,均有显著性差异(P<0.01)。正常对照组SOD、GSH-PX活性明显高于模型组,MDA含量明显低于模型组,差别有高度显著性差异(P<0.01)(表3)。
表3 3组小鼠血清中SOD、GSH-PX活性和 M DA 含量比较(±s,s)
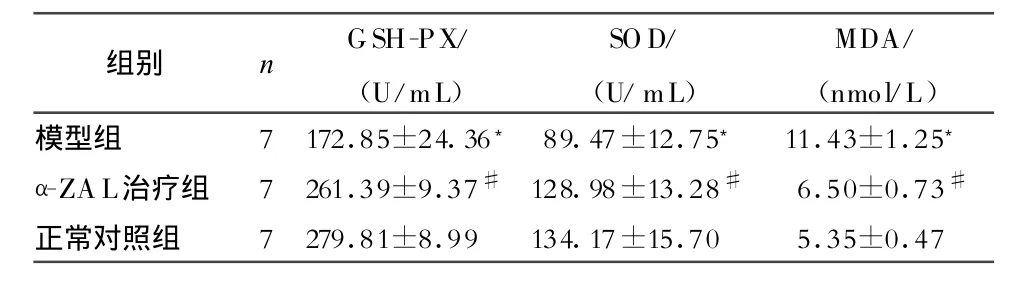
表3 3组小鼠血清中SOD、GSH-PX活性和 M DA 含量比较(±s,s)
注:与正常对照组比较﹡P<0.01;与模型组比较﹟P<0.01
组别 n GSH-PX/(U/m L)SOD/(U/m L)MDA/(nmo l/L)模型组 7 172.85±24.36﹡ 89.47±12.75﹡ 11.43±1.25﹡α-ZA L治疗组 7 261.39±9.37# 128.98±13.28# 6.50±0.73#正常对照组 7 279.81±8.99 134.17±15.70 5.35±0.47
2.3 小鼠脑组织中SOD、GSH-PX活性和MDA含量的测定 与正常对照组比较,模型组脑组织中SOD、GSH-PX活性活性下降、MDA含量增高(P<0.01)。与模型组比较,α-ZAL治疗组 SOD、GSHPX活性活性增高、MDA含量降低,有显著性差异(P<0.01)(表4)。
表4 3组小鼠脑组织中SOD、GSH-PX活性和 M DA 含量比较(±s,s)

表4 3组小鼠脑组织中SOD、GSH-PX活性和 M DA 含量比较(±s,s)
注:与正常对照组比较﹡P<0.01;与模型组比较﹟P<0.01
组别 n GSH-PX/(U/m L)SOD/(U/mL)M DA/(nmol/L)模型组 7 10.72±0.66﹡ 72.05±10.03﹡ 18.05±1.52﹡α-ZA L治疗组 7 18.99±3.40# 100.92±13.90#10.45±1.48#正常对照组 7 20.60±0.62 107.49±15.45 8.89±1.51
3 讨 论
阿尔茨海默病是老年期以渐进性记忆力和智能减退为特征的中枢神经系统退行性疾病,1906年由德国精神病学家A lois A lzheimer首次报道[5]。其临床特点为记忆障碍、认知障碍和精神异常等症状,病情呈进行性加重,逐渐丧失独立生活能力,最终多因并发感染而死亡。近一个世纪人们对AD进行了大量的研究,但由于AD的发病机制十分复杂,因此迄今为止,对于AD的有效的防治措施还远远没有解决。AD显著病理学特征为大脑皮质和海马神经细胞外出现β-淀粉样蛋白(β-amyloid protein,Aβ沉积形成老年斑(senile p laques,SP)、脑神经细胞内tau蛋白异常磷酸化聚集形成神经元纤维结(neurofibrillary tangles,NFTs)和选择性神经元缺失和突触改变。国内外大量实验研究表明,自由基引起氧化损伤是不同病因诱发神经退行性改变的最终的共同通路,氧化应激参与了AD的病理过程[6]。活性氧(ROS)是体内重要的自由基,它来源于线粒体磷酸化时分子氧到水的减少过程中,双分子氧减少的结果产生超氧阴离子(O◦2-)、过氧化氢(H2O2)和羟基自由基(◦OH),大量的自由基未能被清除,则损伤生物大分子包括蛋白质、DNA和脂质过氧化,致使神经细胞凋亡进而导致或加重AD[7]。神经细胞的减少和缺失是导致学习和记忆障碍的主要因素,MDA是自由基攻击机体产生的终产物之一,因此测定MDA的含量常常可以反映机体脂质过氧化的程度。GSH-PX和SOD是机体内清除自由基的关键酶,它们可以保护机体不受自由基的损伤,对它们的监测可以反映出机体抗氧化能力的强弱。本实验使用的转APP基因构建AD小鼠模型已得到公认,同时为了消除内源性雌激素对本实验的影响从而选择了9月龄小鼠并按性别进行配对分组。结果显示:与正常对照组比较,转APP基因模型组空间学习记忆能力显著下降,血清和脑组织中的GSPPX和SOD的活力降低,MDA的含量升高(P<0.01),说明氧化应激参与了AD的病理过程。
α-ZAL是玉米赤霉烯酮的还原产物。1962年Stob等首先报道玉米赤霉醇的培养基中分离出这用物质,证明具有雌激素样效应,可刺激小白鼠子宫增重,并可促进肉用牛羊增重而无可觉察的副作用。目前作为一种新型的植物雌激素药物,α-ZA L已经受到人们的广泛关注。在心血管疾病实验研究中证实α-ZAL可以增强超氧化物歧化酶(SOD)活性,加速H2O2和超氧阴离子的清除,减轻氧化应激损伤[8]。本实验早期给予转APP基因AD模型小鼠α-ZAL,其结果显示:α-ZAL对 AD模型小鼠空间学习和记忆能力有一定的保护作用,能增强GSH-PX和SOD活性,同时能有效清除体内脂质过氧化的代谢物MDA,降低脑组织NO含量,提高了机体的抗氧化能力。由此可以推断α-ZAL可以用来早期干预或预防AD,改善患者的认知、记忆等临床症状。其机制可能在于α-ZAL增强机体的抗氧化能力,保护了神经细胞,减少神经细胞的凋亡。
AD的发生是一个长时间持续性进展的过程,因此实验必需要有较长时间的观察才有可能获得更准确的结论。本实验为防治AD临床药物开发提供了有价值的参考依据,但是要获得更全面的信息还需要进行大量实验研究。相信随着研究的深入,α-ZAL作为一种新型的植物雌激素凭借其自身优势在防治AD等方面的应用会得到良好的发展。
1 戴顺龄,段金虹,陆 媛,等.α玉米赤霉醇——一个值得重视的新的植物雌激素.中国动脉硬化杂志,2005,13(5):670-672.
2 孙海燕,刘 舒,吕树铮,等.植物雌激素对心血管保护作用的研究进展.临床荟萃,2005,20(7):414-416.
3 Dai S.Phy toestrogen alpha-zearalanol inhibits atherogenesis and im proves lipid profile in ovariectom ized cholesterol-fed rabbits.Endocrine,2004,25(2):121-129.
4 李少春,程 炜,段 斐,等.α-玉米赤霉醇对去卵巢大鼠骨生物力学的影响.医学研究与教育,2010,27(3):6-8.
5 Ni Y.Activation of beta2-adrenergic receptor stimu latesgammasecretase activity and accelerates amy loid plaque formation.Nat Med,2006,12(12):1390-1396.
6 Ch risten Y.Oxidative stress and A lzheimer disease.Am JClin Nutr,2000,71(2):621-629.
7 于如同,李 祥,高立达,等.氧化应激诱导神经细胞凋亡与 c-M yc、Fas-FasL、核因子-κB关系的研究.中华创伤杂志,2003,19(6):344-347.
8 王 雯,邱笑违,蒋东桥,等.植物雌激素α-玉米赤霉醇对 HUVEC低氧/复氧损伤的保护作用.中国病理生理杂志,2006,22(11):2110-2112.
