左卡尼汀对大鼠肾缺血再灌注损伤时能量代谢的影响
2011-06-13许益笑王德选卢立肖杨宇真杨青王丽熊锡山
许益笑,王德选,卢立肖,杨宇真,杨青,王丽,熊锡山
(1.温州医学院 病理生理学教研室,浙江 温州 325035;2.温州医学院附属育英儿童医院 肾内科325027;3.上海长征医院 肾脏病研究所,上海 200003)
肾缺血再灌注损伤(renal ischemia reperfusion injury,RIRI)是缺血性急性肾损伤最主要的病理生理变化之一,常见于新生儿窒息、肺炎、休克及肾移植、肾切开取石术等[1],其发生机制极其复杂,至今仍未被完全阐明。左卡尼汀(L-carnitine)又名左旋肉碱, 可通过提高位于线粒体膜上卡尼汀脂酰转移酶的活性,促进脂肪酸代谢。有报道称其对心肌缺血再灌注损伤及脑缺血过程中具明显保护作用[2-3],但对于其在RIRI中的作用研究甚少。本实验利用在体大鼠肾缺血再灌注模型,从3个再灌注时间点观察肾功能、游离脂肪酸(free fatty acid,FFA)、钠钾ATP酶的变化及肾组织的超微结构改变,探讨左卡尼汀对RIRI的保护作用。
1 材料和方法
1.1 实验动物与试剂 雄性SD大鼠48只,重250~300 g,由第二军医大学实验动物中心提供。左卡尼汀注射液由常州兰陵制药有限公司生产(5 mL/g,批号为0003271)。FFA、钠钾ATP酶测定试剂盒购自南京建成生物工程研究所。其余均为市售分析纯品。
1.2 模型制备和分组 实验前禁食12 h,自由饮水,戊巴比妥钠(30 mg/kg)腹腔注射麻醉后,腹部备皮,腹正中切口打开腹腔,暴露肾脏,分离左肾动、静脉,无创动脉夹夹闭左肾动脉,肾脏由红变紫黑色表示夹闭成功;同样方法暴露右肾并切除。45 min后放开血管夹,见肾脏颜色由紫黑变为粉红后,关闭腹腔并放回鼠笼,维持室温37 ℃,予正常饮食,再灌注1 h、6 h、12 h,复制肾缺血再灌注损伤模型[4]。
实验动物随机分为对照组和左卡尼汀治疗组(治疗组)两大组,治疗组缺血前15 min及再灌注后40 min两次尾静脉注射左卡尼汀500 mg·kg-1[5],对照组同时点注射等量0.9%氯化钠溶液。每大组再分成4小组,即:①假手术组:仅行右肾摘除,左肾暴露45 min后取下;②缺血再灌注1 h组(IR1h组);③缺血再灌注6 h组(IR6h组);④缺血再灌注12 h组(IR12h组),每小组6只。各组动物实验结束时取血样后处死摘取左肾。
1.3 血清尿素氮(Bun)和肌酐(Scr)检测 各组动物左肾切除前眼睛框后取血,注入空白离心管,于4 ℃,3000 r/min离心10 min后取上清送第二军医大学新药评价中心检测血Bun和Scr。
1.4 肾皮质组织FFA含量、钠钾ATP酶活力检测各组大鼠在试验结束后迅速摘取左肾,沿冠状面切开,于靠近下极处切取肾皮质组织约200 mg,加生理盐水制成2%的匀浆,4 ℃ 3500 r/min离心5 min,取上层清液,按试剂盒说明书操作测FFA含量和钠钾ATP酶活力。
1.5 电镜观察 于左肾靠近下极处切取约0.1 cm×0.1 cm×0.1 cm大小的组织数块,予2.5%戊二醛前固定,1%锇酸后固定,乙醇丙酮系列梯度脱水,纯环氧树脂包埋剂浸透2 h,包埋聚合后超薄切片,醋酸双氧铀及枸橼酸铅双重染色10 min,H-7500型透射电镜(日本HITACH公司生产)观察、拍照。
2 结果
2.1 血清Bun、Scr含量的改变 对照组和治疗组大鼠血清Bun、Scr水平均随着再灌注时间的延长而逐渐升高。对照组的BUN、Scr均于再灌注6 h后开始与假手术组出现统计学差异(P<0.05或P<0.01);治疗组再灌注12 h的BUN(P<0.05)和再灌注6、12 h的Scr也显著高于假手术组(P<0.05和P<0.01),但低于相应对照组(P<0.01),见表1。
表1 各组大鼠血清Bun、Scr含量的比较(±s,n=6)
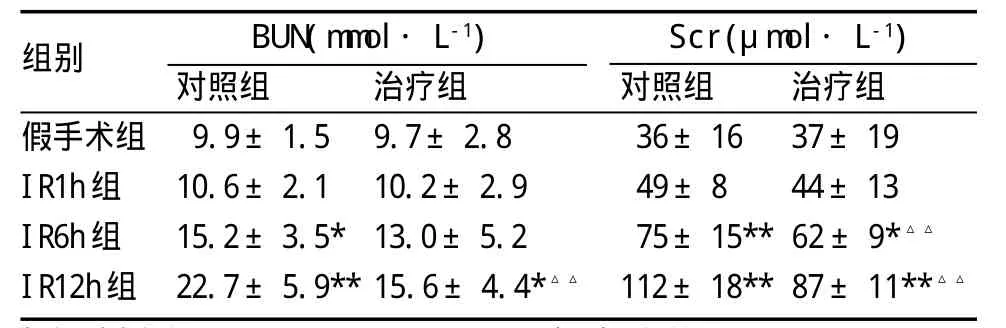
表1 各组大鼠血清Bun、Scr含量的比较(±s,n=6)
与假手术组比:*P<0.05,**P<0.01;与对照组比:△△P<0.01
组别假手术组IR1h组IR6h组IR12h组BUN(mmol·L-1)Scr(μmol·L-1)对照组9.9±1.5 10.6±2.1 15.2±3.5*22.7±5.9**治疗组9.7±2.8 10.2±2.9 13.0±5.2 15.6±4.4*△△对照组36±16 49±8 75±15**112±18**治疗组37±19 44±13 62±9*△△87±11**△△
2.2 肾皮质组织FFA含量、钠钾ATP酶活力的改变随着缺血再灌注时间的延长,肾组织中FFA含量逐渐升高,再灌注12 h后与相应假手术组比差异有统计学意义(P<0.01);钠钾ATP酶活力逐渐下降,再灌注6 h后与相应的假手术组比差异有统计学意义(P<0.05或P<0.01)。治疗组再灌注12 h后钠钾ATP酶活力显著高于相应对照组(P<0.01);而FFA含量较相应对照组下降(P<0.01),见表2。
2.3 肾脏组织超微结构变化 假手术组肾小管上皮细胞胞浆中存在大量线粒体(箭头),极少见变性空泡,无断裂,嵴间隙清晰可见,色深,细胞核无明显固缩,见图1①。IR12h对照组肾小管上皮细胞线粒体数量明显减少、肿胀,嵴模糊,大量空泡变性(箭头),细胞核明显固缩,见图1②。IR12h治疗组肾小管上皮细胞胞浆线粒体较丰富,部分肿胀(箭头),少见空泡变性,嵴可见,细胞核轻微固缩,见图1③。
表2 各组大鼠肾皮质FFA含量、钠钾ATP酶活力的比较(±s,n=6)

表2 各组大鼠肾皮质FFA含量、钠钾ATP酶活力的比较(±s,n=6)
与假手术组比:*P<0.05,**P<0.01;与对照组比:△P<0.01
组别假手术组IR1h组IR6h组IR12h组FFA(μml·mg-1prot)对照组27.67±7.12 29.50±9.24 33.43±7.74 53.43±9.31**治疗组23.85±5.11 28.87±6.54 30.12±9.03 41.95±4.60**△钠钾ATP酶活力(U·mg-1 prot)对照组0.985±0.273 0.916±0.33 0.549±0.166*0.394±0.092**治疗组0.950±0.287 0.921±0.294 0.670±0.181**0.581±0.074**△

图1 肾近曲小管上皮细胞超微机构(×17000)
3 讨论
左卡尼汀是一种氨基酸衍生物,可由人体内源性产生或自肉类食品中摄取。它本身并非机体的基本营养素,而是脂肪酸进入线粒体进行β-氧化所必需的辅助因子,可加速转运长链脂肪酸通过线粒体内膜,进入线粒体进行β氧化供能,与脂肪酸的利用及能量生成密切相关。因其对心肌缺血低氧的保护作用受到公认[6],左卡尼汀在临床上已开始应用于心肌梗死、中重度心力衰竭及体外循环手术患者。但关于其在RIRI中的作用,目前尚知之甚少。
因肾移植患者多为双侧肾功能严重衰竭,本实验采用右肾切除,左肾单侧缺血再灌注的RIRI模型,更贴近肾移植患者的临床实际。结果显示对照组大鼠血Bun、Scr明显升高,且此改变随再灌注时间的延长而更加明显,提示大鼠的肾功能在再灌注后显著受损;肾超微结构显示肾小管上皮细胞肿胀,大量空泡变性,细胞核明显固缩,以上表明本次RIRI造模成功。而应用左卡尼汀后IR6h、IR12h治疗组大鼠血Bun、Scr较同时点对照组显著下降,超微结构可见组织损伤也明显减轻,说明左卡尼汀可改善肾功能,保护肾小管上皮细胞,从而减轻肾缺血再灌注损伤。
脏器缺血再灌注可从多个方面造成组织损伤,其中代谢受阻、能量不足是主要原因之一。缺血后,组织有氧氧化受阻,能量供应严重不足造成损伤,糖酵解的加速虽可提供ATP,但同时生成的大量酸性产物可诱发钙超载,导致线粒体严重受损,进一步干扰能量代谢。肾脏血供丰富,占心输出量的20%~25%;就单位重量而言,其氧耗仅次于心脏,机能活动极为旺盛,故能量代谢紊乱对RIRI的发生发展影响很大。Li等[7]报道RIRI时钠钾ATP酶活性受抑,可致细胞毒性水肿,线粒体、溶酶体膜破裂。脂肪酸为肾皮质的主要能源物质,特别是手术后或者急性肾损伤后,多种激素分泌增加可使体内糖原迅速分解,此时脂肪酸的供能作用更加重要。心肌缺血后,脂肪酸β-氧化的生理抑制剂丙二酰CoA水平下降,至再灌注30 min后达最低,导致缺血再灌注后脂肪酸的氧化迅速恢复且其氧化速率超过缺血前的水平[8],提示脂肪酸氧化供能可能在缺血再灌注后的能量供应中占重要地位。此外,脂肪酸的氧化更是血管内皮细胞唯一的能量来源,而左卡尼汀又是脂肪酸氧化途径中必不可少的辅助因子,因此左旋卡尼汀对血管内皮细胞有明显的保护作用。早在20世纪90年代,Hulsmann等[9]的研究就指出,内皮细胞在缺血期易向外释放卡尼汀,且细胞内剩余卡尼汀活性明显下降,而进一步研究发现,缺血前补充左旋卡尼汀可增加冠状动脉的血流量,改善缺血后的心功能[10]。
本研究结果表明,对照组再灌注后FFA含量逐渐升高,钠钾ATP酶活力逐渐下降,与假手术组比差异有统计学意义(P<0.01),肾小管上皮细胞超微结构显示线粒体数量明显减少,结构损伤严重,提示RIRI后线粒体破坏明显,FFA分解受阻堆积,能量生成障碍。应用左卡尼汀之后,FFA较对照组同时点明显下降,钠钾ATP酶活力明显升高,肾功能得到显著改善,超微结构显示线粒体数量增多,损伤减轻,表明左卡尼汀能有效保护肾功能,抑制肾缺血再灌注损伤,其机制可能与左卡汀促进FFA进行β-氧化,清除脂肪酸代谢的旁路产物及其他细胞内毒性[11],保护线粒体结构,减轻内皮损伤有关。
[1]陈孝文,江黎明,叶锋.急性肾功能衰竭[M].北京:人民卫生出版社,2001:26.
[2]夏经钢,王丽娟,胡健.左卡尼汀对兔在心肌缺血/再灌注损伤状态下抗氧化指标分析[J].中国医科大学学报,2006,35(4):364-366.
[3]Turkyilmaz C, Turkyilmaz Z, Onal E, et a1.L-carnitine pretreatment reduces apoptotic cell death in seven-day-old rats hypoxia ischemia [J]. Restor Neurol Neurosci,2010,28(6):817-824.
[4]Takada M,Chandraker A,Nadeau KC,et a1.The role of the B7 costimulatory pathway in experimental cold ischemia/reperfusion injury[J].J Clin Invest,1997,100(5):1199-1203.
[5]Sener G,Paskaloglu K,Satiroglu H,et al. L-carnitine ameliorates oxidative damage due to chronic renal failure in rats[J].J Cardiovasc Pharmaccol,2004,43(5):698-705.
[6]Serati AR, Motamedi MR, Emami S, et a1.L-carnitine treatment in patients with mild diastolic heart failure is associated with improvement in diastolic function and symptoms[J]. Cardiology,2010,116(3):178-182.
[7]Li DB, Zhao CL, Lin HY, et a1. Effects of astragalus and angelica injections on adenosine triphosphate-ase in renal injury induced by ischemia/reperfusion in rabbits [J].Chin J Clin Rehabil,2005,9(15):222-224.
[8]Calvanim M , Reda E, Arrigoni-Martelli E.Regulation by carnitine of myocardial fatty acid and carbohydrate metabolism under normal and pathological conditions [J].Basic Res Cardiol,2000,95(2):75-83.
[9]Hulsmann WC, Dubelaar ML. Carnitine requirement of vascular endothelial and smooth muscle cells in imminent ischemia [J]. Mol Cell Biochem,1992,116(122):125-129.
[10]Gesuete V, Ragni L, Picchio FM, et al. The “big heart” of carnitine [J]. G Ital Cardiol (Rome),2010,11(9):703-705.
[11]Gorur S, Bagdatoglu OT, Polat G. Protective effect of L-carnitine on renal ischaemia-reperfusion injury in the rat[J]. Cell Biochen Funct,2005,23(3):151-155.
