蛋白激发子基因peaT1植物表达载体的构建及其转化棉花的研究*
2011-06-12唐宏琨曾洪梅杨秀芬袁京京邱德文
唐宏琨, 曾洪梅, 杨秀芬, 袁京京, 邱德文
(中国农业科学院植物保护研究所,农业部生物防治重点开放实验室,北京 100081)
自1987年Umbeck首次报道通过农杆菌介导法[1],将卡那霉素抗性基因转入棉花以来,棉花转基因研究迅速发展。国内外利用农杆菌介导法已将抗虫、抗除草剂等有价值的目的基因导入棉花,得到了稳定遗传的转基因棉花。我国农业部于1997年批准了转基因棉花的商业化种植,至2007年转基因棉花已占棉花种植面积的60%以上,产生了显著的经济、生态和社会效益。
蛋白激发子是一类能够诱导植物产生防卫反应的信号分子,在植物与病原菌的相互识别中起重要作用。其对病原菌无直接毒杀作用,通过信号传导诱导植物产生乙烯、水杨酸、吲哚乙酸、茉莉酸、植保素和病程相关蛋白等[2-3],调节植物的新陈代谢,激活植物的免疫系统,从而促进植物生长、增强植物抵抗病原菌的能力,有效防止或减轻病害的发生。peaT1是本实验室从极细链格孢(Alternaria tenuissima)中分离出来的蛋白激发子,具有诱导多种植物产生系统抗性、促进植物生长、改善作物品质等作用[4-6]。peaT1的编码基因已被克隆(GenBank登录号为EF030819),在大肠杆菌和毕赤酵母中的表达蛋白仍具有诱导植物抗旱、促进根系生长等生物活性[7-8]。
关于蛋白激发子转基因植物的研究目前已有报道,并展现出较好的应用前景。Qiu[9]等将蛋白激发子基因pemG1转化水稻和烟草,转基因作物表现出较好的抗病性。邵敏等[10]将来自水稻白叶枯病菌(Xanthomonasoryzae pv.oryzae)的hr f AXoo基因转化水稻,转基因株系中水稻白叶枯病菌的生长明显受到抑制。蒋冬花等[11]将隐地蛋白突变基因CryK 13V整合到烟草基因组中,结果表明转化植株的相关抗病性均有提高。本研究利用农杆菌介导法开展激发子基因peaT1的转基因棉花研究,建立了有效的转基因植株再生体系,获得了再生苗及大量的胚状体,为进一步培育抗病虫、高产优质的棉花品种提供了基础材料。
1 材料与方法
1.1 材料
蛋白激发子基因 peaT1由本实验室从极细链格孢菌克隆获得,质粒pET28a-peaT1由本实验室保存;植物表达载体 pCAMBIA 2300和农杆菌LBA 4404由本实验室保存;中间载体pG4AS-cup由中国农业科学院生物技术所郭三堆研究员惠赠;受体棉花品种‘中棉 24’(‘CCRI24’)由中国农业科学院棉花科学研究所提供。
ExTaq DNA聚合酶、T4 DNA连接酶、限制性内切酶、DNA Marker、pMD18-T Simple载体和DNA 片段回收试剂盒均购自大连TaKaRa公司,大肠杆菌感受态细胞DH5 和反转录试剂盒 EasyScript First-Strand cDNA Synthesis SuperMix购自北京全式金生物技术有限公司,质粒小提试剂盒购自天根生化科技有限公司,柱式植物RNAout试剂盒购自天恩泽生物公司,所用引物由英骏生物技术有限公司(Invitrogen)合成。卡那霉素和羧苄青霉素购自AMRESCO公司,其他化学试剂为国产分析纯产品。
1.2 植物表达载体的构建
设计含有 PstⅠ和 XhoⅠ酶切位点的引物primer1(TACTGCAGATGGCCAACCCCCGCATTGAAGAG)和p rimer2(CGCTCGAGCTA TATGCTCAGCGCCATGATGGA),以质粒 pET28apeaT1为模板扩增peaT1序列,引入PstⅠ和XhoⅠ酶切位点。将PCR产物回收后连接pMD 18-T Simp le载体,转化DH5α感受态细胞后提取质粒。将提取的质粒和中间载体pG4AS-cup分别用PstⅠ和XhoⅠ双酶切,连接含有目的基因pea T1的小片段和中间载体片段,得到重组载体pG4AS-peaT1。将重组载体pG4AS-peaT1和pCAMBIA 2300分别用Eco RⅠ和 H in dⅢ双酶切,回收目的片段经T4 DNA酶连接构成植物表达载体pCAMBIA 2300-peaT1。构建好的植物表达载体pCAMBIA 2300-peaT1热激法转化DH 5α感受态细胞,提取质粒用PstⅠ和XhoⅠ双酶切鉴定目的基因peaT1是否正确插入。采用冻融法将酶切鉴定的植物表达载体pCAMBIA 2300-peaT1转化农杆菌LBA 4404菌株。
1.3 农杆菌介导法转化CCRI24
1.3.1 菌株培养及无菌苗制备
挑取含有目的基因和选择标记基因的单菌落,接种于含50 mg/L卡那霉素和50 mg/L链霉素的YEB液体培养基中,28℃振荡过夜暗培养至对数生长期。用YEB液体培养基稀释菌液,再振荡培养4~6 h,至 A600值为0.5备用。‘CCRI24’棉花种子用硫酸脱绒后,自来水洗掉种子表面硫酸并晾干。70%乙醇表面消毒种子1Min,弃去乙醇,无菌水漂洗。再用0.1%的H gCl2表面消毒30 min,无菌水漂洗4次,种于1/2MS培养基上,28℃,2 000 lx光照培养7 d备用。
1.3.2 共培养
选取发育良好的无菌苗,将其下胚轴切成5~8mm长的茎段,浸泡在预先培养好的农杆菌菌液中。15min后取出,放置在铺有一层滤纸的含有2,4-D、KT和 IAA的 MS培养基上,21℃共培养48 h,然后转移到含有50mg/L卡那霉素、500Mg/L羧苄青霉素的上述培养基上,28℃、2 000 lx、每天光照14 h培养(以下培养条件相同),通过调整激素的浓度以诱导抗性愈伤组织[12-13]。
1.3.3 胚性愈伤及胚状体的诱导
将抗性愈伤组织转移到胚性愈伤诱导培养基上(MS+0.01mg/L 2,4-D+0.01mg/LKT+0.01mg/L IAA),45 d左右继代1次。将米黄色的颗粒状胚性愈伤转移到胚状体诱导培养基上(MS-NH4NO3+KNO3加倍+无激素+Gln 1.0 g/L+Asn 0.5 g/L+活性炭1.0 g/L+AgNO3 40mg/L),30 d继代一次直到出现胚状体[14-15]。
1.3.4 再生苗的培养及嫁接
将诱导出的胚状体转移到再生苗培养基上(MS+IAA 0.1 mg/L+6-BA 0.1 mg/L+G ln 1.0 g/L+Asn 0.5 g/L+活性炭1.0 g/L+AgNO3 40 mg/L),30 d左右继代一次。在装有营养土的土钵中种上普通棉花种子,待子叶完全展开时用作砧木苗。劈接法将再生棉株嫁接到砧木苗上,浇少量水后用透光塑料袋密封嫁接苗,25℃培养7 d左右,慢慢透气炼苗2~3 d即可移栽温室。
1.4 再生苗的分子检测
1.4.1 再生苗的PCR分析
取幼嫩再生棉花叶片,参照CTAB法提取总DNA,用 p rimer1和p rimer2进行 PCR 扩增,验证外源基因的整合情况。
1.4.2 再生苗的southern blot分析
CTAB法提取再生棉株2和4及PCR检测呈阴性的再生苗基因组DNA,用Eco RⅠ充分酶切基因组DNA约16 h,40 V电压下以0.8%琼脂糖凝胶(不加染料)电泳10~12 h,成像后切掉凝胶边角作为标记。参照Southern的方法[16],并结合DIG High Prime DNA Labeling and Detection Starter KitⅡ(Roche)说明书,对经PCR检测呈阳性的再生苗进行southern blot分析,以质粒 pCAMBIA-2300-peaT1作为阳性对照,PCR检测呈阴性的再生苗为阴性对照。
1.4.3 再生苗的RT-PCR分析
参照天恩泽柱式植物RNAout试剂盒方法,提取经PCR检测呈阳性棉花植株叶片总RNA,参照全式金EasyScrip t First-Strand cDNA Synthesis SuperMix试剂盒合成cDNA,进行RT-PCR分析。
2 结果与分析
2.1 植物表达载体的构建
从转化pCAMBIA 2300-peaT1的大肠杆菌DH 5α中提取质粒,用PstⅠ和XhoⅠ双酶切,如图1所示,酶切所得片段大小与理论值624 bp一致,说明pea T1插入预期位点,载体构建成功,该载体含有加倍增强子元件、和Kozak序列及多联终止密码子序列的表达盒,可以增强目的基因的表达[17]。

图1 重组质粒酶切鉴定
2.2 农杆菌介导法转化CCRI24
2.2.1 抗性愈伤的诱导
经共培养的无菌苗下胚轴切段转移到MS培养基上诱导愈伤组织,抗性愈伤组织的诱导和增殖受激素种类和浓度影响比较大。如表1所示,当只有KT、IAA时,愈伤组织生长缓慢,外植体长根多,只有KT、2,4-D时,愈伤生长快,愈伤多呈绿色硬块状不利于分化。只有2,4-D和IAA时,愈伤表面多呈白色霜状坚硬状态,不易分化。3种激素浓度均为0.1mg/L时,愈伤组织生长速度不是很快,多呈黄白色疏松状态,有利于进一步分化成胚性愈伤。
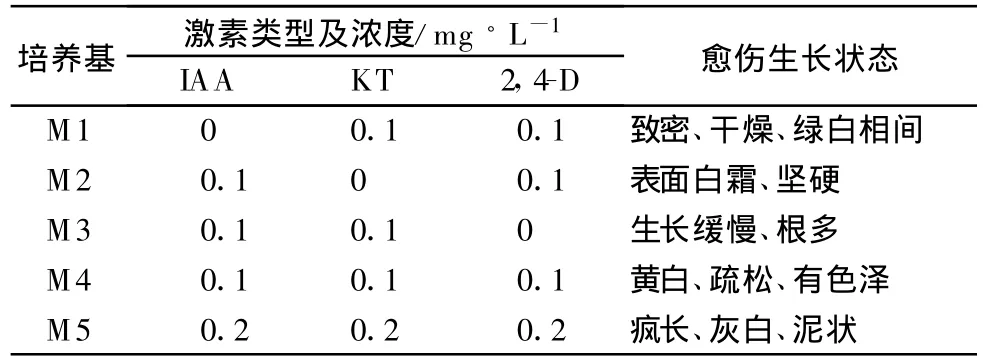
表1 激素对抗性愈伤诱导的影响
2.2.2 胚性愈伤及胚状体的形成
将灰白色疏松的抗性愈伤组织转移到胚性愈伤诱导培养基上,继代2~3次,可分化出米黄色的颗粒状胚性愈伤组织,将其转移到胚状体诱导培养基上,继代1~2次,诱导出了大量不同形态的胚状体细胞,根据其形态和生长时期分为球形胚、心形胚、鱼雷胚和子叶胚。
2.2.3 转化苗的再生及嫁接
挑选子叶胚在成苗培养基上继代培养2~3次,可诱导出再生苗,如图2所示。由于棉花组织培养生根比较困难,直接移栽成活率较低,本研究采用劈接法嫁接再生苗。将4棵长出4~5片叶的再生苗嫁接到准备好的砧木上,保湿7 d左右,缓慢透气炼苗3 d移栽温室培养。

图2 棉花转化苗的再生
2.3 再生苗的分子检测
2.3.1 再生苗的PCR分析
以CTAB法提取的4棵再生苗的总DNA为模板,用引物primer1和primer2进行扩增,结果如图3所示。PCR检测结果初步表明,目的基因peaT1已经整合到再生棉株2和4的基因组当中。
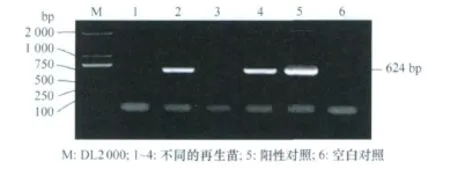
图3 棉花再生苗的PCR检测
2.3.2 再生苗的southern blot分析
从再生棉株2和4及PCR检测呈阴性的再生苗中提取DNA,进行southern杂交分析,如图4所示,质粒阳性对照及再生苗2和4均检测到杂交条带,其中再生苗4中目的基因为双拷贝插入,阴性对照没有杂交信号,表明目的基因peaT1已经整合到再生苗2和4基因组当中。
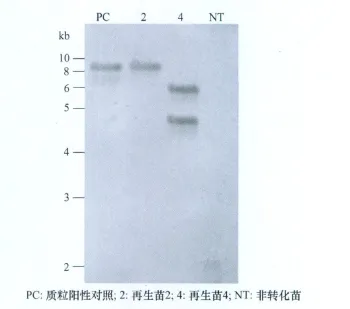
图4 棉花再生苗的southern blot分析
2.3.3 再生苗的RT-PCR分析
从PCR阳性株的叶片中提取总 RNA,以合成cDNA第1链为模板,primer1和primer2的PCR结果如图5所示,再生棉苗2和4均扩增到和阳性对照大小一致的条带,空白对照则没有目的条带,表明目的基因peaT1已经整合到再生苗2和4当中,并成功转录。
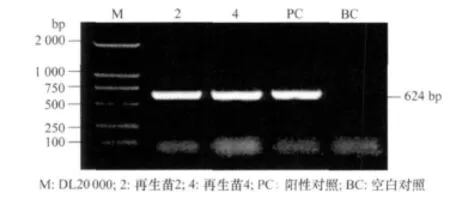
图5 再生苗的RT-PCR分析
3 讨论
棉花的农杆菌转化已经开展多年,并在许多品种上取得了成功。与其他作物相比,棉花组织培养受基因型限制,周期较长,体细胞胚胎发生困难等限制了其广泛应用[18]。组织培养中诱导出的胚性愈伤,在初次继代及随后胚状体诱导过程中会出现严重的褐化现象,导致胚性愈伤死亡。本研究中胚性愈伤继代时多伴有褐化现象,在培养基中添加活性炭和硝酸银一定程度上降低了褐化程度,需要进一步尝试更有效的办法避免或减轻褐化,以提高植株的再生率。针对棉花组织培养生根困难的问题,目前多采用嫁接法以缩短再生周期,保证再生苗的成活率。本研究采用劈接法嫁接再生苗,需要注意的是:嫁接过程中温度应控制在23~25℃[19],嫁接后浇水不宜过多,否则会引起砧木苗与土壤接触部分褐腐死亡,缓慢透气使幼嫩棉苗不易失水太快而引起萎蔫死亡,能保证嫁接苗的成活。
蛋白激发子pea T1是通过诱导植物自身免疫,达到抗病促生的作用,其不针对某一种或某一类病害,不会产生抗药性,对环境安全,应用前景广阔[20]。蛋白激发子基因pea T1与植物基因工程技术的广泛结合,将为培育具有广谱抗性的高产优质品种拓展更广阔的空间。
本研究采用农杆菌介导法,以棉花品种‘CCRI24’为受体材料,成功转化peaT1基因并得到再生苗,经分子生物学方法检测peaT1已经整合到棉花基因组当中,为开展激发子基因peaT1转化棉花的研究提供了基础材料。转peaT1基因的棉花能否产生对相关病害的抗性、表现出促进生长的功能,还需要进一步验证激发子基因peaT1在‘CCRI24’中的表达,综合分析转基因棉花的农艺性状、抗病性,期望能从转基因棉花后代中筛选到优良品种。
[1]Umbeck P,Johnson G,Barton K,et al.Genetically transformed cotton(GossypiuMhirsutuML.)p lan ts[J].Bio Technology,1987,5:263-266.
[2]Okinaka Y,Yang C H,Herman E,et al.The P34 sy ringolide elicitor receptor interacts with a soybean photorespiration enzyme,NADH-dependent hydroxypy ruvate reductase[J].Molecular Plan t-Microbe Interactions,2002,15(12):1213-1218.
[3]W einberger F.Pathogen-indu ced defense and innate immunity in macroalgae[J].Biological Bu lletin,2007,213(3):290-302.
[4]赵明治,杨秀芬,张明,等.一种促进植物根系生长的极细链格孢菌蛋白质分离、纯化和生物功能[J].中国生物防治,2007,23(2):170-173.
[5]邱德文,杨秀芬,刘峥,等.植物激活蛋白对烟草抗病促生和品质的影响[J].中国烟草学报,2005,11(6):33-36.
[6]张志刚,官春云,杨晓萍,等.细极链格孢菌蛋白激发子对棉株光合特性的影响[J].湖南农业大学学报,2008,34(1):1-5.
[7]刘权,李广悦,曾洪梅,等.微生物蛋白激发子pea T1的获得及诱导水稻抗旱性的初步研究[J].中国农业科技导报,2009,11(3):51-55.
[8]刘延锋,曾洪梅,玉山江,等.极细链格孢菌peaT1基因在毕赤酵母中的表达与功能分析[J].生物工程学报,2009,25(3):413-417.
[9]Qiu DW,Mao J J,Yang X F,et al.Expression of an elicitor-encoding gene fromMagnaporthe grisea enhances resistance against blast disease in transgenic rice[J].Plant Cell Reports,2009,28(6):925-933.
[10]邵敏,王金生.转hr fAXoo基因水稻对白叶枯病的抗性[J].南京农业大学学报,2004,27(4):36-40.
[11]蒋冬花,郭泽建,郑重.隐地蛋白(cryptogein)基因定点突变及其广谱抗病烟草转化植株的获得[J].植物生理与分子生物学学报,2002,28(5):399-406.
[12]刘传亮,武芝霞,张朝军,等.农杆菌介导棉花大规模高效转化体系的研究[J].西北植物学报,2004,24(5):768-775.
[13]李燕娥,焦改丽,吴家和,等.棉花农杆菌介导高效转化体系[J].中国棉花,2000,27(5):10-11.
[14]谢龙旭,李云锋,徐培林.根癌农杆菌介导的转aroAM12基因棉花植株的草甘膦抗性[J].植物生理与分子生物学学报,2004,30(2):173-178.
[15]李宝平,赵俊侠,石跃进,等.关键因子对棉花利用农杆菌介导法导入外源基因的影响[J].作物学报,2001,27(1):80-84.
[16]Southern E M.Detection of specific sequences among DNA fragmentsseparated by gelelectrophoresis[J].Jou rnal of Molecular Biology,1975,98:503-506.
[17]郭三堆,崔洪志.中国抗虫棉GFMCrylA杀虫基因的合成及表达载体构建[J].中国农业科技导报,2000,2(2):21-26.
[18]谢德意,金双侠,郭小平,等.棉花胚性愈伤组织的转化及转基因胚状体的有效萌发与成苗技术研究[J].作物学报,2007,33(5):751-756.
[19]李燕娥,朱祯,吴霞,等.转基因再生棉花嫁接初报[J].中国棉花,2000,27(3):25-30.
[20]邱德文.植物免疫与植物疫苗[M].北京:科学出版社,2008.
