Cry1Ah蛋白活性片段在溶液中的单体和寡聚体杀虫活性分析*
2011-06-12周子珊束长龙梁革梅宋福平
周子珊, 束长龙, 梁革梅, 苍 晶, 宋福平, 张 杰**
(1.东北农业大学生命科学学院,哈尔滨 150030;2.中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京 100193)
苏云金芽胞杆菌(Bacillus thuringiensis,简称Bt)是目前应用最广泛的微生物杀虫剂,其在形成芽胞时伴随产生Cry蛋白,大部分Cry蛋白以130~140 ku原毒素的形式存在,在昆虫肠道内被消化成55~60 ku的活性片段[1],Cry蛋白具有3个典型的结构域[2]。孔洞形成模型认为:活化的蛋白与幼虫中肠细胞上的初级受体(钙黏蛋白,cadherin)相结合,使得另外一种蛋白酶更容易切除Cry毒素的N末端即Domain I的α-1螺旋[3-4],这引起毒素多聚体形式的聚集。多聚体增加了与次级受体(氨肽酶N,aMinopeptidase N)结合的亲和力,寡聚体与次级受体结合后插入细胞膜,然后在中肠细胞膜上形成孔洞,引起渗透压失衡,导致中肠细胞破裂,最终导致昆虫死亡[2,5-6]。Cry蛋白在昆虫体内形成正确的寡聚体是能够插入细胞膜的前提条件,但离体情况下,自发形成的寡聚体可能影响Cry毒素与初级受体和次级受体的结合,从而影响成孔能力,最终影响活性。
cry1Ah1 基因(专利号:ZL200410009918.9)是从天然Bt菌株BT8中分离克隆的新型杀虫晶体蛋白基因,该基因全长 3 549 bps,编码1182个氨基酸,表达蛋白为134 ku[7]。Cry1Ah蛋白对亚洲玉米螟、水稻二化螟和棉铃虫的活性比Cry1Ac分别高7倍、5倍和近5倍[8]。然而Cry1Ah蛋白活性片段杀虫活性有不稳定的现象,经过纯化分析发现Cry1Ah活化蛋白中存在寡聚体。本文研究了NaCl对Cry1Ah蛋白寡聚化的促进作用,发现寡聚体能降低对棉铃虫(Helicoverpa arMigera)的活性。因此,在今后进行Cry蛋白活性研究和转cry基因植物[9]的构建过程中如何减少和避免体外寡聚化,将是BtCry蛋白除了高毒力之外应当引起足够重视的因素。
1 材料与方法
1.1 主要试剂和仪器
胰蛋白酶购自Sigma公司;其他试剂为市售国产或者进口分析纯或电泳级纯化学试剂。
Beckman高速离心机Avanti J-26xp;德国台式Eppendorf离心机 5415C;美国Bio-Rad公司 Mini p roteinⅢ蛋白电泳仪;瑞典法玛西亚公司高效液相色谱系统AKTA Exp lorer 100。
1.2 菌株和载体
Bt重组菌株Biot1Ah,本实验室构建[8],即由HD73无晶体突变株导入含有cry1Ah全长基因的重组质粒pSXY 422b-1Ah。
1.3 Cry1Ah蛋白
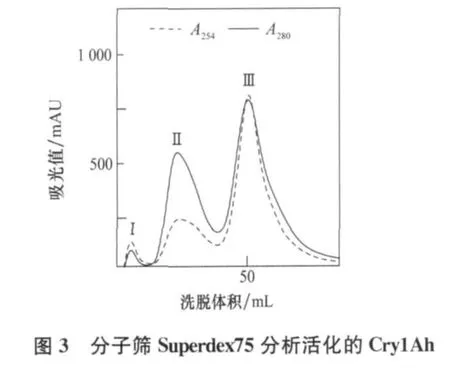
Cry1Ah蛋白的提取参照Xue等的方法[8]。提取的Cry1Ah经Brad ford法(Bio-Rad试剂盒,操作见厂家提供说明书)定量后,与胰蛋白酶按20∶1(质量)的比例混合,37℃,消化1 h,SDS-PAGE检测消化完全后,经分子筛Surperdex75纯化,缓冲液为50mmol/L Na2CO3,pH9.5,流速 1 ML/min,监测A254和 A280,并收集各峰组分。
1.4 戊二醛交联
戊二醛交联试验用以分析Cry蛋白寡聚化的程度。蛋白样品中加入质量浓度25%的戊二醛使其终浓度为2%,室温反应2 min;加入固体 NaBH4终止交联,NaBH4∶戊二醛(摩尔数)为 10∶1。然后,加入8μL 25%脱氧胆酸,和 25μL 78%的三氯乙酸[10],4℃,12 000 r/Min,离心10min,收集沉淀,超纯水洗2~3次沉淀,最后将沉淀溶于50 mmol/L pH 10.0的Na2CO3中,加入1/2体积的3×Loading buffer,煮沸3 min,进行SDS-PAGE检测。
1.5 生物活性分析
活化的Cry1Ah蛋白置于4℃储存1个月后(4℃存放易于形成寡聚体),经分子筛Superdex 75纯化,分别收集洗脱峰Ⅰ、Ⅱ和Ⅲ的蛋白,浓缩定量后,进行对棉铃虫的毒力测定,生物测定方法参照Xue等的方法[8]。
1.6 数据分析
采用POLO软件计算LC50值,通过SPSS 11.5软件进行显著性差异检测(p<0.05水平)。
2 结果与分析
2.1 Cry1Ah蛋白
从Biot1Ah中提取的Cry1A h原毒素蛋白分子量为134 ku(图1),经胰蛋白酶消化1 h后,形成约60 ku的活性片段(图2)。
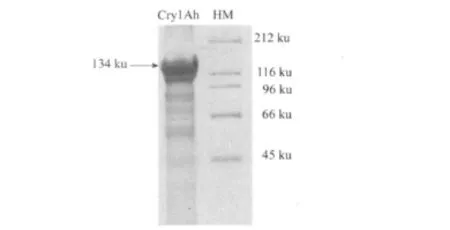
图1 Cry1Ah原毒素的 SDS-PAGE图谱

图2 经胰蛋白酶活化后的Cry1Ah毒素SDS-PAGE图谱
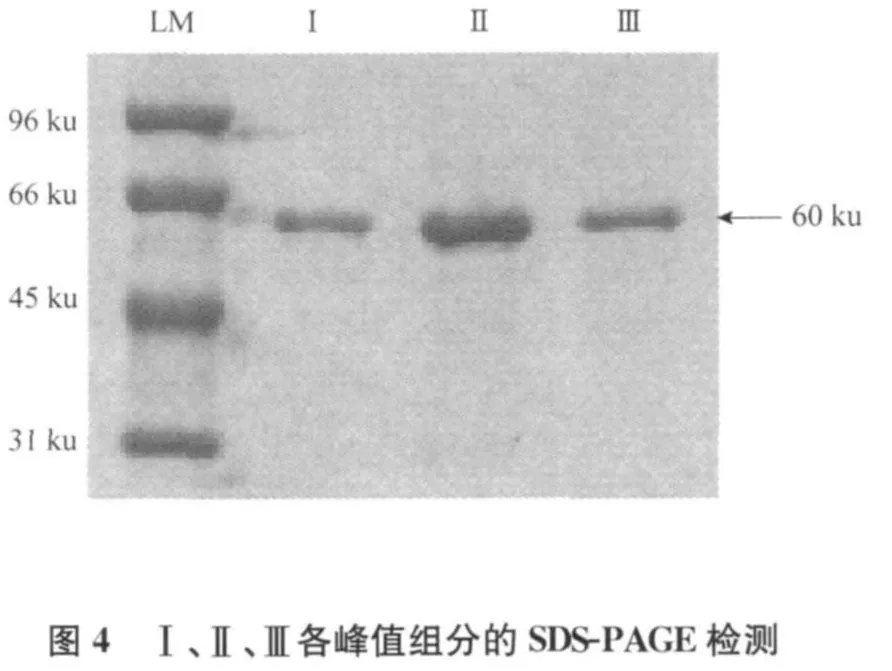
活化的Cry1Ah蛋白经分子筛Superdex 75纯化时出现3个峰(图3),收集各洗脱峰,并进行SDSPAGE检测结果表明,3个峰都只有60 ku的目的蛋白(图4)。这一结果表明,活化的Cry1Ah在溶液中同时以3种分子量形式存在,推测是一种单体和两种寡聚体。
2.2 NaCl对Cry1Ah寡聚化的影响
等量的Cry1Ah原毒素在胰蛋白酶消化时,添加不同终浓度的NaCl,消化完全后,经分子筛Superdex 75检测结果表明,随着NaCl浓度的升高,单体吸收峰(吸光值)有所降低,而寡聚体的吸收峰有一定程度的升高(图5),如峰Ⅲ(单体)的最大吸光值从83.8mAU(a)降至66.99 mAU(c),这说明在消化时加入一定浓度的NaCl,对Cry1Ah的寡聚化有促进作用。

2.3 戊二醛交联试验
戊二醛交联试验发现峰Ⅰ和Ⅱ除有60 ku的蛋白条带外,分别检测到3、4条分子量大于60 ku的蛋白条带(图6)。经Quantity One软件分析,峰Ⅱ寡聚体的4条带总的相对含量占总蛋白的16.12%,峰I寡聚体的3条带总的相对含量占总蛋白的63.35%,而峰Ⅲ只有60 ku的蛋白。这说明,活化的Cry1Ah蛋白,确实存在着寡聚化现象,而且寡聚体以多种形式存在,这一结果验证了此前的推论。
2.4 对棉铃虫的生物活性分析
生物活性测定结果表明,活化的Cry1Ah对棉铃虫的毒力与原毒素、单体峰Ⅲ和寡聚体峰Ⅱ间差异不显著(p<0.05);而寡聚体峰I的毒力比活化的Cry1Ah蛋白和原毒素分别降低了49.6倍和31.9倍(差异显著,p<0.05),比单体峰Ⅲ和寡聚体峰Ⅱ分别降低了11.9倍和14.2倍(差异显著,p<0.05)。这一结果说明,活化的Cry1Ah蛋白形成寡聚体后对棉铃虫的毒力下降。

图6 戊二醛交联分析Ⅰ、Ⅱ和Ⅲ的SDS-PAGE图谱

表1 Cry毒素对棉铃虫的生物活性测定
3 讨论
与很多cry基因相似,cry1Ah1基因表达134 ku的原毒素,经胰蛋白酶消化后,形成60 ku的活性片段,活性片段的生物活性与Cry1Ah原毒素毒力无显著差异。
Cry蛋白的寡聚化已有报道[11-12],一般情况下Cry原毒素则不会形成寡聚体[13],而体外活化的Cry蛋白在溶液中存在着不同程度的寡聚化现象,如 Cry1Aa、Cry1Ac、C ry1C 、C ry1D 和 Cry3A 蛋白在溶液中以单体和多聚体的混合物形式存在,其中寡聚体呈现的分子量大于 600 ku[13-15]。活化的Cry1Ie在溶液中能发生寡聚化[16],而寡聚化的Cry1Ie蛋白对于小菜蛾(P lutella xy lostella)2龄幼虫的毒力下降了100倍。本研究中Cry1Ah在离体条件下可形成不同分子量的寡聚体,而且寡聚体的高含量的大分子对棉铃虫的毒力显著下降。此外,NaCl可以加剧Cry1Ah活性片段在体外寡聚化程度,因此在研究Cry毒素过程中,应注意控制缓冲液的盐浓度,减少寡聚体的形成。此外,存放时间、温度和蛋白性质与浓度等因素也都有可能影响寡聚化,将在今后的研究中对这些因素进行深入探索。
Soberón等人报道经过分子设计的缺少α-1螺旋的Cry1A b和Cry1Ac,在体外没有初级受体Cadherin的情况下也可以形成寡聚体,并且对Cadherin沉默的烟草天蛾(Manduca sexta)和Cadherin缺失突变的抗性棉红铃虫(Pectinophora gossypiella)具有毒杀作用[17]。由此可见,形成正确的寡聚体对活性的影响十分重要。本研究的Cry1Ah(峰I组分)形成了占总蛋白的比例很高的、分子量较大的寡聚体分子,可能有部分基团被包裹在寡聚体的中心位置,影响与受体的识别和结合,另一方面可能由于没有切除α-1螺旋,因而没有形成完全正确的寡聚体形式,从而导致插膜的能力下降,毒力降低。因此,对寡聚体及其形成条件的研究为减少寡聚化程度提供有效方法,同时也为Cry1Ah蛋白在转基因方面的成功应用奠定理论基础。
[1]Höfte H,W hiteley H R.Insecticidal crystal proteins of Bacillus thuringiensis[J].Microbiol Mol Bio Rev,1989,53(2):242-255.
[2]Schnepf E,C rickmore N,Van R J,et al.Bacillusthuring iensis and its pesticidal crystal proteins[J].Microbiol Mol Biol Rev,1998,62:775-806.
[3]Gómez I,Sánchez J,Miranda R,et al.Cadherin-like recep tor binding facilitates proteolytic cleavage of helixα-1 in DoMain I and oligomer p re-pore forMation of Bacillus thuringiensis Cry1Ab toxin[J].FEBS Lett,2002,513:242-246.
[4]Jimenez-Juarez N,Munoz-Garay C,Gomez I,et al.Bacillus thuringiensis Cry1AbMutan ts affecting oligomer formation are non toxic to Manduca sexta larvae[J].JBiolChem,2007,282:21222-21229.
[5]de Maagd RA,Bravo A,Berry C,et al.Structure,Diversity and evolution of protein toxins fromspore-forMing en tomopathogenic bacteria[J].Ann Rev Genet,2003,37:409-433.
[6]Bravo A,Gómez I,Conde J,et al.O ligoMerization triggers binding of a Bacillus thuringiensis Cry1Ab pore-forMing toxin to aMinopeptidase N receptor leading to insertion into memb ranemicrodomains[J].BiochiMBiophys Acta,2004,1667:38-46.
[7]对鳞翅目昆虫高毒力的Bt cry1Ah基因及其表达产物:中国,ZL200410009918.9[P].2006-06.
[8]Xue J,Liang G,CrickmoreN,et al.Cloning and characterization of a novel Cry1A toxin fromBacillus thuringiensis with high toxicity to the Asian corn borer and other lepidopteran insects[J].FEMSMicrobiol Lett,2008,280:95-101.
[9]W ang Y,Lang Z,Zhang J,et al.Ubi1 intron-Mediated enhan ceMent of the expression of Bt cry1 Ah gene in transgenic maize(Zeamays L.)[J].Chinese Science Bulletin,2008,53(17):2041-2046.
[10]LaiZ,McCulloch J,Lashuel H A,et al.Guanidinehy drochloride-induced denatu ration and refolding of transthy retin exhibits a marked hysteresis:equilib ria with high kinetic bar riers[J].BiocheMistry,1997,36:10230-10239.
[11]V ie V,Van Mau N,Pomarede P,et al.Lipid-induced pore formation of the Bacillus thuring iensis C ry1Aa insecticidal toxin[J].JMemb r Biol,2001,180:195-203.
[12]Pun theeranu rak T,Stroh C,Zhu R,et al.Structure and distribution of the Bacillus thuringiensis C ry4Ba toxin in lipid Memb ranes[J].U ltraMicroscopy,2005,105:115-124.
[13]Guereca L,Bravo A.Theoligomeric state of Bacillus thu ringiensis Cry toxins in solution[J].BiochiMBiophys Acta,1999,1429:342-350.
[14]Feng Q,Beck telW J.pH-indu ced conformational transitions ofCry IA(a),C ry IA(c),and CryⅢA delta-endotoxins in Bacillus thuring iensis[J].Biochemistry,1994,33:8521-8526.
[15]W alters F S,Kulesza C A,Phillips A T,et al.A stable oligomer of Bacillus thuring iensis delta-endotoxin,CryⅢA[J].Insect BiocheMMol Biol,1994,24:963-968.
[16]Guo Shuyuan,Zhang Yancai,Song Fuping,etal.Protease-resistan t core forMof Bacillus thur ing iensis C ry1Ie:monomeric and oligomeric forms in solu tion[J].Biotechnol Lett,2009,31:1769-1774.
[17]Soberón M,Pardo-López L,López I,et al.Engineeringmodified Bt toxins to counter insect resistance[J].Science,2007,318:1640-1642.
