组氨酸标签人β干扰素在E.coli BL21(DE3)中的表达、纯化和活性测定
2011-06-08王丽非朱元军王松梅杜郁余腾斐王丽洪斌
王丽非,朱元军,王松梅,杜郁,余腾斐,王丽,洪斌
干扰素(interferon,IFN)是一种具有广谱抗病毒、抗肿瘤和免疫调节等活性的细胞因子,能通过多种机制影响肿瘤细胞功能,促进免疫细胞的活性[1]。干扰素是一个大的基因家族,可分为3 型,主要包括 IFNα、IFNβ 和 IFNγ[2]。IFNβ 主要用于病毒性疾病、恶性肿瘤和自身免疫性疾病的治疗[3]。1993年,美国 FDA 批准了 Chiron 公司生产的IFNβ-1b 上市销售,其商品名为Betaseron,用于治疗多发性硬化症、神经系统疾病。日本也批准了静脉注射的 IFNβ 用于治疗慢性乙型或丙型肝炎[4]。
尽管如干扰素、集落刺激因子等一些细胞因子已被开发成蛋白药物用于临床,但作为科研用试剂的细胞因子的开发在我国几乎是一片空白,高价进口和受制于西方生物技术公司成为细胞因子来源的主要现状。本工作在国家科技支撑计划——“科研用细胞因子试剂平台的完善和应用研究”的支持下,采用高效的宿主系统和载体表达标签化细胞因子——组氨酸标签人 β 干扰素(HIS-IFNβ),实现了可溶性表达,并利用 Ni sepharose 亲和层析的方法,分离得到高纯度的 HIS-IFNβ,并进行了生物学活性的检测,为科研用标签化细胞因子试剂的研制奠定了基础。
1 材料与方法
1.1 主要材料与仪器
1.1.1 菌株、细胞株、病毒株和质粒 大肠杆菌E.coliTG1、E.coliBL21(DE3) 为本实验室保存;人羊膜细胞(Wish细胞)购自中国科学院上海细胞中心;水泡性口膜炎病毒(VSV)为本研究所保存;质粒载体 pGEM-T 购自美国 Promega 公司;质粒载体 pET-16b 购自美国 Novogen 公司。
1.1.2 培养基 大肠杆菌培养基 LB 的配制参见分子克隆操作指南[5];氨苄青霉素在 LB 培养基中使用浓度为100 μg/ml;Wish 细胞所用 MEM 培养基购自美国 Thermo scientific 公司。
1.1.3 工具酶和生化试剂 限制性内切酶、T4 DNA 连接酶等均购自日本 TaKaRa 公司;PfuDNA 聚合酶购自上海生物工程公司。TA 克隆试剂盒,购自美国 Promega 公司;UNIQ-10 柱式 DNA胶回收试剂盒,购自上海生物工程公司。人 β 干扰素抗体和组氨酸标签抗体购自美国 R&D 公司;人 β 干扰素标准品购自中国药品生物制品检定所。
1.1.4 仪器 miniCycleTMPTC-200 型 PCR 仪为美国 MJ Research 公司产品;SEMI-DRY TRANSFER 转膜仪为美国 Bio-Rad 公司产品;ÄKTA Explorer 系统为美国 GE Healthcare 公司产品;SHIMADZU-20A 型高效液相色谱仪为日本岛津公司产品;C8 反相柱 ZORBAX 300SB-C8为美国 Agilent 公司产品。
1.2 方法
1.2.1 人 β 干扰素与组氨酸标签融合蛋白重组表达菌株的构建 PCR 扩增、DNA 电泳及片段回收、大肠杆菌质粒提取和转化、质粒酶切和连接等DNA 基本操作参见分子克隆操作指南[5]。提取人Bel-7402 细胞总 DNA 作为PCR 扩增的模板,设计一对引物(5’ TCCATATGATGAGCTACAACTTG CTTGG 3’ 和 5’ CGGGATCCTTAGTTTCGGAGGT AACCTGTAAG 3’),采用Pfu高保真 DNA 聚合酶进行 PCR 扩增。为确证 PCR 扩增得到的片段为正确的相关基因,将 PCR 产物电泳后进行胶回收纯化,3’ 端加 A,克隆到 pGEM-T 载体上,得到重组质粒 pGEM-IFNβ。将重组质粒转化至E.coliTG1 感受态细胞,挑取白斑,提取其中的重组质粒进行NdeI 和BamHI 双酶切鉴定。鉴定正确后,琼脂糖凝胶电泳回收NdeI 和BamHI 双酶切片段和同样经过上述酶切回收的载体 pET-16b 进行连接,转化E.coliTG1,在含有 Amp 100 μg/ml的 LB 琼脂平板上挑选转化子。转化子提质粒进行酶切鉴定,鉴定正确的重组表达质粒命名为pET16b-IFNβ。将重组表达质粒转化E.coliBL21(DE3) 感受态细胞,获得重组表达菌株E.coliBL21(DE3)/pET16b-IFNβ。
1.2.2 组氨酸标签人 β 干扰素在大肠杆菌中表达条件的摸索 为了使重组蛋白在细胞裂解液上清中表达量最大化,本工作进一步优化了重组菌株表达的 IPTG 诱导时间、浓度和温度。将菌株E.coliBL21(DE3)/pET16b-IFNβ 接种于 5 ml LB培养基,37℃培养过夜,取 1 ml上述菌液,转种50 ml LB 培养基 37℃培养,待菌液 OD600约为0.6~1.0 时,以不同浓度的 IPTG 诱导 8 h,取1 ml 菌液收集菌体,进行聚丙烯酰胺凝胶(SDS-PAGE)电泳分析。取上述 OD600约为0.6~1.0 时的菌液,在 0.08mmol/L IPTG 诱导条件下37℃分别培养 1、2、3、5、6、7、8 h,取 1 ml 菌液收集菌体,进行 SDS-PAGE 分析。取上述 OD600约为0.6~1.0 时的菌液,在 0.08mmol/L IPTG诱导条件下分别在 37℃和 28℃培养 6 h,取1 ml 菌液收集菌体,破碎细胞,分别取上清、沉淀进行 SDS-PAGE 分析。
1.2.3 Western blotting 分析 取菌株E.coliBL21(DE3)/pET16b-IFNβ 发酵液,收集菌体,破碎细胞,取上清进行 SDS-PAGE 后,取出凝胶放置于转膜缓冲液中,用 Bio-Rad semi-dry transfer转膜仪进行蛋白印迹转移,根据凝胶面积按0.65 mA/cm2电转移至 PVDF 膜。转膜完毕后,将膜用丽春红 S 溶液浸泡 5min,再用水漂洗脱色,以确认目标条带是否成功转移到 PVDF 膜上。然后将膜放入杂交袋,加入含 5%脱脂牛奶的 TBS,4℃封闭过夜。弃封闭液,加入用 5%脱脂牛奶稀释(1∶1000)的一抗(人 β 干扰素抗体或抗His-tag 抗体),室温缓慢振荡 2 h。弃抗体,将膜以 TBS 漂洗 3 次,每次 5min,加入用 5%脱脂牛奶稀释(1∶1000)的碱性磷酸酶标记的马抗小鼠 IgG(H+L) 作为二抗,室温缓慢振荡 2 h。将膜放于 TBS 液中漂洗 3 次,每次 5min 后,膜置于碱性磷酸酶显色底物 NBT/BCIP 溶液中,室温显色至特异性杂交条带出现,将膜取出放置于去离子水中终止显色。
1.2.4 组氨酸标签人 β 干扰素纯化 重组表达菌株在最适条件下进行培养,收集菌体,菌体用binding buffer 悬浮,置于冰浴中进行超声破碎,直至无明显菌体。10 000×g离心 10min,收集上清,0.45 μm 滤膜过滤备用。采用 ÄKTA Explorer 系统,将过滤后的样品上样至以 5 倍体积 binding buffer(0.02 mol/L Tris-HCl,0.5 mol/L NaCl,0.01 mol/L 咪唑,pH 8.0)平衡的 His Trap FF crude亲和柱,以 elution buffer(0.02 mol/L Tris-HCl,0.5 mol/L NaCl,0.25 mol/L 咪唑,pH 8.0)进行梯度洗脱,UV 280 nm 检测收集目的蛋白峰。将含有目的蛋白的洗脱液合并,充分透析后冷冻干燥存储。
1.2.5 高效液相分析重组蛋白纯度 将纯化的重组蛋白样品进行 HPLC 分析,采用岛津SHIMADZU-20A 仪器,C8 反相柱,流动相 A:20%乙腈,流动相 B:0.1%三氟乙酸(TFA),连续梯度洗脱,在 30min内乙腈浓度由 20%增至80%,流速为1 ml/min。记录产物峰面积,并计算表达产物的纯度。
1.2.6 人 β 干扰素生物学活性测定 参照 2005年版《中国药典》第三部附录中干扰素生物学活性测定法,依据细胞病变抑制法,将培养于含 10%小牛血清的 MEM 培养基中的 Wish 细胞生长24~48 h 时配成细胞浓度约为3×105个/ ml 的悬液,加到 96 孔细胞培养板上,每孔 100 μl。同时设立标准品对照。在含 5%CO2,37℃孵箱中培养 4~6 h 后,每孔加入 4 倍系列稀释的干扰素样品 100 μl,样品稀释用含 7%小牛血清的 MEM培养液,37℃培养 18~24 h。弃上清后用含 3%小牛血清 MEM 培养基稀释 VSV 至 100 TCID50进行攻击,然后于含 5%CO2,37℃孵箱中培养24 h 左右。弃掉培养板中的上清液,每孔加入 50 μl的结晶紫液室温染色 30min,弃掉染液,用自来水冲洗残余的染液,用滤纸吸干后每孔加入 100 μl的脱色液脱色,在 Bio-Rad 自动酶标仪上于570 nm 波长处测定每孔的吸收值(OD),记录测定结果,将数据结果按照四参数回归计算法进行处理,以标准品为参考,并根据下列公式计算待测样品活性。

2 结果
2.1 人 β 干扰素与组氨酸标签融合蛋白重组表达载体的构建及表达菌株的获得
人 β 干扰素的编码序列存在于一个外显子上,提取人 Bel-7402 细胞总 DNA 作为PCR 扩增的模板进行扩增,得到预期大小的 PCR 产物(图1A)。PCR 产物进行序列测定,测序结果与GenBank 数据库进行 Blast 比对和分析,表明获得的片段序列与已知人 β 干扰素的基因序列完全一致。本工作采用质粒 pET-16b 作为表达载体,将人 β 干扰素基因克隆至载体组氨酸标签编码序列之后,可表达组氨酸标签与人 β 干扰素的融合蛋白。将人 β 干扰素基因片段克隆至载体 pET-16b,提取转化子质粒进行酶切鉴定,获得与 PCR 扩增的基因大小一致的片段(图1B),表明人 β 干扰素基因成功插入了 pET-16b 质粒。将获得的重组表达质粒命名为pET16b-IFNβ。将重组表达质粒转化E.coliBL21(DE3) 感受态细胞,获得重组表达菌株E.coliBL21(DE3)/pET16b-IFNβ。
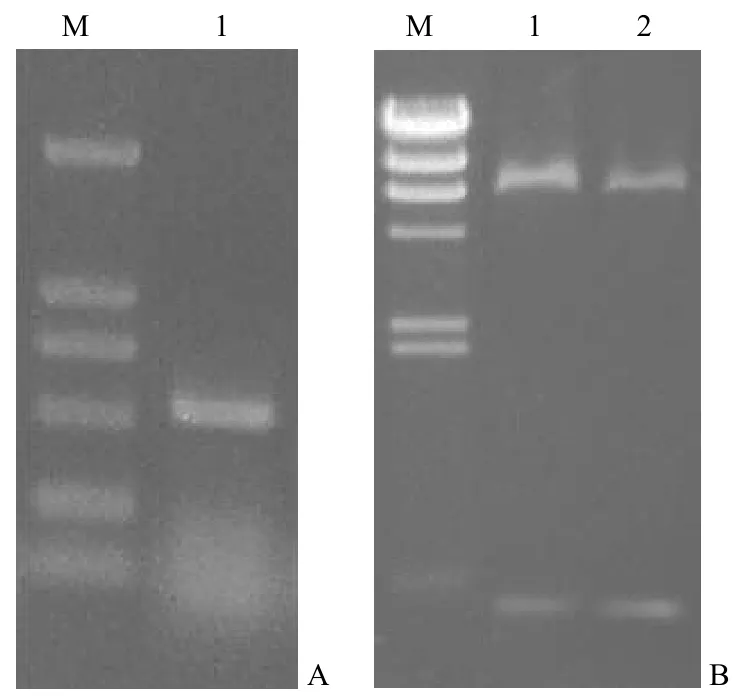
图1 IFNβ 的 PCR 扩增和 pET16b-IFNβ 的酶切验证Figure 1 PCR product of IFNβ and restriction enzymatic analysis of pET16b-IFNβ
2.2 组氨酸标签人 β 干扰素的表达
2.2.1 组氨酸标签人 β 干扰素表达的 IPTG 诱导浓度、时间和温度的摸索 以不同浓度的 IPTG诱导 8 h,SDS-PAGE 结果表明在 0.08mmol/L IPTG 诱导条件下表达量最高,增加 IPTG 诱导浓度表达量无明显增加(图2A)。在 0.08mmol/L IPTG 诱导条件下分别诱导不同时间,SDS-PAGE结果表明诱导 6 h 后,表达量已经达最大,以后没有明显增加(图2B)。分别在 37℃和 28℃培养下进行诱导表达,SDS-PAGE 结果表明在 28℃培养下,表达产物存在于细胞裂解液上清中更多(图2C)。最终确定最优表达条件为,0.08mmol/L IPTG 诱导下,28℃培养 6 h。
2.2.2 Western blotting 检测 表达的组氨酸标签人 β 干扰素蛋白分子量约为20 kD,N-端带有His-tag,分别用抗His-tag 抗体和人 β 干扰素特异性抗体进行 Western blotting 检测。在约 20 kD 处有一明显杂交条带(图3),表明该特异条带为组氨酸标签人 β 干扰素蛋白。
2.3 组氨酸标签人 β 干扰素蛋白的纯化
将组氨酸标签人 β 干扰素表达菌株E.coliBL21(DE3)/pET16b-IFNβ 在最适条件下发酵,采用HisTrap FF crude 亲和柱纯化,收集目的蛋白,梯度透析,冷干。每升发酵液可获得 28.2 mg 纯化后的组氨酸标签人 β 干扰素蛋白(图4)。将纯化的蛋白样品进行 HPLC 分析,检测其纯度,结果显示组氨酸标签人 β 干扰素的保留时间为11.5min,纯度为92%(图5)。
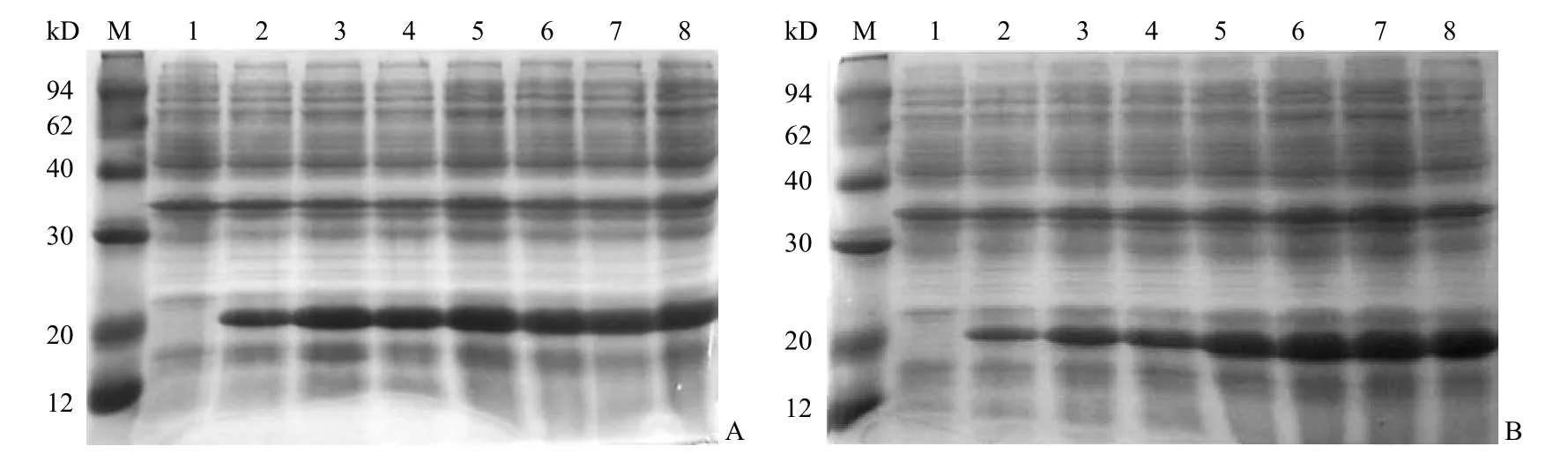

图2 HIS-IFNβ 在大肠杆菌 BL21(DE3) 中的表达Figure 2 The expression of HIS-IFNβ in E.coli BL21(DE3)

图3 Western blotting检测HIS-IFNβ的表达Figure 3 Western blotting analysis of the expression of HIS-IFNβ
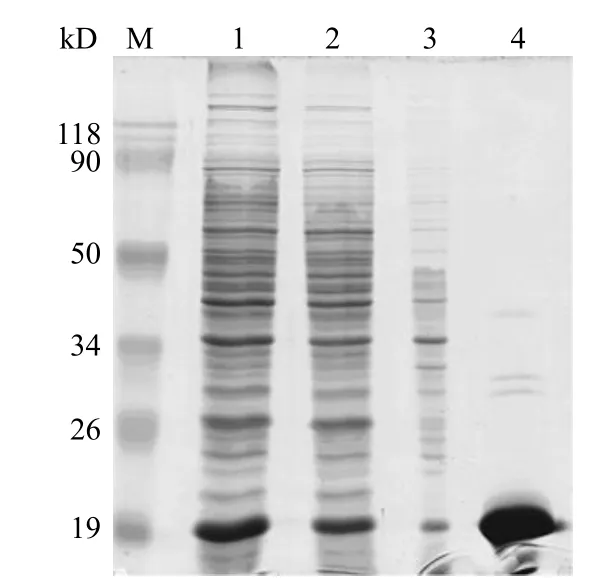
图4 HIS-IFNβ 蛋白的纯化Figure 4 Purification of HIS-IFNβ

图5 HPLC 检测 HIS-IFNβ 的纯度Figure 5 HPLC analysis of purified HIS-IFNβ
2.4 组氨酸标签人 β 干扰素蛋白生物学活性测定
参照 2005年版《中国药典》第三部附录中干扰素生物学活性测定法,结果经干扰素 β 国家标准品(2008 国生标字 0015)校正,确定其比活性为4.2×107U/mg。
3 讨论
作为科研用的细胞因子试剂,其应用领域主要为生命科学领域的遗传学、发育学、细胞学、免疫学、生物化学和分子生物学,基础医学与药学等,并包括了相应的应用性开发研究。为了增加科研用细胞因子试剂的示踪性、可检测性及其稳定性,进一步完善、拓展科研用细胞因子试剂的特性,扩展其用途,使其逐步向高端产品方向迈进,我们进行了标签化细胞因子(tag-细胞因子)试剂的研制,现已表达了多种标签化的细胞因子。标签化细胞因子不仅可方便细胞因子试剂本身的分离纯化,利用此功能,还可方便地进一步分离和研究其受体或与其相互作用的分子,可提高基础研究的效率和水平。同时,不仅其本身能作为普通的科研用细胞因子试剂,而且可作为研发临床诊断试剂的重要的中间核心物质,具有潜在的诊断试剂特性。
本工作采用大肠杆菌表达系统中常用的E.coliBL21(DE3),该宿主是以 T7 RNA 聚合酶为表达系统的高效外源基因的蛋白表达宿主。载体 pET-16b在大肠杆菌中可以快速而有效地表达重组蛋白,它利用 T7 启动子和终止子进行高效表达,并可在表达蛋白 N 端加上组氨酸标签,便于表达产物的纯化。而且在组氨酸标签后加上凝血酶 Xa 的酶切位点,便于纯化产物后将组氨酸标签切除,利于产物的后续处理。本工作结果表明在此系统中可成功表达带有组氨酸标签的人 β 干扰素,每升发酵液可获得 28.2 mg 纯化后的组氨酸标签人 β 干扰素蛋白。表达的融合蛋白既能与组氨酸标签抗体产生结合反应,又可与人 β 干扰素抗体产生结合反应。利用 Ni sepharose 亲和层析纯化,从大肠杆菌的上清中分离得到纯度 92%的细胞因子。干扰素生物学活性测定也表明,获得的组氨酸标签的人 β 干扰素具有人 β 干扰素生物学活性,比活性为4.2×107U/mg。本工作为进一步以此系统表达其他科研用标签化的细胞因子奠定了基础。
[1]Le Bon A, Tough DF.Links between innate and adaptive immunity via type I interferon.Curr Opin Immunol, 2002, 14(4):432-436.
[2]Liu XY.Interferon and its major breakthrough in Progress.China Prescription Drug, 2004(28):33-35.(in Chinese)刘新垣.干扰素研究及其重大突破性研究进展.中国处方药,2004(28):33-35.
[3]Li NL, Ma AL, Yu QW, et al.Expression of human beta-IFN using yeast Pichia pastoris- fermentation strategy optimization.China Biotechnol, 2004, 24(1):57-61.(in Chinese)李宁丽, 马安伦, 余奇温, 等.酵母菌表达倍菲隆发酵工艺研究.中国生物工程杂志, 2004, 24(1):57-61.
[4]Zhang Q, Lei JY, Ding YD, et al.Expression and purification of IFNβ-HSA fusion protein in Pichia pastoris.Chin J Biotechnol, 2009,25(11):1746-1752.(in Chinese)张琦, 雷楗勇, 丁月娣, 等.人 β干扰素与人血清白蛋白融合蛋白的表达及纯化.生物工程学报, 2009, 25(11):1746-1752.
[5]Sambrook J, Fritsch EF, Maniatis T.Molecular cloning: a laboratory manual.2nd ed.New York: Cold Spring Harbor Laboratory Press,1999.
