携带抗白细胞介素-2受体α单抗靶向超声微泡和对比超声结合评价肾缺血-再灌注损伤
2011-06-05吴凤林,纪丽景,罗利红等
靶向超声微泡与对比超声(contrast enhanced ultrasound, CEU)相结合能够有效评价肾缺血再灌注损伤(ischemia reperfusion injury, IRI)已经得到了证实,大多数研究是以内皮细胞上相关炎性分子为靶点[1]。肾IRI是肾移植排斥反应中重要的病理过程,研究方向除内皮细胞表面外,还应着重于淋巴细胞,因为肾移植排斥反应是以淋巴细胞活化并大量克隆增殖为特征的,但相关研究尚处于初步阶段。肾IRI发生时,能够非抗原性激活T淋巴细胞,从而使T淋巴细胞表面表达大量炎性因子受体[2,3]。南方医院超声科以T淋巴细胞表面携带抗白细胞介素-2受体α(IL-2Rα)为靶点,通过与对比超声相结合对肾进行评价,为研究肾移植后排斥反应提供了相关数据。
1 材料与方法
1.1 实验材料 昆明小鼠10只,体质量为25~30g,雄性,南方医科大学实验动物中心提供,合格证号:scxk(粤)2006-0015;二棕榈酰磷脂酰胆碱(DPPC,美国Sigma公司)、聚乙二醇(PEG,德国Applichem公司)、生物化脂质(DSPE-PEG2000-biotin,美国Avanti公司)、链亲和素(Streptavidin,美国Sigma公司)、抗小鼠IL-2Rα单克隆抗体(美国RD公司)、EnVision免疫组织化学显色系统(丹麦Dako公司)、Sequoia 512超声心动图仪(德国Siemens公司)。
1.2 制备超声微泡 参照文献[4],以上述脂质材料为原料制备普通脂质微泡和生物素化脂质微泡。生物素化微泡按一定比例加入链亲和素后再分别加入抗小鼠IL-2Rα单抗和同型对照抗体,制备出靶向超声微泡(MBIL-2Rα)和同型对照微泡(MB)。
1.3 体外评价超声微泡 构建出MBIL-2Rα和MB后,以库尔特计数仪测定微泡的浓度(%)及平均粒径(μm);采用绿色荧光标记的二抗与MBIL-2Rα相结合,荧光显微镜下观察抗IL-2Rα单抗与微泡连接情况。
1.4 建立肾IRI模型 对所有小鼠采用戊巴比妥钠(50mg/kg)腹腔注射麻醉;将小鼠俯卧位,固定四肢于鼠板上;尾静脉插留置针用于注射微泡。备皮后在脊柱左侧0.5cm处行2.0cm左右纵形切口,游离左肾;用无损伤动脉夹夹闭肾蒂,造成左肾缺血;50min后释放动脉夹,逐层缝合切口。
1.5 肾对比超声检查 再灌注24h后,对实验小鼠行对比超声检查(CEU),并根据注射超声微泡的不同分为靶向超声微泡组(MBIL-2Rα)和对照超声微泡组(MB)。实验小鼠取俯卧位,用支架固定Sequoia512超声机(德国Siemens公司)的高频超声探头(17L5)于小鼠肾上方,调整探头位置获得良好肾显像;实验中探头位置和仪器参数保持不变。CEU检查均采用相干脉冲序列成像技术(coherent pulse sequence, CPS)实时观察,探头发射频率为7.0MHz,机械指数为0.2。每只小鼠采用微量进样器经尾静脉随机先后注射(间隔30min)MB和MBIL-2Rα的数量约为1×108个。注入微泡5min后行CEU检查,获取第1帧图像,后继续存储图像23帧后给予高机械指数(mechenical index, MI)的连续超声发射2~3s以破坏微泡,继续存储本底图像2~3帧,全部声学造影图像存于CD盘,以备脱机分析。微泡破坏前存储图像的平均声强度(Video Intensity, VI)可代表靶向微泡在组织中的总浓度,包括黏附和循环微泡。微泡破坏后存储图像上的平均VI反应的是在血池中循环微泡的浓度。前者减去后者得到的是黏附微泡在组织中的浓度。取图结束后,应用CEU图像分析软件(美国Virginia大学)对图像进行分析,测量小鼠肾造影VI值,单位为灰阶强度(U);并用彩色编码技术制作肾显影的彩色编码图像,红色、橙色和白色依次代表肾显影的强度由弱到强。
1.6 肾病理学检查 CEU图像采集后取出小鼠肾,以4%甲醛固定。常规脱水,石蜡包埋制片。切片作苏木精-伊红(HE)染色和免疫免疫组织化学EnVision法染色。
1.7 统计学分析 使用SPSS 13.0统计分析软件进行统计学分析,组间比较采用二阶段交叉设计方差分析,组内比较采用配对t检验。P<0.05为差异有统计学意义。
2 结果
2.1 超声微泡体外评价 库尔特计数仪测得MBIL-2Rα浓度为(0.68±0.32)%×109个/ml,微泡平均粒径为2.70±0.24μm;MB浓度为(0.71±0.39)%×109个/ml,微泡平均粒径为2.87±0.24μm。与荧光二抗结合后的MBIL-2Rα在荧光显微镜下可见外壳显明显绿色荧光(图1A);MBIL-2Rα在普通光学显微镜可见微泡大小均一、中心透亮、外壳光滑完整(图1B)。
2.2 肾CEU彩色编码 第1帧CEU图像显示MBIL-2Rα组在左侧肾可见显著的超声显影增强(图2A)。而MB组左侧肾仅见轻度的超声显影增强,其显影强度较前者明显减弱(图2C);第1帧CEU图像显示MBIL-2Rα及MB在右侧肾均无明显的超声显影(图2B、D)。
2.3 肾对比超声VI分析 VI值在MBIL-2Rα组和MB组右侧肾均未见明显增大,分别为3.8±1.5U和3.7±1.7U,两者之间差异无统计学意义(P>0.05);而在左侧肾MBIL-2Rα组为21.6±4.8U较MB组9.7±2.9U明显增大,两者之间差异具有统计学意义(P<0.05)。MBIL-2Rα组左侧肾VI值为右侧肾的6.8±3.4倍,P<0.05,而MB组左侧肾VI值仅为右侧肾的3.1±1.9倍,P<0.05(图3)。
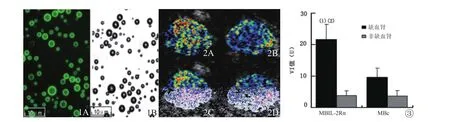
图1 A.MBIL-2Rα在荧光显微镜下可见外壳显明显绿色荧光;B.MBIL-2Rα在普通光学显微镜可见微泡大小均一,中心透亮,外壳光滑完整(×400)。图2 肾脏对比超声造影彩色编码图。A.MBIL-2Rα组在左肾可见显著的超声显影增强;B. MBIL-2Rα组在右肾无明显的超声显影增强;C.MB组左肾仅见轻度的超声显影增强,其显影强度较前者明显减弱;D. MB组在右肾无明显的超声显影。图3 MBIL-2Rα和MB组缺血肾(左肾)和非缺血肾(右肾)VI值比较:(1)与MBIL-2Rα比较,P<0.05;(2)与MB组比较,P<0.05
2.4 病理及免疫组织化学结果 HE 切片显示右侧非缺血肾组织中肾小管排列整齐,形态正常,间质无充血、水肿(图4);左侧缺血再灌注肾组织中可见肾小管上皮细胞肿胀、变性,内可见管型和坏死脱落细胞,伴肾间质水肿及淋巴细胞增多(图5)。免疫组织化学检查显示右侧非缺血肾组织未见明显淋巴细胞浸润,未见明显IL-2Rα表达(图6);左侧缺血再灌注肾组织淋巴细胞增多,淋巴细胞表面可见IL-2Rα表达(棕黄色阳性反应物,箭头示,图7)。
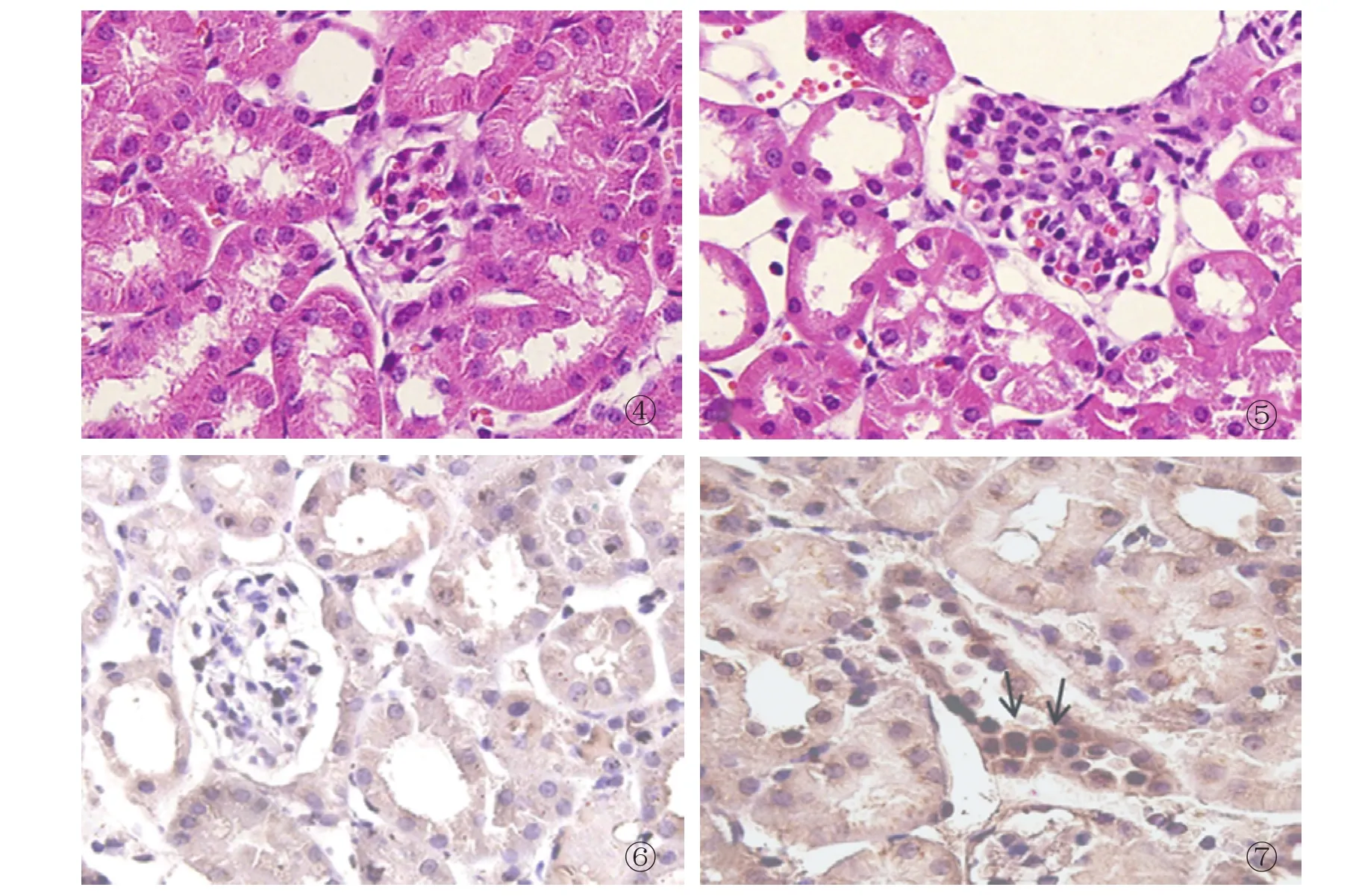
图4 ~7 病理学检查。图4 显示右侧非缺血肾组织中肾小管排列整齐,形态正常,间质无充血、水肿。图5 左侧缺血再灌注肾组织中可见肾小管上皮细胞肿胀、变性,内有管型和坏死脱落细胞,伴肾间质水肿及淋巴细胞增多(HE,×400)。图6 右侧非缺血肾组织未见明显淋巴细胞浸润,未见明显IL-2Rα表达。图7 左侧缺血再灌注肾组织淋巴细胞增多,淋巴细胞表面可见IL-2Rα表达(棕黄色阳性反应物,箭头示)( EnVisoon法,×400 )
3 讨论
肾缺血再灌注损伤(IRI)是肾移植过程中不可避免的损伤过程,也是引起急性肾功能衰竭的重要因素之一。近年,在靶向超声造影领域,肾IRI的相关炎性反应也成为研究热点,但通常只是作为一种普通的炎性反应来进行研究,且多数是以血管内皮细胞上的靶分子为靶点进行血管内成像[1]。但事实上有学者发现,免疫因素在肾IRI过程中可能发挥重要作用。一般来说,T淋巴细胞经典的活化途径是抗原依赖性活化,但是在肾IRI中没有“外来”抗原的刺激,肾IRI后仍有T淋巴细胞的激活、相应炎性分子及分子受体等的上调[2,3]。根据这一理论,本实验直接构建肾IRI模型,模拟肾移植过程中的免疫炎性反应,不仅减少了小动物肾移植模型构建的繁琐过程,同时也降低了抗体等的用量。同时,因为IL-2在移植排斥反应中发挥着重要作用[5],而以其受体作为靶点,能够从侧面反应IL-2表达量的多少,从而对移植排斥反应做出评价。因此,不同以往,南方医院超声科尝试利用T淋巴细胞表面的IL-2Rα为靶点,对肾IRI的炎性反应进行评价。
肾IRI的对比超声造影结果显示:MBIL-2Rα组左肾产生显著的“主动性靶向超声分子显影”[6],且显影强度同右肾及MB组相比显著增强。研究还显示,MB组左肾VI值也有一定程度升高,提示在此区域也有一定程度的微泡滞留。其可能机制是在IRI过程中,脂质微泡可通过血清补体介导的调节作用与激活的白细胞结合并黏附于组织的小静脉内皮细胞上;而且激活的单核-巨噬细胞和中性粒细胞可通过表面的巨噬细胞抗原复合体-1(Mac-1)或补体受体的介导对脂质微泡产生“非免疫球蛋白依赖的吞噬作用”,从而在行对比超声显影检查时可产生一定程度的“被动性靶向对比超声显影”[7]。
应该提出的是,由于本实验所选择的靶点与以往不同,位于淋巴细胞表面,MBIL-2Rα在靶向黏附的过程中所伴随的是淋巴细胞不断地滚动甚至向间质组织的移行、迁出,因此,我们所应用的MBIL-2Rα的剂量同以往相比有所增高,试图提高MBIL-2Rα的靶向黏附概率。尽管我们对MBIL-2Rα组被动显影和主动显影没有做进一步的区分,但同MB组相比,MBIL-2Rα组的显影强度明显增强,病理改变明显,也提示检测敏感度更强。
总之,本实验结果主要提供了一种可能性,即是以淋巴细胞表面分子为靶点进行超声显影同样能够实现,同时也为进一步对肾移植排斥免疫反应进行评价提供了理论基础。
[1]陈少敏, 杨 莉, 宾建平, 等. 携带抗P-选择素单抗靶向微泡行对比超声评价肾缺血再灌注损伤的实验研究. 中国医学影像技术, 2008, 24(7): 985-987.
[2]salahudeen AK, Haider N, May W. Cold ischemia and the reduced long term survival of cadaveric renal allografts.Kidney Int, 2004, 65(2):713-718.
[3]Melissa J, Burne-Taney, Naoko Yokata, et al. Persistent renal and extrarenal immune changes after severe ischemic injury.Kidney Int, 2005, 67(3):1002-1009.
[4]郑道文, 杨 莉, 宾建平, 等. 亲和素桥连构建携抗P-选择素单抗靶向超声微泡及体外荧光鉴定. 中国医学影像技术, 2008, 24 (8 ): 1182-1185.
[5]杨振林, 秦玉峰. IL-2受体α单克隆抗体的研究进展.国外医学·移植与血液净化分册, 2004, 2(3):11-13.
[6]纪丽景, 杨莉, 吴爵非, 等. P-选择素靶向超声微泡与普通超声微泡黏附途径和效能的对比研究.临床超声医学杂志, 2009, 11(5):289-292.
[7]Lindner JR, Coggins MP, Kaul S, et al. Microbubble persistence in the microcirculation during ischemia/reperfusion and inflammation is caused by integrin- and complementmediated adherence to activated leukocytes. Circulation,2000, 101(6):668-675.
