乳腺非肿块性浸润性导管癌的MRI诊断
2011-06-05龚良庚,程流泉
乳腺浸润性导管癌是浸润性乳腺癌中最常见的一种类型,根据强化方式可分为肿块性和非肿块性强化,肿块性浸润性导管癌临床诊断并不难[1]。非肿块性的浸润性导管癌组织中间隔正常的乳腺组织,缺乏典型的浸润性乳腺癌的MRI影像特征,临床诊断困难。本研究回顾性分析经病理证实的27例非肿块性浸润性导管癌患者的MRI影像资料,以提高乳腺非肿块性浸润性导管癌的MRI诊断水平。
1 资料与方法
1.1 一般资料 收集2008-07~2010-03在解放军总医院经手术或穿刺后病理证实的非肿块性浸润性乳腺癌的女性患者27例,年龄27~74岁,平均46岁。所有患者在取得病理前均行MRI常规扫描、DWI及动态增强扫描。
1.2 仪器与方法 MRI扫描使用GE 1.5T双梯度磁共振机(signa excite HD twin),4通道乳腺专用线圈。患者取俯卧位,双乳自然悬垂。常规扫描SE T1WI(TR 500ms,TE 8.3ms, 层 厚 4.0mm, 间 隔 1.0mm)、FSET2WI脂肪抑制(TR 4 660ms,TE 89ms,层厚4.0mm,间隔1.0mm),DWI(TR 8 400ms,TE 73.2ms,b 值 1 000s/mm2,层厚4.0mm,无间隔)。动态增强扫描采用3D-FSPGR序列(VIBRANT),TR 4.8ms,TE 2.3ms,层厚1.2~1.6mm,无间隔扫描,矩阵384×352。分6个时相采集图像,每个时相扫描时间120s,从第二个时相扫描开始,按照0.2mmol/kg静脉团注Gd-DTPA(德国拜耳先灵医药公司,商品名:马根维显),注射速度为2ml/s。全部扫描总用时19min 9s。
1.3 图像后处理方法 利用工作站(workstation 4.3)的Function Tool软件进行DWI及动态增强后处理,分别生成ADC图和增强时间-信号曲线(time-signal intensity curve, TIC),部分病例进行减影处理以便更好地观察强化情况。在ADC图上的病灶范围(对应于强化区病灶)内放置不少于5个像素的3~5个感兴趣区(region of interest,ROI),取平均ADC值作为结果。在病灶强化最快速的部分和廓清最快的部分,或者最怀疑恶性病灶的部分放置2~3个ROI,并观察TIC的类型。按美国放射学会乳腺影像报告与数据系统(ACR BI-RADS-MRI)[1]将TIC分为持续型(Ⅰ型)、平台型(Ⅱ型)和廓清型(Ⅲ型)3种。为了更好地观察病灶的强化,对部分腺体型乳腺或混合型乳腺病例将增强后的图像与增强前预扫图像进行配准减影。
2 结果
27例均经手术病理证实为乳腺浸润性导管癌。24例术前BI-RADS-MRI分级为Ⅴ级,3例病灶术前诊断为Ⅳ级。27例均可见乳腺结构紊乱,8例见乳腺导管牵拉、聚集扩张改变。5例伴有乳头凹陷或相邻Cooper韧带及皮肤增厚。9例同侧腋下淋巴结肿大。
2.1 MRI常规扫描 T1WI呈低信号3例,等信号22例,稍高信号2例;T2WI呈高信号18例,等或稍低信号9例,27例均表现为不均匀信号。DWI呈等信号者4例,高信号23例。ADC值(0.78~1.35)×10-3mm2/s,平均(1.15±0.21)×10-3mm2/s(图 1、2)。
2.2 Gd-DTPA动态增强扫描 27例均呈不均匀强化,其中11例可见有簇集状强化(其中2例病灶内见小环状强化),5例可见线样或导管样强化,3例既有导管样强化又有簇集状强化。根据强化范围显示病灶分布呈节段性17例(占63%),区域性或多区域性分布8例(占30%),2例呈弥漫性分布,内部见少许导管样强化。TIC曲线呈平台型(Ⅱ型)8例(图1E),廓清型(Ⅲ型)19例(图2C)。14例见患侧乳腺有明显粗大的动脉血管显影(图2E)。
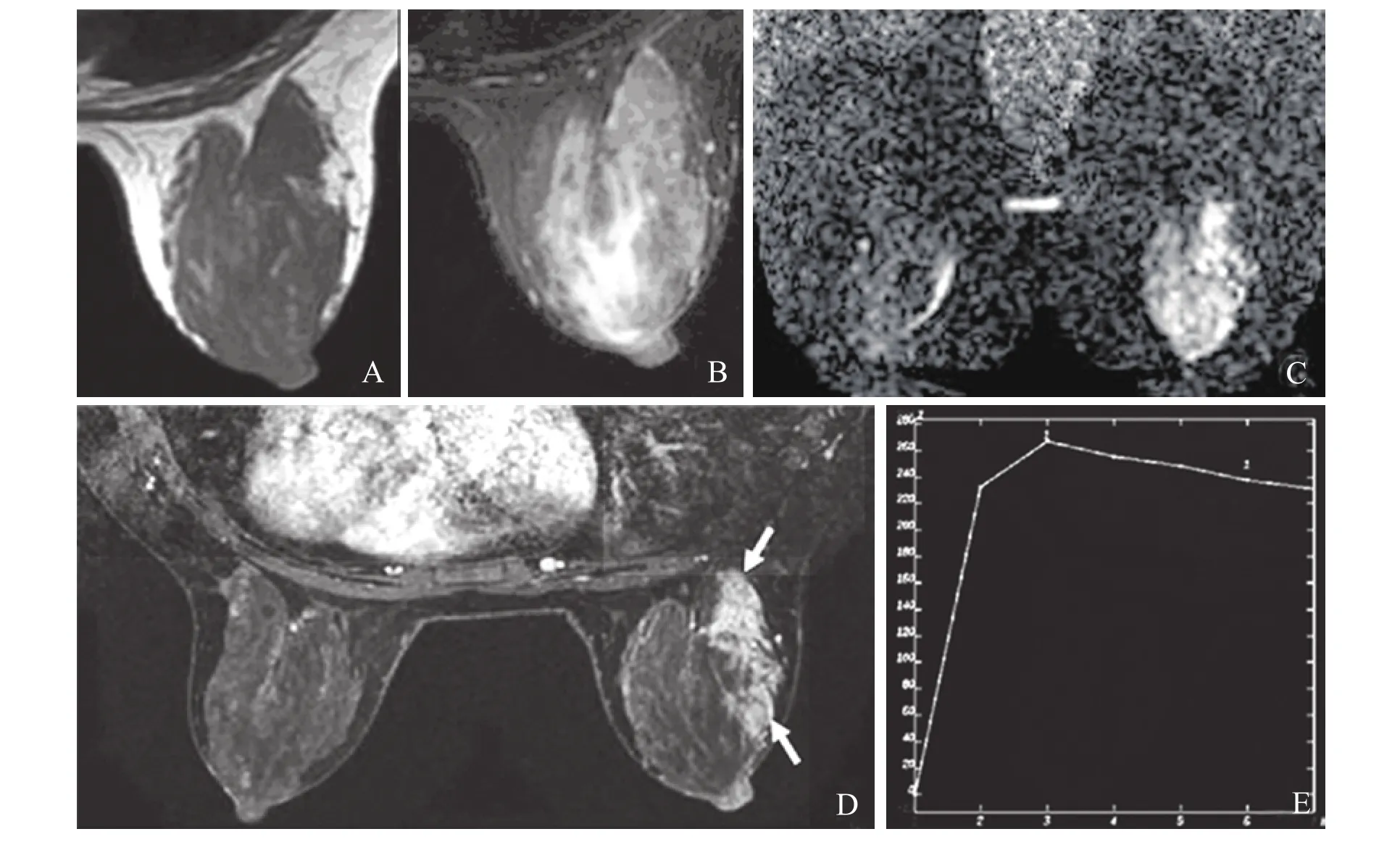
图1 患者,女性,45岁,右乳肿块5个月。A.病灶在T1WI呈等信号;B.T2WI呈稍高信号,病变范围难以确认;C.病变侧DWI呈不均匀高信号,ADC值(0.92~1.18)×10-3 mm2/s;D.动态增强扫描病变区呈非肿块样强化,内部见导管样线状强化,呈节段性分布(箭头示);E.病变区TIC曲线呈Ⅱ型。病理诊断为浸润性导管癌,内见高级别导管癌
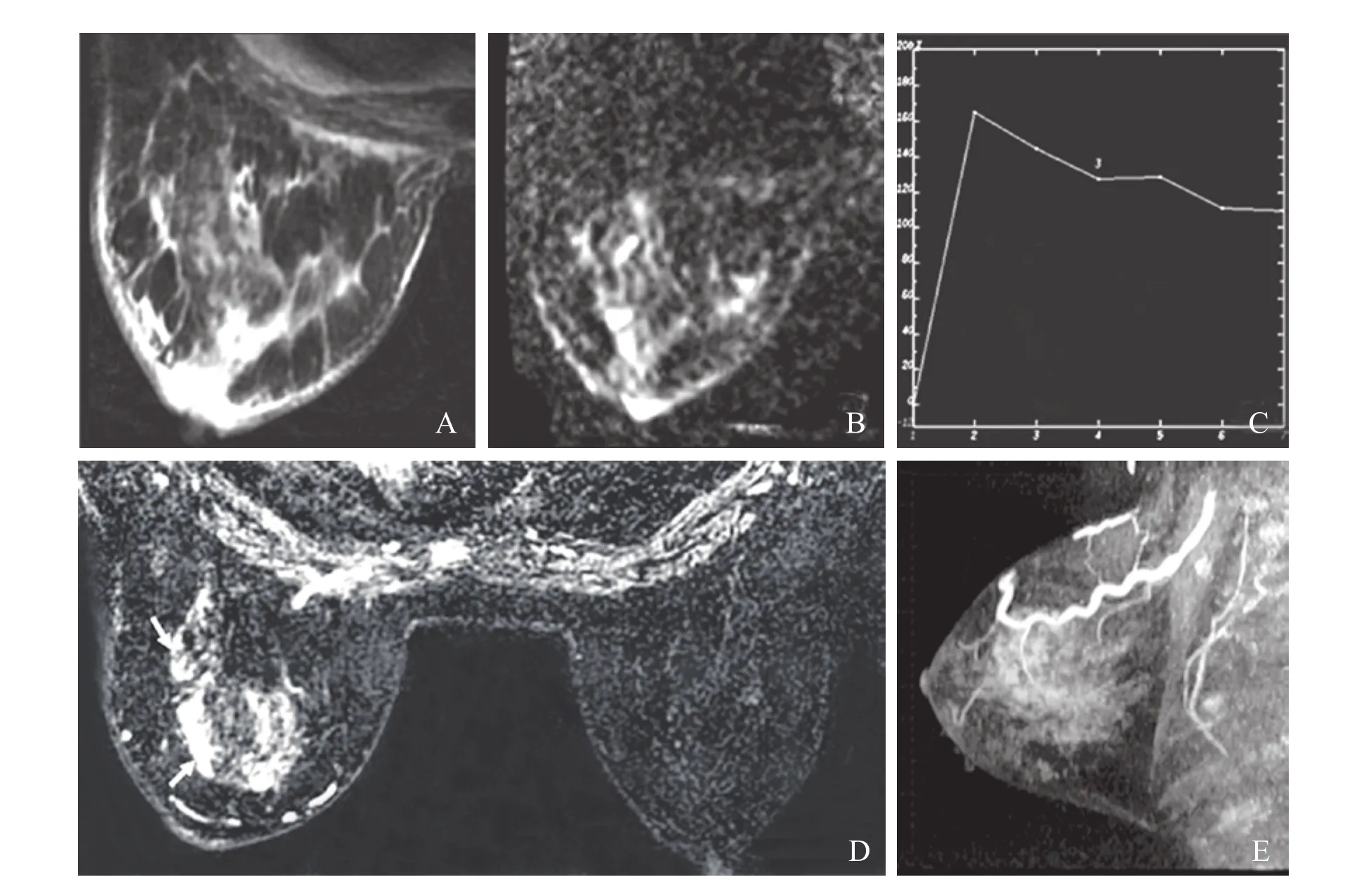
图2 患者,女性,55岁,触及左乳包块3个月。A.病变区域正常结构紊乱,T2WI呈片状不均匀稍高信号;B.DWI呈不均匀高信号,ADC值(0.88~1.26)×10-3 mm2/s;C.TIC曲线呈Ⅲ型;D.动态增强扫描病变区呈非肿块样强化,内部强化极不均匀(箭头示),对侧乳腺内未见异常强化;E.矢状面MIP重建显示病变乳腺见粗大的血管影。病理诊断为浸润性导管癌
3 讨论
乳腺非肿块性病变除见于浸润性乳腺癌外,也常见于乳腺腺病、乳腺导管周围炎或急性乳腺炎等良性疾病,除急性乳腺炎有特征性的临床表现外,其他病变的临床症状均无明显特征性。有效地鉴别诊断良、恶性病变可直接影响患者治疗方案的选择甚至预后。
本研究对非肿块状乳腺病变的纳入标准参考BI-RADS-MRI描述非肿块病变的定义[2],但鉴于导管状强化及线状强化与病灶的分布范围无明确对应关系,因此在本组资料中将上述两种表现作为病灶内部强化特点来描述。病灶分布以节段性为主,其次为区域性或多区域性分布,而呈弥漫性分布少见。Liberman等[3]认为导管样分布或节段性分布的病变可能为导管内癌、浸润性导管癌、不典型导管增生、乳头状瘤或硬化性腺病,结果相互吻合。文献报道簇状环形、导管样及簇状强化的非肿块病变均应评估为BI-RADS Ⅳ级而行活检[4],本组病灶中线样、导管样及簇集状强化占70%(19/27),也提示非肿块性浸润性导管癌,导管样或簇集状强化都是恶性肿瘤的特点。
TIC动态变化的影像学基础是通过测量ROI选定区域的对比剂流量变化造成信号强度的动态变化生成的随时间变化的信号-强度变化曲线。肿瘤细胞代谢旺盛,血流量增加也明显,在TIC上即表现为快速流入快速廓清的Ⅲ型曲线,而低级别的肿瘤相对新陈代谢较小或动静脉瘘较少,表现为快速流入和缓慢流出的Ⅱ型曲线。Veltman等[5]认为,如果病变早期呈快速或中速增强而延迟期呈平台型或廓清型,应高度怀疑为恶性,廓清型曲线的恶性可能性为87%。本组中TIC以Ⅱ、Ⅲ型曲线为主,其中Ⅲ型曲线占70%(19/27),本组中有14例显示增粗的血管影,也从另外一个方面证明了肿瘤血供增多。也有恶性肿瘤表现为Ⅰ型曲线的报道[1]。本组中只有2例出现小环形强化,反映非肿块性浸润性导管癌的生长方式是弥漫性浸润性生长,肿块并不容易发生坏死。非肿块性浸润性导管癌由于癌组织生长广泛,不形成明显的较大肿块,因此不容易发生坏死,是非肿块性浸润性导管癌的一个特点。
DWI从分子水平上反映了人体组织的空间组成信息和病理生理状态下组织中水分子扩散能力的变化。本组资料中,ADC图像上23例(85%)呈高信号,平均ADC值为(1.15±0.21)×10-3mm2/s,反映了癌组织内细胞密度较大,细胞核大而胞浆少,导致水分子扩散受限的病理特点。浸润性导管癌的ADC值一般比其他恶性肿瘤更低,因为细胞密度更大,抑制了水分子的表面扩散能力[6,7]。由于肿瘤对周围结构不均衡的浸润性生长方式,导致病变区的组织结构混杂,DWI信号出现不均匀的现象,肿瘤的坏死囊变及出血等也是DWI信号不均匀的重要原因。笔者认为在测量ADC值时,应该尽量避开囊变、出血区,同时,病灶DWI内部信号不均匀时,应多点测量并取平均值,以减少病灶总体ADC值测量的偏差。
常规MRI扫描T1WI及T2WI的信号强度在乳腺癌中的诊断无明显特异性,多呈等T1稍长T2信号,两者的比率分别为81%(22/27)和67%(18/27)。27例均可见乳腺结构紊乱,8例见乳腺导管牵拉、聚集扩张改变。5例伴有乳头凹陷或相邻Cooper韧带及皮肤增厚。9例同侧腋下淋巴结肿大。但这些都不是浸润性导管癌的特征性改变。因此笔者认为,单纯以常规MRI平扫的信号特点进行定位和定性诊断都是不可取的。T1WI和T2WI的作用主要是判断病灶中是否有囊变、坏死或出血等病理改变,以及对乳腺皮肤、韧带及胸大肌等邻近结构是否浸润进行评价。
文献报道MR诊断浸润性导管癌的敏感性高达93%~100%[8~10],Tozaki等[11]对30个非肿块性病变进行评估,乳腺癌的阳性预测值高达94%。但是乳腺癌诊断的整体特异性并不高[12],少数不典型病变仍然存在误诊或漏诊的可能,分化好的、非肿块性、直径<1cm的乳腺癌术前MRI容易漏诊;形成肿块的慢性炎症、血供丰富的导管内乳头状瘤、纤维腺瘤及表现复杂多样的腺病容易误诊为恶性[10]。本组中3例因为综合MRI征象没有充分诊断为Ⅴ级病变的证据,将病变归为Ⅳ级。虽然术前诊断提示不能除外恶性病变的可能,但此类病变的鉴别诊断仍需要关注。良、恶性病变的ADC值、增强曲线的类型均有交叉现象。
综上所述,MRI是诊断和评价乳腺癌的重要手段,以节段性分布、较低的ADC值及Ⅲ型TIC曲线诊断价值最大。综合MRI的影像表现,可以有效地诊断并准确地评估非肿块性浸润性乳腺癌的范围、周围结构的变化及腋窝淋巴结转移等。
[1]范晓彧, 杨军.乳腺浸润性导管癌的MRI诊断.放射学实践, 2010, 25(1): 59-62.
[2]Tozaki M, Igarashi T, Fukuda K. Positive and negative predictive values of BI-RADS-MRI descriptors for focal breast masses. Magn Reson Med Sci, 2006, 5(1): 7-15.
[3]Liberman L, Morris EA, Dershaw DD, et al. Ductal enhancement on MR imaging of the breast. Am J Roentgenol, 2003, 181(2): 519-525.
[4]Sakamoto N, Tozaki M, Higa K, et al. Categorization of non-mass like breast lesions detected by MRI. Breast Cancer, 2008, 15(3): 241-246.
[5]Veltman J, Stoutjesdijk M, Mann R, et al. Contrastenhanced magnetic resonance imaging of the breast: the value of pharmacokinetic parameters derived from fast dynamic imaging during initial enhancement in classifying lesions. Eur Radial, 2008, 18(6): 1123-1133.
[6]Savannah C, Wendy B, Brenda F, et al. Quantitative diffusion-weighted imaging as an adjunct to conventional breast MRI for improved positive predictive value. Am J Roentgenol, 2009, 193(6): 1716-1722.
[7]Partridge SC, McKinnon GC, Henry RG, et al. Menstrual cycle variation of apparent diffusion coefficients measured in the normal breast using MRI. J Magn Reson Imaging,2001, 14(4): 433-438.
[8]刘小娟,翟仁友,蒋涛,等. MR重T2W首次通过灌注成像鉴别乳腺良恶性肿瘤的价值初探.中华放射学杂志,2004, 38(3): 277-281.
[9]李明山,周玉荣,王丽,等. 3D T1WI动态增强成像诊断乳腺良恶性病变的价值.中国临床医学影像杂志,2005,16(5): 256-259.
[10]张静, 蔡幼铨, 程流泉, 等. 乳腺MR误诊病例的影像学表现与病理的对照分析.中国医学影像学杂志, 2009,17(3): 193-197.
[11]Tozaki M, Fukuda K. High-spatial-resolution MRI of nonmass like breast lesions: interpretation model based on BIRADS MRI descriptors. AJR Am J Roentgenol,2006, 187(2): 330-337.
[12]Goto M, Ito H, Akazawa K, et al. Diagnosis of breast tumors by contrast-enhanced MR imaging: comparison between the diagnostic performance of dynamic enhancement patterns and morphologic features. J Magn Reson Imaging, 2007, 25(1): 104-112.
