地沟油中胆固醇的LC/MS/MS定性定量检测
2011-06-02余雯静沈崇玉
余雯静,郑 利,沈崇玉
(1.苏州出入境检验检疫局,苏州 215104;2.江苏出入境检验检疫局,南京 210001)
胆固醇、电导率、多环芳烃以及特定基因组成可用于地沟油的识别鉴定,这是因为真正的植物油中主要含有谷甾醇、豆甾醇、菜油甾醇等多种植物甾醇,不含或含有极少量的胆固醇,而相对比胆固醇多存在于动物油脂中。所以检测过程中遇到油样中的胆固醇含量高出预设的正常限值,即可高度怀疑该油脂可能为地沟油。但是结果的得出必需建立在确证化合物为胆固醇的基础上。植物油谷甾醇、豆甾醇、菜油甾醇等植物甾醇在结构上均与胆固醇十分相似,单一依靠前处理很难将其完全分离。目前胆固醇的分析常采用液相色谱法[1-3]、气相色谱法[4]、荧光毛细分析法[5]、生化分析仪[6]、试剂盒[7]等,但是由于仪器的选择性和灵敏度的限制,无法实现精确定性、定量。随着研究的逐步深入,液质的逐步推广,采用三重四级杆质谱研究化合物越来越多。除此之外,有学者采用将QTRAP类型液质运行不同于三重四级杆的多种扫描模式,并进行谱库搜索对化合物进行确证[8-10]。本研究中采用液相色谱质谱联用仪的多反应监控(MRM)模式以及增强子离子扫描(EPI)模式得到胆固醇的二级质谱图,一次进样同时实现胆固醇的定性定量检测。
样品经皂化后提取胆固醇,经色谱柱分离后进入检测器。本实验参照“GB/T 22220—2008食品中胆固醇的测定-高效液相色谱法”的前处理方法以及液相色谱条件[11],通过添加基质后的样品模拟真实样品,建立标准曲线以及质控实验,完成方法的评价,利用AB SCIEX 4000 QTRAP质谱仪MRM-IDA-EPI扫描模式定性定量检测油样中胆固醇。实验过程中,筛查本市餐饮行业使用油中胆固醇的含量,旨在为有关监管部门辨别植物油中是否掺有地沟油提供一种准确而且迅速确证及定性方法。
1 材料与方法
1.1 材料与试剂
橄榄油、菜籽油、花生油、大豆油、花生调和油(市售)和煎炸老油以及地沟油;胆固醇标样(纯度≥99%),德国Sigma公司生产;正己烷(分析纯)、无水乙醇(分析纯)、KOH(分析纯)、氮气(≥99.9%)、磷酸(分析纯)、乙腈(分析纯)。
1.2 仪器与设备
AB SCIEX 4000 QTRAP LC/MS/MS质谱仪(AB SCIEX公司,配APCI离子源);Agilent 1200高效液相色谱仪(配自动进样器,Agilent公司);10~200 μL 移液枪(Thermo公司);100~1 000 μL移液枪(Thermo公司);电子分析天平(感量0.000 1 g,METTLER TOLEDO公司);高速高速离心机(湖南湘仪离心机有限公司);旋转蒸发仪;氮吹仪。
1.3 前处理方法
1.3.1 样品制备
取花生油50 mL,分别添加不同浓度胆固醇标准品,充分混合,混合后样品中胆固醇浓度为20 ng/mL、50 ng/mL、100 ng/mL、200 ng/mL、1 000 ng/mL(标记为验证品1~5号),以峰面积为纵坐标,胆固醇浓度为横坐标,绘制标准曲线建立标准曲线,其中以添加浓度为50 ng/mL和200 ng/mL油样作为对照品对方法进行质量控制。
1.3.2 样品前处理
称取油样3.0 g于250 mL平底烧瓶中,加入30 mL无水乙醇,10 mL60%氢氧化钾溶液,混和均匀。将试样在磁力搅拌加热电热套皂化回流1.5 h,温度控制在98~102℃,皂化结束后冷却至室温,用5 mL无水乙醇自冷凝管顶端冲洗其内部,即为皂化液。
1.3.3 提取
转移皂化液于250 mL梨形瓶中,用少量无水乙醇洗涤烧瓶内部并将洗涤液合并入梨形瓶中。在45℃旋蒸近干,加入100 mL提取液(石油醚∶乙醚;50∶50),在水浴中超声 30 min,提取液6 000 r/min离心,将上清液转移入500 mL分液漏斗,将剩余残渣用100 mL提取液超声提取30 min,离心,合并上清液于分液漏斗中,再用40 mL提取液超声提取10 min,离心后合并上清液于同一个分液漏斗中,用饱和NaCl水溶液洗涤分液漏斗中的有机相,直至中性。旋转蒸发至有机相接近蒸干,加入3 mL无水乙醇溶解瓶中残留物,10 000 r/min离心,收集上清液用甲醇稀释10倍即提取的胆固醇。每次取10 μL乙醇胆固醇溶液进样,进行检测。
1.4 仪器方法
液相条件:采用 Phenomenex Kinetex C18(100X4.6mm,5 um)液相色谱柱,流动相为VA(水)∶VB(甲醇)=5∶95 等度洗脱,柱温35 ℃,流速1.0 mL/min,进样体积10 μL。
仪器参数:离子源,Turbo V;电离模式,APCI;采集方式,MRM-IDA-EPI;气帘气,15;碰撞气,高;离子源温度,500 ℃;NC,2;GAS1,25;GAS2,15;DP,45IDA。参数:离子流预值,350 cps,不排除目标离子。EPI参数:DP,45 V;碰撞能量,20、30、40 eV;扫描范围,m/z 50~400。
2 结果与讨论
2.1 检验方法的确立
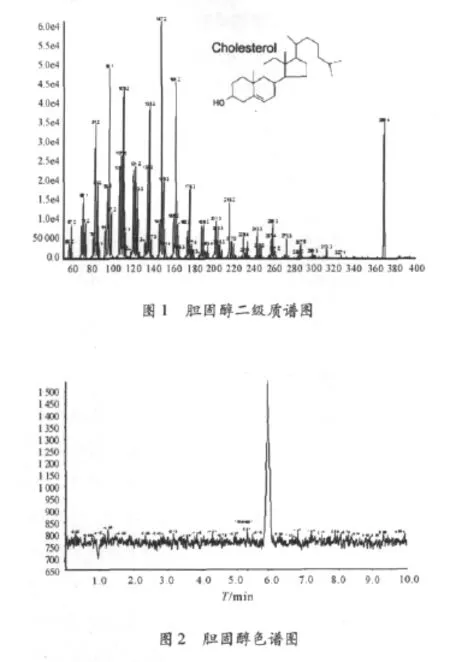
检验过程中,胆固醇的分子量为386.6,脱掉一个水分子后离子化[M-H2O]+,m/z为369.4。逐步增加碰撞能量得到对应的二级碎片,其中选择 m/z 161.2为定性离子,碰撞能量 CE30,m/z 147.3为定量离子,碰撞能量CE35。得到二级质谱图(见图1)。配合液相条件得到如图2的色谱图。
2.2 前处理方法验证
添加基质的验证品1~5号油样按照1.3节前处理方法中介绍步骤逐步实施,得到处理好的样品,经仪器采集数据,与未添加基质的标准品溶液对比,分别绘制标准曲线(见图3)。经验证方法回收率在82% ~93%,添加基质得到的标准曲线线性良好,线形相关系数R=0.994。

图3 添加基质得到的胆固醇标准曲线
2.3 前处理方法稳定性研究
以添加浓度为50 ng/mL和200 ng/mL油样作为对照品,每个浓度重复进样20次,按照信噪比(S/N)为10∶1得到方法的最小定量限(S/N按峰峰比计算)、相对标准偏差(CV%)以及准确度数据(见表1)。
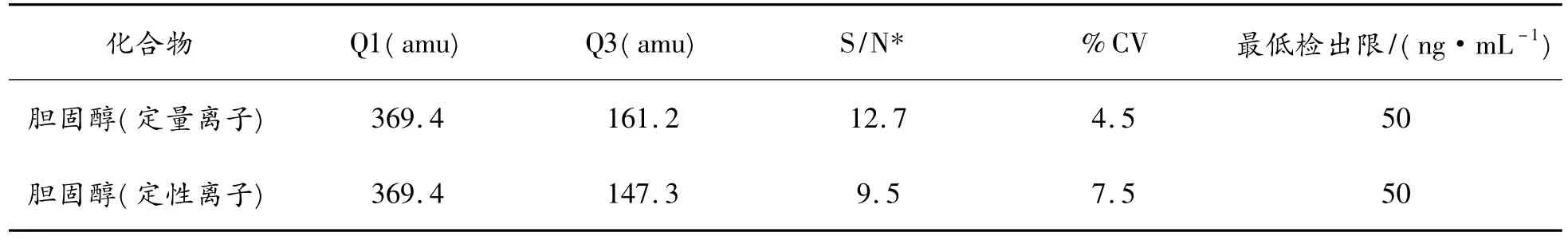
表1 方法稳定性数据
2.4 同时定量、定性检测
在胆固醇分析过程中,由于大量与其结构相似的物质的存在,传统MRM模式无法获得化合物的结构信息,并且由于缺少LC/MS/MS图谱库等原因,使样品检验过程中容易出现假阳性,导致检验结果可信度下降,所以仅以2对MRM离子难以确认化合物。在本研究中采用MRM-IDA-EPI模式在以2对MRM离子定量的同时,得到胆固醇的二级质谱图,通过与预先添加到谱库的标准品信息对比,进行质谱库的检索,其匹配度大于90%即可确认为胆固醇。
2.5 加标回收率与检测结果
选择市场所售不同品牌橄榄油、菜籽油、花生油、大豆油、花生调和油进行加标回收方法验证,其加标浓度分别50 ng/mL和200 ng/mL胆固醇的回收率均大于82%,这为准确检测地沟油提供了技术保障。研究过程中从市场抽取10家餐饮行业用油,评估其油中胆固醇含量,检验结果及添加胆固醇的好油的回收率数据见表2。
3 结束语
建立了用地沟油鉴别胆固醇的LC/MS/MS检测方法,其中添加基质的方法模拟真实样品验证胆固醇检测方法的准确度与精确度。在方法分析过程中,按照S/N为10∶1计算得到方法定量、定性分析的检出限50 ng/mL,同时用QTRAP的增强子离子扫描功能(EPI)添加胆固醇到质谱库,通过对检出限浓度的样品进行谱库检索,依据二级谱图的匹配度确立化合物的成分。方法的确立不仅为定量结果提供定性数据支持,同时从根本上解决了传统串联四极杆质谱对低浓度样品只能定量不能定性的问题,极大地提高了食品安全分析中结果的可靠性。
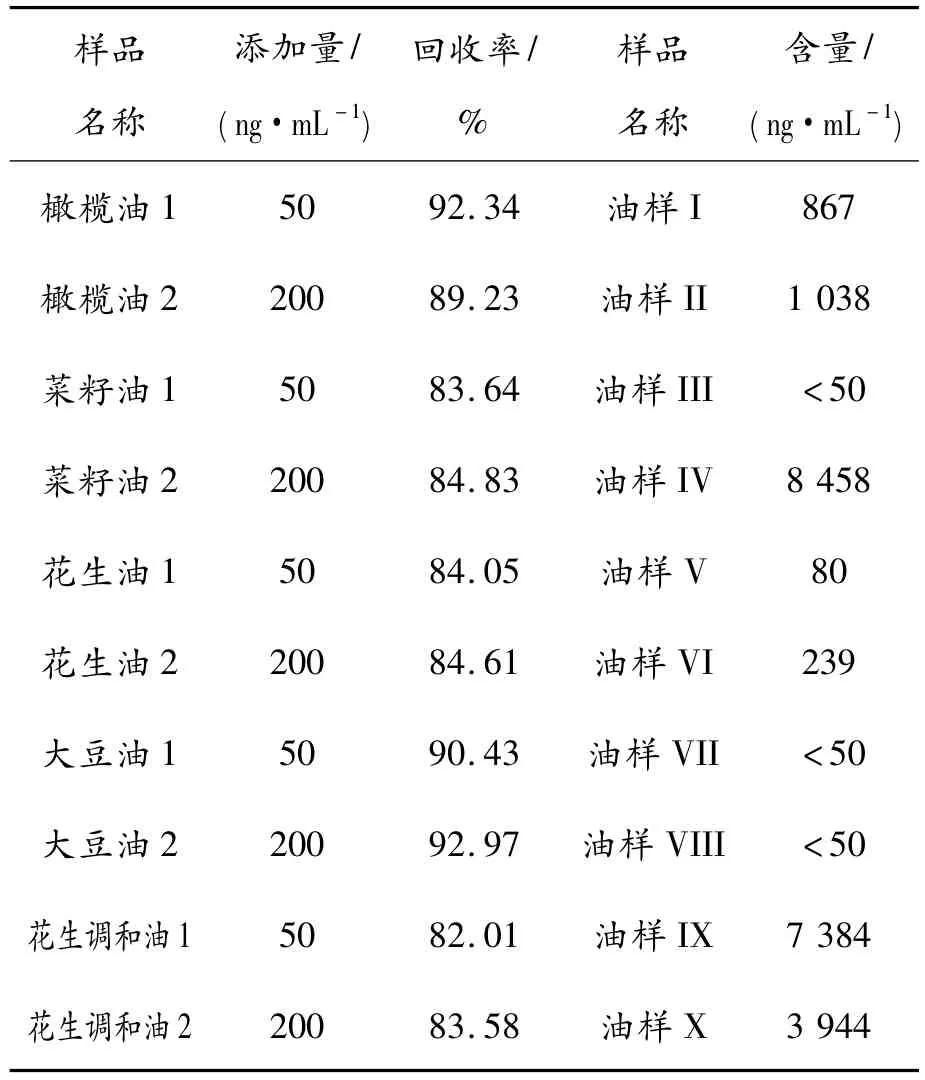
表2 添加胆固醇及回收率数据
[1]齐永秀,高允生,费洪荣,等.高效液相色谱法测定鸡蛋蛋黄中胆固醇含量[J].药物生物技术,2005,12(4):258-260.
[2]张蓉真,李珑,刘树滔,等.测定鸡蛋胆固醇的高效液相色谱新方法[J].色谱,1998,16(2):91 -94.
[3]郭涛,杜蕾蕾,万辉,等.高效液相色谱法测胆固醇含量鉴别地沟油[J].食品科学,2009,30(22):286-289.
[4]刘长建,姜波,安晓雯,等.气相色谱法测定发酵液中胆固醇含量[J].微生物学杂质,2009,29(6):97-99.
[5]杨海朋,王丙涛,陈仕国,等.荧光毛细分析法测定胆固醇[J].中国卫生检验杂志,2010,20(8):1862-1864.
[6]王聪,赵凤梅,许青.全自动生化分析仪测定血清铁后对高密度脂蛋白胆固醇检测的交叉污染[J].中国误诊学杂志,2010,34:83 -85.
[7]陆俊贤,葛庆联,施祖灏,等.不同品种鸡蛋中胆固醇含量比较[J].中国家禽,2010,32(8):64 -65.
[8]再帕尔·阿不力孜,李斌,阿布拉江·克依木,等.新型QTRAPTM四极杆2线性离子阱串联质谱仪的特点及应用[J].现代仪器,2004(5):9-13.
[9]赵贵平,蒋宏键.蔬菜中25种农药残留的LC-MS/MS-QTRAP定量定性同时分析方法研究[J].分析测试学报,2007,26:244 -247.
[10]MASS SELECTIVE AXIAL EJECTION FROM A LINEAR ION TRAP[J].J Am Soc Mass Spectrom,2009,20:1132-1140.
[11]GB/T 22220—2008.食品中胆固醇的测定-高效液相色谱法[S].北京:中国标准出版社,2002.
