全自动细胞图像分析仪在胸腹腔积水诊断中的应用
2011-05-30张薇汪键程越清刘岩李永红
张薇 汪键 程越清 刘岩 李永红
1.襄阳市铁路中心医院病理科,湖北 襄阳 441003;
2.湖北省中山医院细胞病理室,湖北 武汉 430033
胸腹水细胞学检查在鉴别癌性、炎性胸腹水上起着关键性作用。胸腹水细胞中发现有恶性肿瘤细胞,即胸腹水是由恶性肿瘤引起的。相反,胸腹水细胞中没有发现恶性肿瘤细胞,多数是由良性病变引起的。然而由于非典型增生的胸腹膜间皮细胞往往较难区别于恶性肿瘤细胞,可导致误诊。结合多项研究结果基础上发现:常规细胞学诊断癌性浆膜积水敏感度为58%,特异度为97%[1]。近十年来,有很多新方法用于鉴别癌性与炎性胸腹水[2-6]。当DNA双链中的倍体发生改变时,往往表示为恶性肿瘤细胞[7]。临床上可用流式细胞仪和细胞图像分析仪来测定细胞核内DNA改变。流式细胞仪可在较短时间内测定较多胸腹水细胞内DNA含量,但它不能对少量细胞的样品进行形态学观察分析;而细胞图像仪可对少量细胞样品进行DNA测定,也可进行形态学观察分析,但测定时间较长。从研究结果看,细胞图像分析仪较流式细胞仪敏感[8-9]。目前国内临床上所用的细胞图像仪多为手动的,需要用手来寻找可疑细胞,并对每一个细胞进行聚焦、测定,故需大量时间才能对少数细胞进行测量。全自动细胞图像分析仪可克服以上缺点,对较多的细胞样品进行全自动测定,从而避免了人为因素影响。本研究试用DNA全自动图像分析仪研究恶性胸腹积水细胞中的非整倍体细胞。
1 资料和方法
1.1 研究对象
463例胸腹积水标本在2005年1月—2010年5月来源本院和多个外院(大多为可疑胸腹积水)送往本院检测的。
1.2 标本处理
每例50~100 mL胸腹水细胞离心后(1 000×g,10 min),经Sed-Fix固定液(美国Surgioath Medical Inc)固定20 min,再次离心,清洗后用涂片离心机(武汉兰丁医学高科技有限公司制成4张薄层细胞片。2张细胞片用Papanicotaou染色,常规细胞学检查是由2位有30年经验的细胞病理学专家做出。
1.3 结果判定
常规细胞学检查结果分为3类:⑴炎性胸腹水(包括急性炎症、结核和慢性炎症),⑵恶性肿瘤可疑胸腹水,⑶癌性胸腹水包(括恶性间皮瘤和转移性癌等)。全自动DNA细胞图像分析系统(DNA Image Cytometer,DNA-ICM,武汉兰丁医学高科技有限公司)测定方法,对每例4 000个以上的胸腹水细胞核进行自动聚焦测定每个细胞核的78个核特征,自动进行细胞分类和计数,自动打印DNA倍体分析直方图和细胞点阵分布图。二倍体细胞(G1/G0)的DNA含量为2c(c为DNA含量单位, DNA content);四倍体细胞(G2/M期)的DNA含量为4c。2c细胞和4c细胞为整倍体细胞。DNA定量诊断癌性胸腹水的阳性指征分为3类:⑴3个或3个以上的大于5c非整倍体细胞,⑵在2.2c至3.6c之间或大于5c 位置形成一个非整倍体峰值或多个非整倍体峰值,⑶4c的细胞数占被测细胞总数10%以上时。
2 结 果
463例胸腹积水中,常规细胞学诊断炎性积水193例,转移性腺癌177例,淋巴瘤16例,间皮瘤30例,疑为增生或核异质47例。经临床和病理诊断证实,除疑为增生或核异质47例外,常规细胞学诊断正确。
2.1 诊断明确的416例胸腹积水病例DNAICM诊断结果
由表1可见,在193例炎性积水中DNA-ICM检测未见非整倍体细胞。177例转移性腺癌中只有2例未见非整倍体细胞,4例有1~2个非整倍体细胞,61例有3个或3个以上非整倍体细胞,110例为非整倍体细胞峰。16例淋巴瘤中有3例未见大于5c的非整倍体细胞,1例有2个非整倍体细胞,7例有3个或3个以上的非整倍体细胞,5例可见非整倍体细胞峰。30例间皮细胞瘤中,2例未见大于5c的非整倍体细胞,9例可见3个或3个以上的非整倍体细胞,19例可见非整倍体细胞峰。
2.2 非整倍体细胞峰(stemline aneuploidy)形式及分布
癌性胸腹水患者大多处于肿瘤晚期阶段。在大多癌性胸腹水病例中,都可见非整倍体细胞峰。由表1可见,62%转移性腺癌,38%的淋巴瘤和63%的间皮细胞瘤均可见非整倍体细胞峰。从峰的多少和形式来看,以上3种癌性胸腹水非整倍体细胞峰形见表2。非整倍体细胞峰可表现为单峰、双峰、多峰或片状峰3种形式。转移性腺癌和间皮细胞瘤大多数都以单峰和双峰形式存在。非整倍体细胞峰出现位置也不相同,但大多数出现S期,即2.2c至3.6c之间。由表3可见,83%转移性腺癌和68%间皮细胞瘤非整倍体细胞峰分布在2.6c至3.4c之间。淋巴瘤胸腹水病例细胞在S期分布较有特点,即使无大于5c的非整倍体细胞,S期细胞分布成片。这种图形明显不同于转移性腺癌和间皮细胞瘤(图1、2)。
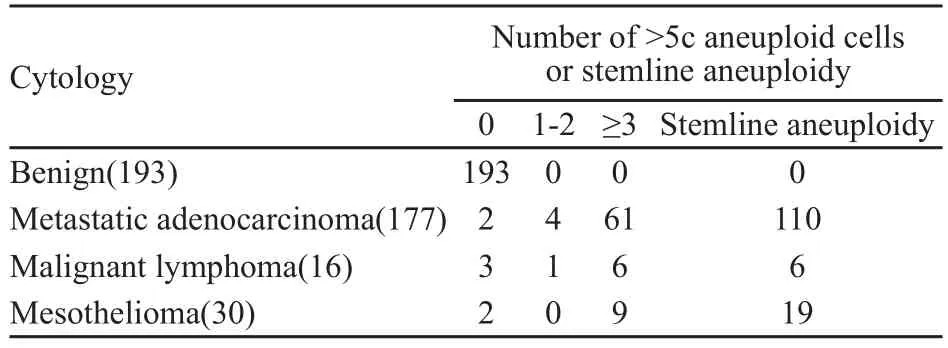
表 1 胸腹积水常规细胞学和DNA-IMC诊断结果Tab.1 Results of 416 serous effusions diagnosed by conventional cytology and DNA-ICM
2.3 >5c的非整倍体细胞数
比较多种胸腹积水中>5c细胞的百分率(表4),炎性积水没有>5c细胞,转移性腺癌中约有3.8% >5c细胞,淋巴瘤和间皮细胞瘤分别有6.6%和6.2%的细胞>5c。
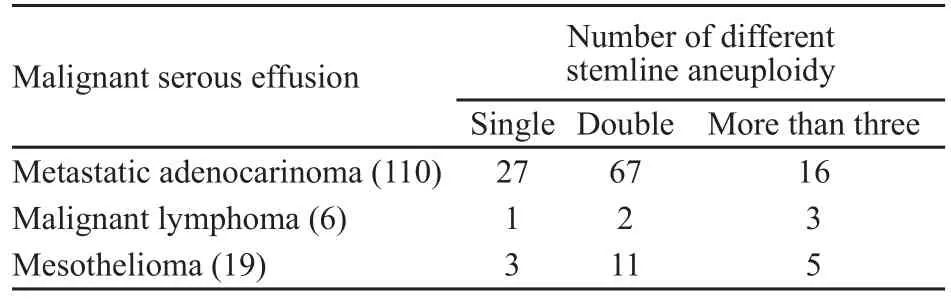
表 2 癌性胸腹积水非整倍体细胞峰的峰形情况Tab.2 Number of stemline aneuploidy in malignant serous effusions
2.4 47个可疑病例DNA-ICM的诊断结果
表5显示通过随访患者或家属而确诊了27例,另20例由于无法与患者或家属联系而不能最终明确诊断。在确诊的10例炎性积水中,DNA-ICM发现8例有1~2个>5c的非整倍体细胞。另外17例确诊的癌性积水中均可见有>5c的非整倍体细胞,其中有非整倍体细胞峰11例。

表 4 不同胸腹水>5c细胞的百分率Tab.4 Percentage of >5c aneuploid cells in different effusions

表 3 不同DNA含量非整倍体细胞峰的分布Tab.3 Distribution of different stemline aneuploidy in malignant effusions



表 5 47例异型增生病例的DNA-ICM诊断结果Tab.5 Diagnosis of 47 suspicious cases by DNA-ICM
3 讨 论
我们的研究结果与其他作者的研究结果一致[4-6,8-9],DNA-ICM检测炎性胸腹积水时,大多未见非整倍体细胞,即使可见非整倍体细胞,也只是1~2个。而癌性胸腹积水绝大多可见非整倍体细胞和非整倍体细胞峰。由此可见,癌性胸腹积水的癌细胞染色体倍数已发生了改变,用DNA-ICM可诊断和鉴别诊断炎性和癌性胸腹积水。
通过对DNA-ICM直方图的分析,可鉴别不同性质的癌性胸腹积水。淋巴癌性胸腹积水非整倍体细胞多出现在S期,呈片状分布;而转移性胸腹水非整倍体细胞以细胞单峰形式出现在S期,并可在4c和8c之间出现第2个峰。非整倍体细胞峰愈多、染色体愈不稳定,肿瘤的恶性程度愈高,预后愈差。因此癌性胸腹水的DNA-ICM图形也可用于肿瘤的恶性程度和预后的评估。
癌性胸腹积水中非整倍体细胞峰可有不同DNA含量,其原理不清楚。非整倍体细胞峰出现的位置主要决定于癌细胞内染色体的倍数。如果癌细胞的染色体倍数为正常细胞的1.5倍,那么,就可能在3c处出现一个峰;如果癌细胞染色体倍数为正常细胞的3倍,非整倍体细胞的峰就可出现在6c的位置。胸腹积水非整倍体细胞峰出现的不同部位可能与原发肿瘤种类、性质和发展程度有关。
DNA-ICM在诊断胸腹积水中尚存在问题,如⑴少数非整倍体细胞:从本研究中可见,极少数炎性和少数癌性胸腹积水中均可出现1~2个非整倍体细胞。因此,对1~2个非整倍体细胞如何处理要非常慎重。少数炎性胸腹积水细胞可出现细胞退变或核固缩,这些细胞在Feulgen染色时,可出现>5c细胞。但这些>5c细胞的数量和例数非常小。当出现1~2个大于5c细胞时,可反复检查,做免疫组化等方法来鉴别炎性或癌胸腹积水。⑵DNA-ICM对成团的癌细胞不能识别:由于本研究所用DNA-ICM的软件尚不能将成团的细胞分割开来。因此,DNA-ICM将这类细胞作为“垃圾”处理。转移性腺癌细胞常聚集成团,DNA-ICM有时不能识别出来而误诊。
总之,DNA-ICM可用于诊断炎性或癌性胸腹积水,也可用它来判别癌性胸腹积水的性质和恶性程度。
[1]Motherby H, Pomjanskin N, Kube M, et al.Diagnostic DNA flow vs image cytometry in effacsion cytology[J].Anal Cell Pathol, 2002, 24:5-15.
[2]Motherby H, Kube M, Friedriches N, et al.Immunocytochemistry and DNA image cytometry in diagnostic effusion cytology Ⅰ.Prevalence of markers in tumour cell positive and negative smears[J].Analy Cell Path, 1999, 19:7-20.
[3]Motherby H, Kebe M, Friedriches N, et al.Immunocytochemistry and DNA-image cytometry in diagnostic effusion cytology Ⅱ.Diagnostic accuracy in equivocal smears[J].Analy Cell Path, 1999, 19:59-66.
[4]Carcia-Bonafe M, Moragas A.Differential diagnosis of malignant and reactive cells from serous effusions: image and texture analysis study[J].Anal Cell Pathol, 1996, 12:85-98.
[5]Decker D, Stratmann H, Springer W, et al.Benign and malignant cells in effusions: diagnostic value of image DNA cytometry in comparison to cytological analysis[J].Pathol Res Pract, 1999, 194:791-795.
[6]Kayser K, Blum S, Beyer M.Routine DNA cytometry of benign and malignant pleural effusions by means of the remote quantitation server Euroquant: a prospective study[J].J Clin Pathol, 2000, 53:760-764.
[7]Osterheld MC, Lietle C, Anca M.Image cytometry: an aid for cytological diagnosis of pleural effusions[J].Diagn Cytopathol, 2005, 32:173-176.
[8]Saha I, Dey P, Vhora H, et al.Role of DNA flow cytometry and image cytometry on effusion fluid[J].Diagn Cytopathol,2000, 22:81-85.
[9]Palmer HE, Wilson CS, Bardales RH.Cytology and flow cytometry of malignant effusions of multiple myeloma[J].Diagn Cytopathol, 2000, 22:147-151.
