甲状腺乳头状癌组织中瘦素的表达与血管生成及转移的关系
2011-05-30于霄赵俊军王波李连宏李平唐建武孙雷
于霄 赵俊军 王波 李连宏 李平 唐建武 孙雷
1.大连医科大学中日临床病理中心,辽宁 大连 116044;
2.大连市中心医院,辽宁 大连 116033
1994年瘦素(leptin)和ob基因(obese gene)的发现,1995年leptin受体OB-R的成功克隆将leptin这一物质引入人们的视线。随着对leptin认识的逐渐加深,学者们发现,leptin不仅与肥胖症有关,也通过不同的信号通路及途径参与结肠癌、肝癌、口腔鳞癌、宫颈癌等恶性肿瘤进展过程[1-5]。血管生成对肿瘤的发展至关重要,研究表明leptin有促进血管生成的作用[6]。本实验采用免疫组织化学染色法检测甲状腺乳头状癌组织中leptin的表达情况及其与血管生成、淋巴结转移的关系。
1 资料和方法
1.1 资料来源
收集大连市中心医院病理科2003—2009年甲状腺乳头状癌组织标本58例(其中已发生淋巴结转移29例,未发生淋巴结转移29例)和甲状腺腺瘤组织标本26例。
1.2 切片及染色
选定标本经常规4%甲醛固定,将其切片,片厚约4 μm,切片经常规脱蜡、水化后,进行HE染色及免疫组织化学染色。
1.3 分组方法
根据病理诊断将标本分为甲状腺乳头状癌组、对照组(癌旁组、甲状腺腺瘤组)。
1.4 免疫组织化学染色
试剂:兔抗人leptin多克隆抗体ob购自Santa Cruz公司。鼠抗人CD105单克隆抗体和SP试剂盒均购自北京中杉金桥生物技术有限公司。免疫组织化学染色步骤按照SP法。
leptin阳性结果判定:参照许良中等[7]的免疫组织化学反应结果的判定标准,综合考虑切片中阳性细胞占所观察同类细胞数的百分比。阳性细胞百分比分为4级:≤5%为0分;>5%~25%为1分;>25%~50%为2分;>50%为3分。根据显色程度判定阳性强度:基本不着色为0分;淡黄色为1分;棕黄色为2分;棕褐色为3分。将每张切片着色程度得分与着色细胞百分率得分相乘,为最后得分。0~1分为阴性(-);2~3分为弱阳性(+);4~6分为中等阳性(++);6分以上为强阳性(+++)。
C D 1 0 5标记微血管,微血管密度(microvessel density,MVD)计数方法为:与背景明显有别的任何一个被染成棕色的内皮细胞或不管是否有腔的细胞丛均视为单个微血管,分支结构如果未和连续结构中断应作为一个血管计数,管径大于8个红细胞并具有肌层的血管不作为新生微血管,200倍下选取3个MVD高区,在200倍视野下由2名病理医师采用双盲法进行计数,结果取均值作为该病例的MVD。
1.5 统计学处理
应用SPSS13.0统计软件中的χ2检验、单因素方差分析和非参数等级相关性(Spearman)检验对数据进行分析,P<0.05表示差异有统计学意义。
2 结 果
2.1 各组中leptin的表达情况
leptin主要表达于甲状腺乳头状癌组织中、肿瘤细胞的胞质内、局部癌组织及周边组织间质内(图1)。甲状腺乳头状癌组织leptin表达阳性率为91.38% (已转移组93.10%,未转移组89.66%,χ2=10.68,P<0.05),显著高于甲状腺腺瘤组织(leptin表达阳性率为7.70%,χ2=56.07,P<0.05)和癌旁组织(leptin表达阳性率为5.17%,χ2=88.94,P<0.05)。甲状腺腺瘤组织与癌旁组织之间leptin表达差异无统计学意义(χ2=2.31,P>0.05) (表1、2 )。

表 1 各组leptin表达阳性分析Tab.1 Statistic analysis of leptin-positive expression in different groups


表 2 甲状腺乳头状癌组leptin表达情况Tab.2 The expression of leptin in thyroid papillary carcinoma group
2.2 各组CD105表达情况以及MVD计数结果
甲状腺乳头状癌转移组和未转移组CD105表达如图2所示。

经单因素方差分析(表3),甲状腺乳头状癌已转移组MVD(59.92±18.54)高于未转移组(22.44±14.50,P=0.000)、腺瘤组(4.18±2.14,P=0.000)和癌旁组(2.03±1.52,P=0.000);甲状腺乳头状癌未转移组MVD高于腺瘤组(P=0.005)和癌旁组(P=0.000);腺瘤组与癌旁组MVD差异无统计学意义(P=0.919)。Spearman相关分析显示,MVD随leptin表达的强度增强而增加,两者呈正相关性(r=0.88,P<0.05)。
3 讨 论
leptin是由ob基因编码的146个氨基酸组成的多肽激素。leptin在最初的研究中是作为调节机体能量平衡的重要因子,随后发现leptin与某些恶性肿瘤的进展有关。相关动物实验提示由于肥胖引起的leptin血浆水平提高可增加黑色素瘤的生长速度[8]。临床研究表明,循环血中leptin血浆浓度的提高可见于乳腺癌患者、儿童癌症患者、儿童期急性淋巴细胞白血病患者等[9-12]。甲状腺乳头状癌患者血浆中leptin浓度的明显升高与本实验结果中甲状腺乳头状癌组织leptin的高表达一致[13]。此外,结肠癌、胃癌、宫颈癌组织中leptin的表达亦有增强[14-16]。在恶性肿瘤患者体内血浆leptin浓度的升高、局部癌组织leptin的高表达不仅与脂肪的沉积和能量代谢有关,更受关注的效应是改变恶性肿瘤组织局部环境进而通过复杂的机制参与肿瘤的进展。
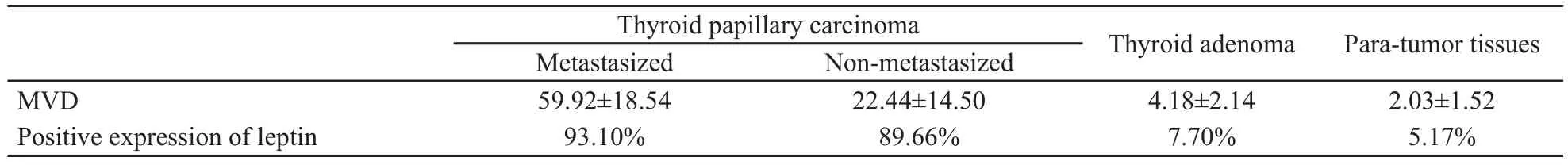
表 3 各组新生血管密度以及与leptin表达的相关性分析Tab.3 The MVD in different groups and its correlation with leptin expression
一些体外研究证实leptin对于恶性肿瘤细胞的迁移起到促进作用。如leptin可刺激前列腺癌、结肠癌以及甲状腺癌细胞的迁移[17-19]。迁移对于肿瘤转移的发生有非常重要的作用。然而leptin并不是直接赋予恶性肿瘤细胞迁移的能力,而是通过使细胞外基质金属蛋白酶增多、经激活的NF-κB通路诱导整联蛋白高表达等途径改变恶性肿瘤组织局部的细胞外基质状态,从而发挥促进细胞迁移的作用[20-21]。本实验结果表明甲状腺乳头状癌中,已发生转移组的leptin表达强度强于未发生转移组,据此可推测leptin通过复杂的途径参与了甲状腺乳头状癌组织的转移过程。
无血管状态下肿瘤的直径不超过2~3 mm,因此肿瘤的发展依赖血管的生成。1998年,Sierra-Honigmann MR等[22]发现leptin受体可表达于人类脉管系统及原代培养的人类内皮细胞,内皮细胞作为leptin可作用的靶细胞在其调控下发生分裂增殖。leptin具有激活造血细胞的作用,并特定地调控内皮祖细胞的黏附性及靶向归巢能力[23-24]。另有研究表明,leptin还可诱导局部组织血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达[17]。leptin的这些作用均可促进肿瘤组织血管的新生。部分研究已经证实肝癌、前列腺癌组织中leptin及其受体参与肿瘤组织血管的生成[17,25]。本实验新生血管密度随着leptin的表达强度的增加而增高,两者呈正相关性。推测leptin参与了甲状腺乳头状癌组织内血管的生成,为肿瘤的发展提供基础。
[1]Ratke J, Entschladen F, Niggemann B, et al.Leptin stimulates the migration of colon carcinoma cells by multiple signaling pathways [J].Endocr Relat Cancer, 2010, 17(1): 179-189.
[2]Ribatti D, Belloni AS, Nico B, et al.Leptin-leptin receptor are involved in angiogenesis in human hepatocellular carcinoma[J].Peptides, 2008, 29(9): 1596-1602.
[3]Gharote HP, Mody RN.Estimation of serum leptin in oral squamous cell carcinoma [J].J Oral Pathol Med, 2010,39(1): 69-73.
[4]Lebrecht A, Ludwig E, Huber A, et al.Serum vascular endothelial growth factor and serum leptin in patients with cervical cancer [J].Gynecol Oncol, 2002, 85(1): 32-35.
[5]邹杨, 汪昱, 夏晓天, 等.结直肠癌组织leptin受体的表达及临床意义 [J].中国癌症杂志, 2006, 16(10): 809-812.
[6]Ide S, Tokuyama R, Davaadorj P, et al.Leptin and vascular endothelial growth factor regulate angiogenesis in tooth germs[J].Histochem Cell Biol, 2011, 135(3): 281-292.
[7]许良中, 杨文涛.免疫组织化学反应结果的判定标准[J].中国癌症杂志, 1996, 6: 229-231.
[8]Brandon EL, Gu JW, Cantwell L, et al.Obesity promotes melanoma tumor growth: role of leptin [J].Cancer Biol Ther, 2009, 8(19): 1871-1879.
[9]Wu MH, Chou YC, Chou WY, et al.Circulating levels of leptin, adiposity and breast cancer risk [J].Br J Cancer,2009, 100(4): 578-582.
[10]Geisler J, Haynes B, Ekse D, et al.Total body aromatization in postmenopausal breast cancer patients is strongly correlated to plasma leptin levels [J].J Steroid Biochem Mol Biol, 2007,104(1-2): 27-34.
[11]Cağlar K, Kutluk T, Varan A, et al.Leptin and neuropeptide Y plasma levels in children with cancer [J].J Pediatr Endocrinol Metab, 2005, 18(5): 485-489.
[12]Wex H, Ponelis E, Wex T, et al.Plasma leptin and leptin receptor expression in childhood acute lymphoblastic leukemia[J].Int J Hematol, 2002, 76(5): 446-452.
[13]Akinci M, Kosova F, Cetin B, et al.Leptin levels in thyroid cancer [J].Asian J Surg, 2009, 32(4): 216-23.
[14]晏泽辉, 熊枝繁.结直肠癌中瘦素受体的表达及其在血管生成中的作用[J].中国肿瘤临床, 2007, 34(3): 140-144.
[15]王颖, 罗和生, 赵亮, 等.瘦素及其受体在胃癌中的表达[J].中华实验外科杂志, 2005, 22(5): 609-610.
[16]胡斐, 效小莉, 濮德敏, 等.瘦素及其受体在宫颈癌中的表达及意义 [J].中国组织化学与细胞化学杂志, 2006,15(3): 297-301.
[17]Frankenberry KA, Somasundar P, McFadden DW, et al.Leptin induces cell migration and the expression of growth factors in human prostate cancer cells [J].Am J Surg, 2004, 188(5):560-565.
[18]Ratke J, Entschladen F, Niggemann B, et al.Leptin stimulates the migration of colon carcinoma cells by multiple signaling pathways [J].Endocr Relat Cancer, 2010, 17(1): 179-189.
[19]Cheng SP, Yin PH, Chang YC, et al.Differential roles of leptin in regulating cell migration in thyroid cancer cells [J].Oncol Rep, 2010, 23(6): 1721-1727.
[20]Yeh WL, Lu DY, Lee MJ, et al.Leptin induces migration and invasion of glioma cells through MMP-13 production [J].Glia, 2009, 57(4): 454-464.
[21]Yang SN, Chen HT, Tsou HK, et al.Leptin enhances cell migration in human chondrosarcoma cells through OBRl leptin receptor [J].Carcinogenesis, 2009, 30(4): 566-574.
[22]Sierra-Honigmann MR, Nath AK, Murakami C, et al.Biological action of leptin as an angiogenic factor [J].Science, 1998, 281(5383): 1683-1686.
[23]Gainsford T, Willson TA, Metcalf D, et al.Leptin can induce proliferation, differentiation, and functional activation of hemopoietic cells [J].Proc Natl Acad Sci U S A, 1996,93(25): 14564-14568.
[24]Schroeter MR, Leifheit M, Sudholt P, et al.Leptin enhances the recruitment of endothelial progenitor cells into neointimal lesions after vascular injury by promoting integrin-mediated adhesion [J].Circ Res, 2008, 103(5): 536-544.
[25]Ribatti D, Belloni AS, Nico B, et al.Leptin-leptin receptor are involved in angiogenesis in human hepatocellular carcinoma[J].Peptides, 2008, 29(9): 1596-1602.
