塞来昔布对乳腺癌细胞株的放射增敏作用
2011-05-30牛国梁王辉谢荣俊张树友
牛国梁 王辉 谢荣俊 张树友
南华大学附属南华医院普外科,湖南 衡阳 421002
乳腺癌是严重威胁女性健康的恶性肿瘤之一,对早期患者实行保乳治疗加放疗已是当今的总趋势。放疗正成为乳腺癌局部和区域治疗的重要手段,但肿瘤细胞本身对放射线的敏感性差、在放疗中存在放射抗拒等因素影响了放疗疗效,且放疗不良反应大。因此,寻找一种高效低毒的放疗增敏剂成为研究的热点。塞来昔布(celecoxib)是环氧化酶-2(cycloxygenase-2,COX-2)的选择性抑制剂,其具有高效低毒、胃肠道反应小等特点,研究发现塞来昔布不仅能抑制肿瘤的发生、发展,还能提高肿瘤放疗和化疗的敏感性,其确切机制尚不明确[1-2]。研究发现,PI3K/Akt信号通路在肿瘤的放射抵抗性中起重要作用[3]。本实验研究塞来昔布对人乳腺癌细胞株MDA-MB-231细胞放射敏感性的影响,并探讨塞来昔布是否通过阻断PI3K/Akt信号通路提高其放射敏感性。
1 材料和方法
1.1 材料及主要试剂
人乳腺癌细胞株MDA-MB-231细胞由中国科学院上海生物化学与细胞研究所提供;PRMI 1640培养基、胰蛋白酶为美国GIBCO BRL公司产品;胎牛血清为杭州四季青公司产品;塞来昔布为美国辉瑞公司产品;四甲基偶氮唑蓝(MTT)、二甲基亚砜(DMSO)、碘化丙啶(PI)为Sigma公司产品;鼠抗人pAkt、Akt单克隆抗体、鼠抗β-actin单克隆抗体购美国Santa Cruz公司产品;羊抗兔二抗为北京中杉金桥生物公司产品;BCA蛋白定量检测试剂盒为美国Pierce公司产品;ECL发光检测试剂盒为联科公司产品。
1.2 细胞培养
人乳腺癌细胞株MDA-MB-231细胞用含10%胎牛血清、100 U/mL青霉素和100 U/mL链霉素的RPMI 1640培养液,置于37 ℃、饱和湿度、CO2体积分数为5%的培养箱中培养,培养瓶贴壁面至70%~80%融合时胰蛋白酶消化传代一次,传代后取对数生长期细胞进行实验。
1.3 细胞照射
直线加速器为德国Siemens Primus,6MV X-ray,将直线加速器机架角度为180度,剂量率200 cGy/min,射野大小为10 cm×10 cm,源皮距(source skin distance,SSD)为100 cm,加1.5 cm等效组织(培养瓶倒置于治疗床面,培养瓶的细胞面朝上,并在瓶面上加垫1.5 cm厚等效有机玻璃板)。
1.4 MTT法检测塞来昔布的细胞毒性
取对数生长期细胞(细胞浓度为2×104mL-1),以每孔200 μL接种于96孔板,于37 ℃,CO2体积分数为5%的培养箱中培养4 h贴壁后,换成含塞来昔布终浓度分别为10 μmol/L、20 μmol/L、30 μmol/L、40 μmol/L、50 μmol/L和60 μmol/L继续培养,对照组为含0.5%DMSO的培养液,每一浓度设4个复孔,培养24 h后,每孔加入MTT 20 μL(以PBS配成5 mg/mL),继续培养4 h后,每孔加DMSO 150 μL,震荡10 min。在酶联免疫检测仪上490 nm波长测定各孔的光密度值(D值)。以上实验重复3次。按公式:细胞生长抑制率=(1-D实验组/D对照组)×100%。计算药物对MDA-MB-231细胞生长抑制率,并计算塞来昔布IC50和IC20,取IC20作为后续实验浓度。
1.5 克隆形成实验
MTT实验得到塞来昔布IC20值20 μmol/L,即为实验浓度。实验分4组,对照组:含有和其他组相等浓度的DMSO溶解剂;药物组:DMSO溶解的塞来昔布;照射组:X线照射;实验组:塞来昔布联合X线照射。对照组及药物组于细胞贴壁后,分别更换含或不含20 μmol/L塞来昔布培养液继续培养24 h,0.25%胰酶消化,悬浮细胞,台盼蓝检测细胞活性并计数活细胞,按100个细胞/孔,接种于12孔培养板,无药培养液继续培养10 d左右。照射组及实验组于细胞贴壁后,实验组更换含20 μmol/L塞来昔布培养液,继续培养24 h。照射组及实验组分别给予0、2、4、6、8、10 Gy X-ray照射,剂量率为200 cGy/min,照射后,消化、悬浮、计数活细胞,根据不同照射剂量(由低到高),分别接种100、100、500、500、1 000、1 000个细胞于12孔培养板。无药培养液继续培养10 d左右,甲醇固定,Gimsa染色,低倍倒置显微镜下计数各孔细胞数大于50个的细胞集落数,计算存活分数,绘制剂量效应曲线。克隆率(plating efficiency,PE)=对照组每孔克隆数/每孔细胞种植数×100%,以PE作为校正系数计算存活分数(surviving fraction,SF),SF=实验组每孔克隆数/(每孔细胞种植数×克隆率),以单击多靶数学模型拟合细胞存活曲线,计算出照射组和实验组的准域剂量(Dq)、平均致死剂量(D0)、2 Gy照射的存活分数(SF2)值,放射增敏效应以放射增敏比(SERD0)表示,定义为照射组与实验组的D0之比。上述实验重复3次。
1.6 流式细胞分析法(flow cytometry,FCM)检测肿瘤细胞凋亡
按上述实验分组,取对数生长期的MDA-MB-231细胞2×106个消化,悬浮,接种于100 mL培养瓶中,37 ℃,CO2体积分数为5%的培养箱中培养,培养瓶贴壁面至70%~80%融合时,对照组及照射组更换含0.5% DMSO培养液,药物组和实验组更换20 μmol/L塞来昔布培养液,以照射剂量为6 Gy干预后,继续培养24 h,然后收集细胞。75%冰乙醇固定,在4℃固定24 h,去固定液,PI染色,流式细胞仪检测细胞凋亡率。上述实验重复3次。
1.7 Western blot法检测Akt、pAkt表达
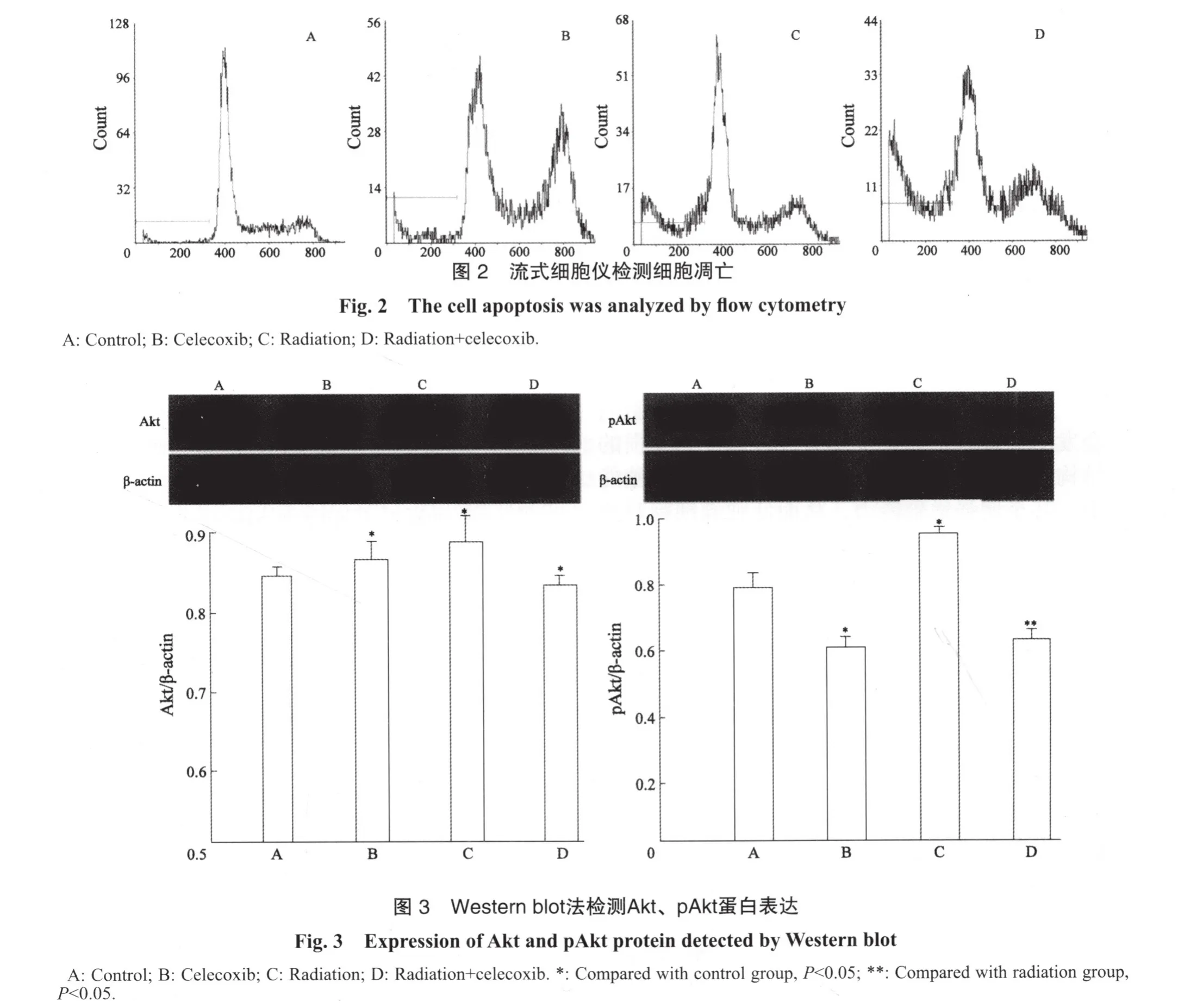
按上述实验分组,对照组及照射组更换含0.5% DMSO培养液,药物组和实验组更换20 μmol/L塞来昔布培养液,以照射剂量为6 Gy干预后,继续培养24 h,收集细胞。裂解细胞提取总蛋白,BCA法蛋白定量,取40 μg蛋白SDS-PAGE凝胶电泳,将凝胶中的蛋白转移至已用甲醇激活的硝酸纤维素膜(PVDF)上,封闭液震动封闭1 h,分别加入抗pAkt、Akt、β-actin一抗,37 ℃温育1 h,洗膜后加入相应二抗37 ℃温育1 h。暗室中用ECL发光法显色,曝光,显影,定影,水洗。以上实验重复3次。胶片用薄层扫描仪进行灰度扫描,用AlphaImager 2200软件分析各产物的灰度值,将各灰度值与对应标本β-actin对照的灰度值相比,计算出样本蛋白相对表达量。
1.8 统计学处理
实验结果采用SPSS 13.0统计软件进行分析。所有数据以均数±标准差()表示。多组间数据比较采用方差分析;两组间比较采用t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 MTT实验结果
MTT法检测发现,不同浓度塞来昔布作用MDA-MB-231细胞24 h后,有明显的抑制作用,并且呈剂量依赖性。根据药物效应中效方程式法计算出药物IC50、IC20分别约为(50.14±2.42) μmol/L、(20.21±1.34) μmol/L。选择IC2020 μmol/L作为后续实验浓度。
2.2 克隆形成实验结果
照射组和实验组克隆形成后,计算细胞存活分数并通过单击多靶模型拟合细胞存活曲线(图1),计算出Dq、D0、SF2值(表1)。可以看出,实验组Dq、D0、SF2明显低于照射组,且放射增敏比SERD0为1.277,表明塞来昔布对人乳腺癌细胞株MDA-MB-231具明显放射增敏作用。


表 1 照射组和实验组细胞放射生物学参数Tab.1 The radiobiological parameters of the MDA-MB-231 cells after treatment
2.3 FCM检测细胞凋亡结果
与对照组相比,塞来昔布和单纯照射与对照组相比,均能诱导MDA-MB-231细胞凋亡(t=15.49,P<0.05;t=24.69,P<0.05),两者联合作用交单纯照射组的效果更显著(t=14.01,P<0.05) (图2,表2),说明塞来昔布能提高MDA-MB-231细胞对放射线的敏感性。

表 2 MDA-MB-231细胞凋亡率的比较Tab.2 Comparison of apoptosis rates in MDA-MB-231cells after treatment
2.4 Western blot法检测Akt、pAkt表达结果
以β-actin为内参照,Western blot法检测蛋白质的表达。结果显示,实验各组Akt蛋白表达没有明显的差异,各组蛋白相对灰度分析差异无统计学意义(P>0.05)。塞来昔布能抑制pAkt表达,而放射线能提高pAkt表达,两者联合使用后pAkt蛋白表达比单纯照射组降低。各组pAkt蛋白相对灰度分析差异有统计学意义(P<0.05,图3)。
3 讨 论
环氧化酶(cyclooxygenase,COX)是催化花生四烯酸生物合成前列腺素(prostaglandin,PG)的限速酶,PG参与机体多种生理及病理过程。COX分为COX-1型和COX-2型。COX-1主要参与体内正常的生理过程。COX-2为诱生表达,在多种恶性肿瘤中高表达,其与肿瘤的发生、发展密切相关[4-5]。塞来昔布是一种高选择性的COX-2抑制剂,它能通过阻滞肿瘤细胞周期、抑制肿瘤细胞增殖、诱导细胞调亡、阻断肿瘤介导的免疫抑制表达、抑制肿瘤新血管生成等起到抗肿瘤作用[6-8]。研究还发现,塞来昔布可增强放射线对肿瘤的作用,但其机制尚未清楚,其可能的机制有:降低细胞内前列腺素E2(prostaglandin E2,PGE2)水平,去除放射保护、抑制细胞增殖促进凋亡、阻滞于对放射线敏感的细胞周期[9]、抑制DNA损伤的修复[10]、抗血管生成等[11]。PI3K/Akt信号通路在绝大多数人类肿瘤中表达失调,调节着肿瘤细胞的增殖和凋亡,并且与肿瘤的血管形成和侵袭转移以及对化学耐药、放疗抗拒密切相关[12-13]。但PI3K/Akt信号通路与塞来昔布在肿瘤细胞放射增敏中的作用及机制尚不清楚。
本实验研究塞来昔布对人乳腺癌细胞株MDA-MB-231细胞放射线的作用,流式细胞仪检测结果显示,塞来昔布能够明显提高肿瘤细胞的放射敏感性。克隆形成实验单击多靶模型是衡量细胞放射敏感性的最广泛的方法。本研究克隆形成实验结果显示,塞来昔布对MDAMB-231细胞有明显的放射增敏作用。塞来昔布联合X线照射组的Dq、D0、SF2较单纯照射组均降低,SERD0为1.277。Dq减小,说明细胞存活曲线肩区缩小,放射抗拒性降低;D0减小,SF2降低,放射抗拒性降低,使细胞亚致死损伤修复能力降低从而达到放射增敏的效果。这可能是塞来昔布降低肿瘤细胞的放射抗拒,提高放射敏感性的重要因素。
肿瘤细胞在受到放射线作用于后,细胞内会发生一系列生物化学反应,以修复其受损的结构和功能,恢复肿瘤细胞的克隆源性增殖能力,甚至增强增殖能力,从而使肿瘤细胞对放射线产生抗拒,抑制肿瘤细胞的凋亡或死亡。而细胞的信号转导通路在这一过程中起了重要的作用。PI3K/Akt信号转通路是一条重要的信号转导通路,其在细胞代谢、细胞周期调控、血管生成等方面发挥重要作用[14-15]。Akt又称蛋白激酶B (protein kinase B,PKB)是PI3K/Akt信号转导通路的核心,是磷脂酰肌醇3-激酶(phosphatidylinositol-3-kinase,PI3K)下游最主要的作用靶标,PI3K激活的Akt可以通过磷酸化作用激活或抑制其下游靶蛋白Bad、Caspase 9、NF-κB、mTOR、Par-4、P21等,从而诱发肿瘤细胞增殖,促进细胞存活[16]。我们实验发现,实验各组Akt在蛋白表达水平没有明显改变,而塞来昔布组pAkt蛋白明显低于对照组,说明塞来昔布能够抑制Akt磷酸化,这与Barnes等[17]研究的塞来昔布能够抑制COX-2,从而抑制Akt磷酸化一致。而单纯放射组提高pAkt蛋白的表达,推测照射后Akt磷酸化可能是细胞对射线损伤的一个早期反应事件,这也可能是肿瘤细胞放射抗拒的重要原因。塞来昔布联合照射线组pAkt蛋白低于单纯照射组,说明塞来昔布具有抑制放射线诱导Akt磷酸化的作用,增强了放射敏感性。
我们的研究提示,放射线可诱导MDAMB-231细胞PI3K/Akt信号转导通路的活化,提高肿瘤细胞的放射抗拒,塞来昔布则能够抑制PI3K/Akt信号转导通路的活化,从而提高了乳腺癌放射敏感性。
[1]Nakata E, Mason KA, Hunter N, et al.Potentiation of tumor response to radiation or chemoradiation by selective cyclooxygenase-2 enzyme inhibitors [J].Int J Radiat Oncol Biol Phys, 2004, 58(2): 369-375.
[2]徐晓婷, 周菊英, 俞志英, 等.COX-2表达对脑胶质瘤的放射敏感性和细胞周期的影响 [J].中国癌症杂志, 2007,17(11): 838-842.
[3]Gupta AK, Bakanauskas VJ, Cerniglia GJ, et al.The Ras radiation resistance pathway [J].Cancer Res, 2001, 61(10):4278-4282.
[4]王日雄, 施烯, 林学德, 等.COX-2及VEGF蛋白在大鼠乳腺癌骨移植瘤中的表达及意义 [J].中国癌症杂志, 2010,20(5): 348-352.
[5]Grösch S, Maier TJ, Schiffmann S, et al.Cyclooxygenase-2(COX-2)-independent anticarcinogenic effects of selective COX-2 inhibitors [J].J Natl Cancer Inst, 2006, 98(11):736-747.
[6]高阳, 庄竟.塞来昔布对人胃癌 SGC-7901细胞系VEGF表达的影响 [J].山东医药, 2009, 49(24): 60-61.
[7]王玲, 张奇, 赵博, 等.塞来昔布通过阻断NF-кB信号通路诱导人乳腺癌细胞MDA-MB-231细胞周期阻滞的相关研究 [J].中国癌症杂志, 2009, 19(1): 33-28.
[8]熊一峰, 梅金红, 徐林林, 等.塞来昔布对人胶质瘤 U251细胞增殖及 NF-κB蛋白表达的影响 [J].山东医药,2010, 50(31): 26-28.
[9]Raju U, Nakata E, Yang P, et al.In vitro enhancement of tumor cell radiosensitivity by a selective inhibitor of cyclooxygenase-2 enzyme: mechanistic considerations [J].Int J Radiat Oncol Biol Phys, 2002, 54(3):886-894.
[10]Liu W, Chen Y, Wang W, et al.Combination of radiation and celebrex (celecoxib) reduce mammary and lung tumor growth[J].Am J Clin Oncol, 2003, 26(4): S103-S109.
[11]Kozin SV, Boucher Y, Hicklin DJ, et al.Vascular endothelial growth factor receptor-2-blocking antibody potentiates radiation-induced long-term control of human tumor xenografts [J].Cancer Res, 2001, 61(1): 39-44.
[12]Yuan TL, Cantley LC.PI3K pathway alterations in cancer:variations on a theme [J].Oncogene, 2008, 27(41): 5497-5510.
[13]Toulany M, Kehlbach R, Rodemann HP, et al.Radiocontrast media affect radiation-induced DNA damage repairin vitroandin vivoby affecting Akt signalling [J].Radiother Oncol, 2010, 94(1): 110-116.
[14]姚婷婷, 林仲秋.PI3K/Akt信号传导通路在妇科肿瘤中的研究进展 [J].实用肿瘤杂志, 2008, 23(2): 182-184.
[15]解智慧, 孙秀华, 柯丹, 等.肺癌中PI3K/Akt信号通路对Skp2调控机制的研究 [J].山东医药, 2010, 50(8): 13-15.
[16]Song G, Ouyang GL, Bao S.The activation of Akt/PKB signaling pathway and cell survival [J].J Cell Mol Med,2005, 9(1): 59-71.
[17]Barnes NL, Warnberg F, Farnie G, et al.Cyclooxygenase-2 inhibition: effects on tumour growth, cell cycling and lymphangiogenesis in a xenograft model of breast cancer [J].Br J Cancer, 2007, 96(4): 575-582.
