白癜风患者维生素D受体Apa I基因多态性及免疫异常的研究
2011-05-28吴瑞勤谢匡成朱光斗施伟民
孙 越,韩 菁,吴瑞勤,谢匡成,朱光斗,施伟民
(上海交通大学附属第一人民医院,上海 200080)
白癜风是一种常见的色素脱失性疾病,严重影响患者身心健康。近年来研究表明白癜风的发病与自身免疫有关,并有一定的遗传背景[1]。维生素D受体(vitamin D receptor,VDR)属于包括雌激素、糖皮质激素、甲状腺素和维甲酸类蛋白受体基因超家族成员,以往研究表明VDR基因多态性与多种疾病有非常密切的关系[2,3]。本研究采用聚合酶链反应和限制性片段长度多态性检测等方法研究了白癜风患者VDR Apa I基因多态性及其与患者损害分布、T淋巴细胞亚群、免疫球蛋白和补体水平的相互关系,旨在探讨VDR基因多态性对白癜风免疫异常及发病的影响。
1 研究对象和方法
1.1 研究对象 按照白癜风的诊断标准[4],随机选取我科门诊白癜风患者46例,男21例,女25例,均为生活在本地区的汉族人群,年龄4~65岁[平均(24.9±13.9)岁]。正常对照组来自同地区50例无血缘关系的健康人员,男27例,女23例,均为汉族,年龄 6~62 岁[平均(26.2±13.7)岁]。46 例白癜风中寻常型 34例(73.91%),节段型 12例(26.09%);进展期26例(56.52%),稳定期20例(43.47%)。46例中7例有家族史(15.22%),所有患者近2个月内未接受其他治疗。
1.2 方法 VDR Apa I基因多态性检测 ①抽取外周血1mL,2%EDTA抗凝,抽提基因组DNA。②参考文献进行引物的设计与合成[5]:上游引物:5’-CAACCAAGACTACAAGTACCGCGTCAGTGA-3’;下游引物:5’-TGGCGGCAGCGGATGTACGTCTGC-3’。③PCR反应及产物的纯化、酶切:限制性内切Apa I酶切后PCR产物显示一条条带,说明扩增片段不含酶切位点(-/-),用AA表示;显示三条条带,说明扩增片段一条染色体上存在酶切位点而另一条染色体上无酶切位点,为杂合子(+/-),用Aa表示;显示两条条带,说明扩增片段两条染色体均有酶切位点(+/+),用aa表示,见图1。应用BNⅡ型DADEBEHRING仪及相应的试剂盒,采用免疫散射比浊法检测IgG、IgA、IgM及C3、C4水平。淋巴细胞亚群采用EPICSXL型流式细胞仪进行定量分析。
1.3 统计学处理 分别统计白癜风组和正常对照组基因型和等位基因的分布频率数据,经Hardy-Weinberg遗传平衡检验后,用SPSS13.0统计软件分析,P<0.05认为差异显著。采用χ2检验,比较白癜风组和正常对照组VDR基因多态性的差异;VDR基因多态性与不同类型白癜风的相关性。采用t检验检测各基因型与血清 IgA、IgM、IgG、C3、C4 以及CD3+、CD4+、CD8+之间的关系。
2 结果
2.1 白癜风组及正常对照组VDR Apa I基因型频率分布的Hardy-Weinberg遗传平衡检验 经Hardy-Weinberg遗传平衡检验,白癜风组 (n=46)χ2=2.726,P>0.05;正常对照组(n=50)χ2=0.127,P>0.05,两者均符合Hardy-Weinberg平衡群体。
2.2 白癜风患者VDR Apa I基因多态性分析 见图1,VDR基因经PCR扩增,得到760bp片段。进一步经限制性内切酶Apa I酶切,如果显示一条带,提示扩增片段为纯合子,两条染色体皆存在G→T突变(GTGCCC),不含酶切位点,以AA表示;如果显示三条条带,说明扩增片段为杂合子,即一条染色体上存在酶切位点(GGGCCC)而另一条染色体上为(GTGCCC),无酶切位点,以Aa表示;如果显示两条条带,说明扩增片段为纯合子,即两条染色体均有酶切位点(GGGCCC),以aa表示,由此可见VDR基因在Apa I酶切位点具有3种基因型。
白癜风患者VDR基因的ApaI酶切位点的基因多态性与正常对照组有统计学差异(χ2=6.638,P=0.036)。提示ApaI酶切位点的基因多态性可能与白癜风发病存在一定的关系。见表1。
白癜风患者与正常对照组VDR基因ApaI酶切位点的等位基因A/a分布频率存在统计学差异(χ2=6.142,P=0.013)。白癜风组a等位基因分布频率高于正常对照组,提示等位基因a分布频率的提高可能与白癜风发病存在一定的关系。见表2。
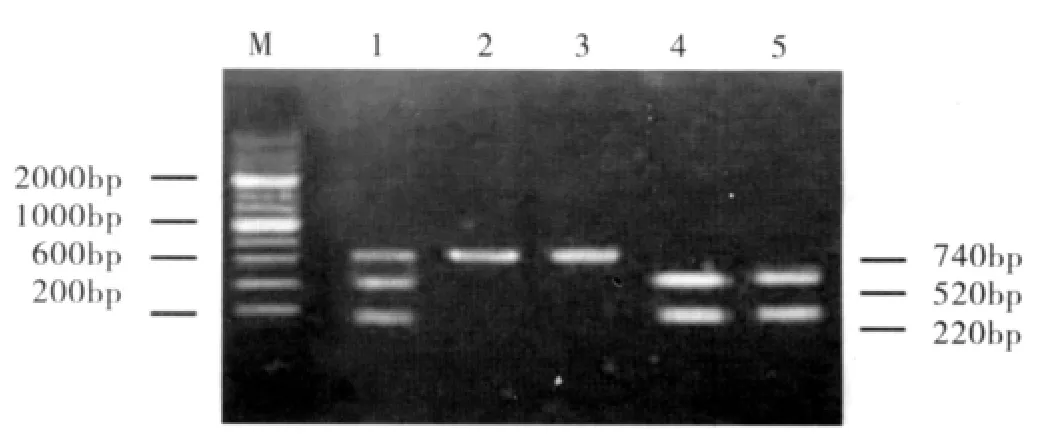
图1 VDR基因Apa I多态性PCR-RFLP结果
2.3 白癜风不同分型、分期VDR基因Apa I酶切位点基因型特点 统计显示:寻常型白癜风34例中,AA基因型 2例 (5.88%),Aa基因型 7例(20.59%),aa基因型25例(73.53%);节段型白癜风12例中AA基因型1例(8.33%),Aa基因型3例(25%),aa基因型 8例(66.67%)。经 χ2分析,χ2=0.214,P=0.899。
进展期白癜风26例中,AA基因型2例(7.69%),Aa基因型5例(19.23%),aa基因型19例(73.08%);稳定期白癜风20例中AA基因型1例(5%),Aa基因型 5例(25%),aa基因型 14例(70%)。经 χ2分析,χ2=0.315,P=0.854。提示白癜风患者的不同分期及不同分型与VDR基因多态性的关系不明显。
2.4 白癜风VDR基因Apa I酶切位点多态性与体液免疫水平的关系 见表3,白癜风患者血清IgA水平显著低于正常对照组(t=3.45,P<0.01),补体水平显著低于正常对照组(t=3.42,P<0.01);其中Aa、aa基因型组血清IgA水平显著低于正常对照组(t=3.544,3.445,P<0.05 与 P<0.01)。提示白癜风 I gA的降低可能主要由Aa、aa基因型实现;进一步检测显示aa基因型患者补体C3水平显著低于正常对照组(t=3.417,P<0.01),提示白癜风色素缺失性的损伤可能存在补体的参与。
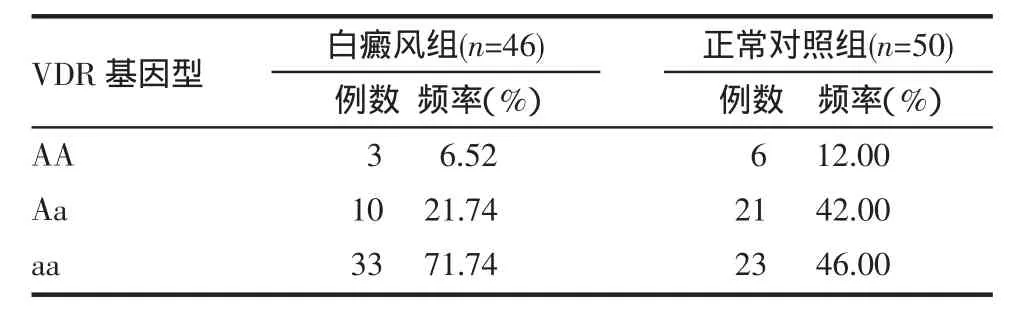
表1 白癜风患者VDR基因的Apa I酶切位点多态性
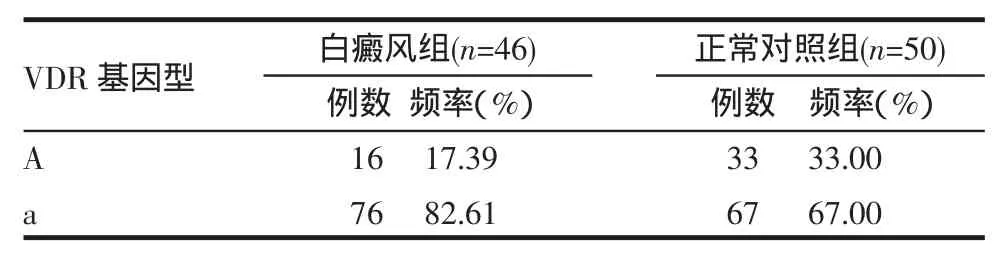
表2 白癜风患者VDR基因的Apa I酶切位点等位基因分布频率的分析
2.5 白癜风VDR基因Apa I酶切位点多态性与细胞免疫水平的关系 见表4,白癜风患者血清CD3+T淋巴细胞水平显著低于正常对照组(t=2.99,P<0.01);其中aa基因型组CD3+T淋巴细胞水平显著低于正常对照组(t=2.37,P<0.05)。提示CD3+T淋巴细胞水平的降低,尤其是aa基因型CD3+T淋巴细胞水平的降低可能与白癜风发表存在一定关系。
表3 白癜风VDR基因Apa I酶切位点多态性与体液免疫水平的关系(±s)
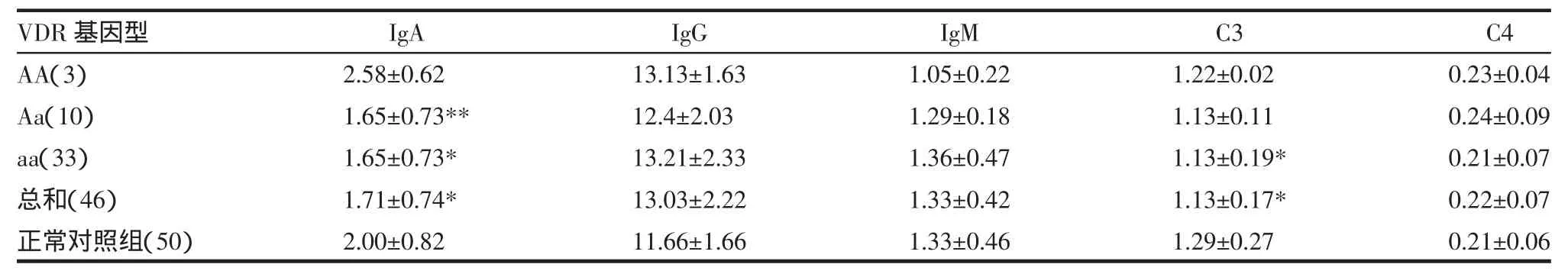
表3 白癜风VDR基因Apa I酶切位点多态性与体液免疫水平的关系(±s)
注:与正常对照组比较 **P<0.05,*P<0.01。
IgA 2.58±0.62 1.65±0.73**1.65±0.73*1.71±0.74*2.00±0.82 IgG 13.13±1.63 12.4±2.03 13.21±2.33 13.03±2.22 11.66±1.66 IgM 1.05±0.22 1.29±0.18 1.36±0.47 1.33±0.42 1.33±0.46 VDR基因型AA(3)Aa(10)aa(33)总和(46)正常对照组(50)C3 1.22±0.02 1.13±0.11 1.13±0.19*1.13±0.17*1.29±0.27 C4 0.23±0.04 0.24±0.09 0.21±0.07 0.22±0.07 0.21±0.06
表4 白癜风VDR基因Apa I酶切位点多态性与细胞免疫水平的关系(±s)
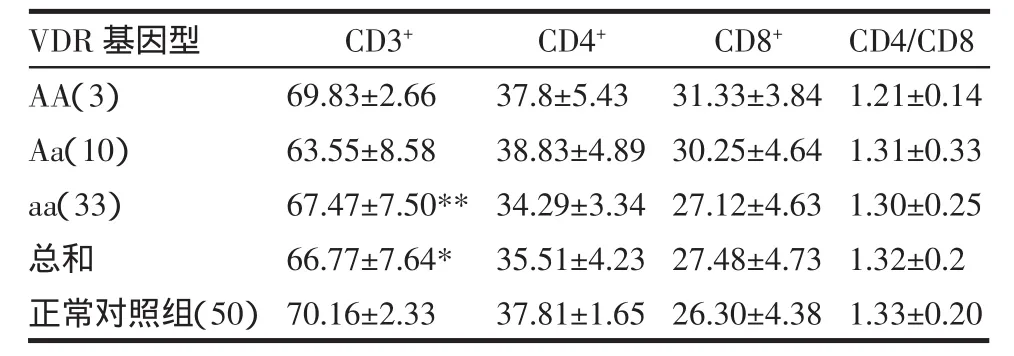
表4 白癜风VDR基因Apa I酶切位点多态性与细胞免疫水平的关系(±s)
注:与正常对照组比较 **P<0.05,*P<0.01。
CD3+69.83±2.66 63.55±8.58 67.47±7.50**66.77±7.64*70.16±2.33 CD4+37.8±5.43 38.83±4.89 34.29±3.34 35.51±4.23 37.81±1.65 CD8+31.33±3.84 30.25±4.64 27.12±4.63 27.48±4.73 26.30±4.38 VDR基因型AA(3)Aa(10)aa(33)总和正常对照组(50)CD4/CD8 1.21±0.14 1.31±0.33 1.30±0.25 1.32±0.2 1.33±0.20
3 讨论
维生素 D 受体(VDR) 是介导 1,25-(OH)2-VitD3,发挥生物效应的核内生物大分子,人类维生素D受体(VDR)基因位于常染色体12q12-14,是亲核蛋白,由427个氨基酸残基组成,系雌激素、糖皮质激素、甲状腺素和维甲酸类蛋白受体基因超家族成员,它们可直接调节基因的转录过程。以往研究表明VDR基因多态性与多种疾病有非常密切的关系[6]。研究表明,皮肤角质形成细胞与黑素细胞均表达VDR,1,25(OH)2D3是通过VDR结合作用于靶组织而发挥生物效应,因而推测VDR基因的变异可能影响维生素D3生物效应的发挥,VDR基因型的不同可能对维生素D3生物效应有一定影响[7,8]。1,25(OH)2D3参加黑素合成的调节,它可致酪氨酸酶活性增加。近几年来国内外报道应用1.25(OH2)D维生素D3类软膏(卡泊三醇)外用并联合口服补骨脂素加UVA治疗白癜风效果显著[9]。由于黑素细胞能表达1.25(OH2)D3受体,该受体与调节黑素合成有关;而白癜风皮损区整个表皮单位钙的内在稳定性受损,即角质形成细胞摄钙与黑素细胞钙离子转运障碍。细胞内钙减少导致硫氧还原蛋白浓度增加,从而抑制了酪氨酸酶活性。故卡泊三醇可能通过黑素细胞上的维生素D3受体或调节细胞内钙紊乱而发挥作用,促使黑素细胞体积增大,树枝状突增多,分泌黑素颗粒。体外实验亦显示维生素D3可加强酪氨酸酶活性和黑素产量[10]。虽然外用卡泊三醇并联合口服补骨脂素加UVA治疗白癜风效果较好,但仍有一些病人效果不佳[11],因此推测VDR基因型的不同可能对治疗效果有一定影响。研究表明白癜风进展期患者VDR表达水平降低[7],VDR基因多态性与多种自身免疫性疾病和肿瘤有密切关系,国外曾报导了VDR基因型的不同与糖尿病、绝经妇女患骨质疏松症危险性以及银屑病发生的早晚严重程度有关[12]。我们的研究结果表明白癜风患者和正常对照组的VDR Apa I位点基因型分布有统计学差异,aa基因型在白癜风患者中出现的频率要高于正常对照组;而白癜风节段型与寻常型患者、进展期与稳定期患者VDR Apa I位点基因型分布无统计学差异,与杨励等研究报道结果相符[13]。白癜风在体液免疫中主要涉及黑素细胞相关的自身抗体。细胞免疫则是有体内T淋巴细胞发挥特异性免疫效应所致的黑素细胞破坏或损伤[14]。IgA是一类具有α链的免疫球蛋白。IgA水平降低可见于自身免疫性疾病,肾病综合征,慢性淋巴细胞白血病等。我们结果显示Aa、aa基因型白癜风患者外周血免疫球蛋白IgA水平明显低于正常对照组(P<0.05,P<0.01),补体 C3 活性明显低于健康组(P<0.01),说明白癜风患者存在体液免疫学的异常。
关于白癜风患者外周血T淋巴细胞的确切变化,目前报道的结果多不一致。研究发现白癜风的细胞免疫学异常主要表现在外周血CD4+T细胞减少,而局部浸润却以CD8+T细胞为主。本研究显示aa基因型白癜风患者外周血CD3+T细胞百分比明显低于正常对照组(P<0.01)与文献报道结果相符[15]。说明白癜风患者T细胞亚群失衡和细胞免疫功能异常,支持细胞免疫机制参与白癜风的发病过程这一学说。据此,我们推测存在VDR基因aa基因型的白癜风患者可能通过影响免疫功能,进而增加白癜风的易感性。
VDR基因多态性与白癜风有一定的关系,其中aa基因型个体患白癜风的风险较高,且白癜风高危基因型可能影响个体的免疫功能进而致病。这对阐明白癜风的发病机理,了解其基因背景及其与免疫学异常的相互关系有非常重要的价值,对开发和评估维生素D类白癜风治疗制剂具有重要的指导意义。
[1] 王侠生,廖康煌.杨国亮皮肤病学[M].上海:上海科学技术文献出版社,2005:650-655.
[2]Birlea S,Birlea M,Cimponeriu D,et al.Autoimmune diseases and vitamin D receptor Apa-Ipolymorphism are associated with vitiligo inasmallinbred Romanian community[J].ActaDerm Venereol,2006,86:209-214.
[3] 席卫平,杨建平,李连青,等.维生素D受体基因ApaI位点多态性与维生素D缺乏性佝偻病的研究[J].中华儿科杂志,2005,43(7):514-516.
[4] 白癜风临床分型及疗效标准.中国中西医结合学会皮肤性病专业委员会色素病学组(2003年修订稿)[J].中华皮肤科杂志,2004,37(7):440.
[5] Gross C,Eccleshall TR,Malloy PJ,et al.The presence of a polymorphism at the translation initiation site of the vitamin D receptor gene is associated with low bone mineral density in postmenopausalMexican-Americanwomen[J].JBoneMinerRes,1996,11:1850-1855.
[6] Uitterlinden AG,Fang Y,Van Meurs JB,etal.Geneticsand biology ofvitamin D receptor polymorphisms[J].Gene,2004,338:143-156.
[7] 佟春光,张文娟,朱铁君.白癜风皮损VDR表达水平的研究[J].中国皮肤性病学杂志,2001,15(4):217-219.
[8]Watabe H,Soma Y,Kawa Y,et al.Differentiation of murine melanocyte precursors induced by 1.25-dihydroxyvitamin D3 is associated with the stimulation of endothelin B receptor expression[J].JInvestDermatol,2002,119:583-589.
[9] 祁怀山,李志刚.他卡西醇软膏联合窄谱中波紫外线治疗白癜风临床疗效观察[J].临床皮肤科杂志,2004,33(10):167-181.
[10] Chiavérini C,Passeron T,Ortonne JP.Treatment of vitiligo by topical calcipotriol[J].JEur Acad Dermatol Venereol,2002,16:137-138.
[11] K觟se O,Riza gür A,Kurumlu Z,et al.Calcipotriol ointment versus clobetasol ointment in localized vitiligo:an open,comparative clinical trial[J].Int JDermatol,2002,41:616-618.
[12] Holick MF.Vitamin D:importance in the prevention of cancers,type 1 diabetes,heartdisease,and osteoporosis[J].Am JClin Nutr,2004,79:368-371.
[13] 杨励,王雷,孙林潮,等.维生素D受体基因多态性与白癜风的相关性研究[J].中国美容医学,2007,16(3):302-304.
[14] Passeron T,Ortonne JP.Physiopathology and geneticsofvitiligo[J].J Autoimmun,2005,25 Suppl:63-68.
[15] 张继玲,曹碧兰.白癜风免疫学说新进展[J].遵义医学院学报,2006,29(4):403-407.
