HPLC测定山楂叶中牡荆素-4″-O-葡萄糖苷、牡荆素鼠李糖苷、牡荆素、芦丁、金丝桃苷的含量
2011-05-26赵彩云
赵彩云, 王 强
(1.江苏省徐州药品检验所,江苏徐州 221006;2.中国药科大学,江苏南京 210009)
山楂叶为蔷薇科山楂属植物山里红(Crataegus pinnatifidaBge.var.majorN.E.Br.)或山楂(C.pinnatifidaBge.)的干燥叶[1],收载于《中国药典》2010年版一部。到目前为止,已经从山楂的叶中分离鉴定了50余种化学成分[2],包括黄酮类、三萜类、原花青素类和有机酸类等。现代药理实验表明,山楂叶具有降血脂、改善冠脉流量保护心肌、抑制血小板聚集和清除自由基、抗氧化等作用[3-6],黄酮类化合物是山楂叶生理活性的主要成分包括牡荆素、牡荆素-4″-O-葡萄糖苷、牡荆素鼠李糖苷、芦丁、槲皮素、金丝桃苷等。本实验用HPLC法对山楂叶中黄酮类成分牡荆素鼠李糖苷、牡荆素-4″-O-葡萄糖苷、牡荆素、芦丁、金丝桃苷进行了含量测定方法学的研究。结果表明该测定方法准确、灵敏、重现性好。
1 仪器与试药
1.1 仪器
Waters高效液相色谱仪(Waters 2695泵、Waters 2996PDAD检测器和Empower色谱工作站),JL-360超声波清洗器(上海杰理科技有限公司),AE240电子天平(梅特勒-托利多仪器有限公司)。
1.2 试药
对照品:牡荆素鼠李糖苷(111668-200401)、金丝桃苷(111521-200303)、芦丁(100080-200306)、牡荆素(111687-200501)均购自中国药品生物制品检定所,牡荆素-4″-O-葡萄糖苷(中国药科大学中药分析教研室提供,纯度为99%);山楂叶(来源见表1),经王强教授鉴定为蔷薇科植物山里红Crataegus pinnatifidaBge.var.majorN.E.Br.的叶。
乙腈、四氢呋喃均为色谱纯,水为重蒸水,其余试剂均为分析纯。
2 方法与结果

表1 山楂叶药材来源Tab.1 Habitats of Hawthorn leaves
2.1 色谱条件
色谱柱:Sepax HP C18柱(4.6 mm ×250 mm,5 μm);流动相:A 为乙腈-四氢呋喃(20∶1),B 为0.5%甲酸溶液,采用梯度洗脱;0~10 min,A为14% ~17%;10~26 min,A 为17% ~18%;26~28 min,A为18% ~14%;检测波长:360 nm,流速:1.0 mL/min;柱温:32℃;进样量:10 μL。混合对照品和供试品色谱图见图1。
2.2 对照品溶液的制备
精密称取牡荆素-4″-O-葡萄糖苷、牡荆素鼠李糖苷、牡荆素、芦丁、金丝桃苷对照品适量,加甲醇溶解配制成浓度分别为 0.662 0、0.997 0、0.042 3、0.097 3、0.095 4 mg/mL的混合溶液,作为对照品贮备液。精密吸取对照品贮备液3 mL置10 mL的量瓶中,加甲醇稀释至刻度,作为混合对照品溶液。
2.3 供试品溶液的制备
取样品粗粉约1.5 g,精密称定,置具塞锥形瓶中,精密加入50%甲醇溶液25 mL,密塞,称定重量,超声处理(功率250 W,频率50 kHz)30 min,放冷至室温,再称定重量,用50%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。
2.4 线性关系考察

图1 混合对照品(A)和供试品溶液(B)色谱图Fig.1 HPLC chromatograms of mixed referencesubstances(A)and sample solution(B)
精密吸取对照品贮备液0.5、1、2、3、4、5、6 mL置10 mL量瓶中,加甲醇稀释至刻度。按上述色谱条件测定峰面积,以进样浓度为横坐标(X),峰面积为纵坐标(Y),进行线性回归,得回归方程分别为Y牡荆素-4″-O-葡萄糖苷=1.28 × 104X+7.91 × 104,r=0.999 6,Y牡荆素鼠李糖苷=1.24 ×106X+1.20 ×105,r=0.999 2,Y牡荆素=1.49 × 104X- 3.03 × 103,r=0.999 8,Y芦丁=1.68 × 105X- 7.43 × 102,r=0.999 8,Y金丝桃苷=2.09 × 104X- 7.05 × 103,r=0.999 9。结果表明:牡荆素-4″-O-葡萄糖苷在33.10~397.2 μg/mL范围内,牡荆素鼠李糖苷在49.80~598.2 μg/mL 范围内,牡荆素在 0.21 ~2.54 μg/mL范围内;芦丁在4.86~58.4 μg/mL范围内;金丝桃苷在4.77~57.2 μg/mL范围内呈良好的线性关系。
2.5 精密度试验
精密吸取混合对照品溶液10 μL平行测定6次,测得牡荆素-4″-O-葡萄糖苷、牡荆素鼠李糖苷、牡荆素、芦丁、金丝桃苷峰面积RSD分别为0.99%、0.73%、0.99% 、1.23% 、0.85% 。
2.6 稳定性试验
精密吸取同一供试品溶液分别于0、2、4、6、8、12 h进样,测定峰面积,测得牡荆素-4″-O-葡萄糖苷、牡荆素鼠李糖苷、牡荆素、芦丁、金丝桃苷峰面积RSD分别为 0.78%、0.88%、0.83%、0.65%、0.72%。表明供试品溶液在12 h内稳定。
2.7 重复性试验
精密称取同一批样品5份,分别按供试品溶液制备方法制备,测定样品中各成分的含量,牡荆素-4″-O-葡萄糖苷、牡荆素鼠李糖苷、牡荆素、芦丁、金丝桃苷含量RSD分别为0.86%、0.98%、0.76%、0.84%、1.23%。表明方法重现性较好。
2.8 加样回收率测定
精密称取已知各成分含量的供试品S1 0.75 g,精密加入一定量的牡荆素-4″-O-葡萄糖苷、牡荆素鼠李糖苷、牡荆素、芦丁、金丝桃苷对照品,平行试验5次,按2.3项下方法制备,测定相应峰面积,计算含量和回收率,结果:牡荆素-4″-O-葡萄糖苷、牡荆素鼠李糖苷、牡荆素、芦丁、金丝桃苷平均加样回收率分别为 99.59%、99.57%、98.70%、99.35%、99.28%;RSD分别为 0.50%、0.96%、1.10%、1.16%、0.88%。见表2~6。

表2 牡荆素-4″-O-葡萄糖苷回收率试验结果Tab.2 Result of recovery test for vitexin 4″-O-glucoside

表3 牡荆素鼠李糖苷回收率试验结果Tab.3 Result of recovery test for vitexin rhamnoside

表4 牡荆素回收率试验结果Tab.4 Result of recovery test for vitexin
2.9 样品测定
分别取不同采集地的山楂叶,按供试品溶液制备方法,平行制备3份,分别精密吸取混合对照品溶液及供试品溶液各10 μL,测定,按外标法计算含量,结果见表7。

表5 芦丁回收率试验结果Tab.5 Result of recovery test for rutin
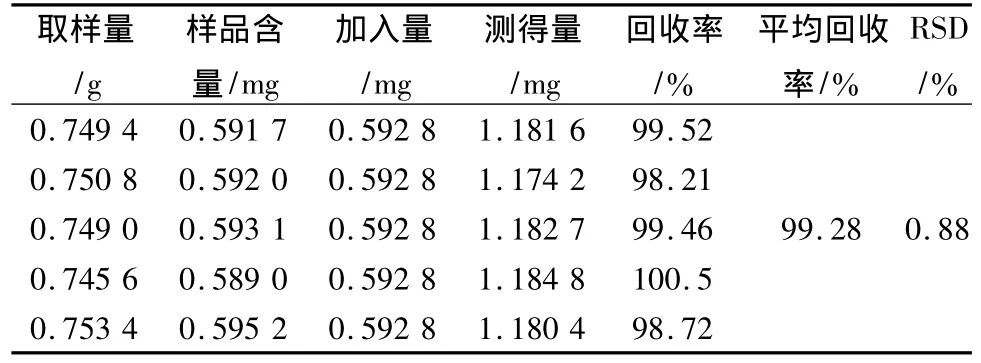
表6 金丝桃苷回收率试验结果Tab.6 Result of recovery test for hyperoside
3 讨论
3.1 通过对5个对照品LC-PDAD紫外吸收波长的扫描可知,5 种成分分别在 350、335、360、335、360 nm处有最大吸收,考虑到5个组分要在一个色谱系统中同时检出又要使样品中各个成分有较大的响应值,且其他成分对其干扰较少,参阅有关文献[1,7-9],选择360nm作为检测波长,在该波长处5个组分均有较强吸收,干扰少,且分离效果良好。
3.2 曾试用甲醇-水、乙腈-水、乙腈-甲酸(乙酸)进行不同等度洗脱和梯度实验,结果表明,在乙腈-甲酸的系统中加入四氢呋喃,既可以使相关峰达到有效分离,又可改善目标化合物的峰拖尾现象。因此选择乙腈-四氢呋喃-甲酸作为流动相。

表7 样品含量测定结果(n=3)Tab.7 Analytical results of samples
3.3 《中国药典》2010年版一部收载了山楂叶,其质控指标成分为总黄酮及金丝桃苷。从结果可以看出金丝桃苷虽为主要活性成分之一,但含量非常低(药典规定应不少于0.050%)。研究表明:牡荆素鼠李糖苷具有扩张血管、保护损伤的心肌组织等作用[10],与山楂叶的功效作用相一致,因此,仅选择金丝桃苷作为质控指标值得商榷,而牡荆素4″-O-葡萄糖苷、牡荆素鼠李糖苷为山楂叶中重要的药理活性成分,含量较高,且为专属性成分,更适宜作为山楂叶的质控指标。
[1]中国药典[S].一部.2010:30.
[2]陈四平,臧亚茹.山楂叶的研究进展[J].承德医学院学报,2003,20(2):164-165.
[3]张文洁,杨 英,张 辉.山楂叶提取物对高血脂大鼠的影响[J]. 辽宁中医杂志,2008,35(2):307-308.
[4]叶希韵,张 隆,张 静,等.山楂叶总黄酮对乳鼠心肌细胞
