血小板活化因子引起肠上皮细胞屏障非凋亡依赖性的通透性增高
2011-05-25许玲芬郭静滕旭孙梅
许玲芬,郭静,滕旭,孙梅
(中国医科大学附属盛京医院儿科,沈阳 110004)
肠上皮细胞屏障是机体最重要的免疫防御屏障,是肠黏膜具有选择性通透的基础,用以维持机体内环境的稳定。目前发现肠上皮细胞的通透性增高与多种急慢性疾病的发病机制相关[1],如:炎症性肠病[2]、败血症[3]、烧伤、终末期肝病[4]、重症胰腺炎,甚至湿疹、食物过敏、1型糖尿病[5]、哮喘等。研究发现[6]血小板活化因子(platelet-activating factor,PAF)可以由肠上皮细胞产生,存在于正常的小肠组织,并调节黏膜的通透性。当给予小剂量PAF,在不足以引起肠损伤的情况下,可以增加肠黏膜的通透性,触发细胞因子和转录因子的活化[7]。因此,PAF被认为是肠上皮屏障通透性增加的关键因素,但具体作用机制和方式还不明了。
本实验应用Caco-2细胞建立体外肠上皮细胞屏障模型,观察PAF对其通透性的影响和超微结构的改变,以探讨PAF调节肠上皮细胞屏障的作用位点和作用机制。
1 材料与方法
1.1 细胞系、主要仪器及试剂
人结肠腺癌细胞株(Caco-2)购于中国科学院上海细胞所,由ATCC引进。主要仪器试剂有:Transwell(Corning,美国);EVOM(Millipore,美国);荧光分光光度计(日立,日本);流式细胞仪(BD,美国)。DMEM培养基、胰酶和胎牛血清(fatal bovine serum,FBS)购自 Gibco公司;PAF、荧光黄购自 Sigma公司;细胞凋亡-Hoechst染色试剂盒由上海碧云天生物有限公司提供;Annexin V-EGFP细胞凋亡检测试剂盒由南京凯基生物科技发展有限公司提供。
1.2 方法
1.2.1 细胞培养:Caco-2细胞培养于DMEM培养基,含15%进口胎牛血清,1%青链霉素双抗液,通入5%CO2(相对湿度90%),置37℃培养箱,传代后7 d左右细胞生长达到融合开始进行实验,每种实验均选取3组非同代细胞进行。
1.2.2 肠上皮细胞屏障的建立:细胞接种于Transwell板上(直径6.5 mm,孔径0.4μm),接种密度为5×104/cm2,约 14~21 d,细胞形成紧密单层,跨上皮细胞电阻(transepithelial electrical resistance,TEER)明显升高,证明肠上皮细胞屏障形成,进行后续实验。
1.2.3 肠上皮细胞屏障通透性的检测:Caco-2细胞形成单层上皮细胞屏障后,无血清培养24 h,在Transwell顶侧加入不同浓度的 PAF(0,10,50,100,200 nmol/L)孵育24 h,检测TEER及荧光黄透过量。
(1)TEER的测定:应用EVOM参照文献[8]测定Caco-2细胞的TEER。整个过程在恒定温度下(37℃)进行,每个Transwell均取不同方向的3个点,重复测定3次,取平均值即为该样品的TEER值,以Ω/cm2表示;因为Transwell膜本身也具有一定的TEER,因此标准的TEER应将样品的实测TEER值减去空白对照的TEER值。
(2)荧光黄透过量的检测:细胞用HBSS(pH7.4)小心冲洗3次,37℃孵育30 min,吸净孔内的HBSS以防止干扰;在Transwell顶端加入80μg/ml荧光黄,37℃孵育1 h后收集基底侧液体,荧光分光光度计下测定吸光度(激发波长427 nm,发射波长536 nm),根据标准曲线计算荧光黄浓度,结果以荧光黄的清除率表示。
Cl[nl/(h·cm2)]=Lab/([LY]a×S)
Cl为清除率;Lab为顶侧向基底侧的荧光黄透过量;[LY]a为荧光黄的基础量;S为 Transwell面积。
1.2.4 Annexin V-EGFP检测细胞凋亡:各组加入处理因素后,采用Annexin V-EGFP/PI双染色法,按照试剂盒操作步骤收集细胞、处理样本,于荧光显微镜下观察并拍照,Annexin V-EGFP荧光信号呈绿色,PI荧光信号呈红色;用流式细胞仪检测,激发波长Ex=488 nm;发射波长Em=530 nm。Annexin V-EGFP的绿色荧光通过FL1通道检测;PI红色荧光通过FL2通道检测。
1.2.5 Hoechst染色检测细胞凋亡:各组加入处理因素后,采用Hoechst染色,按照试剂盒操作步骤收集细胞、处理样本,于荧光显微镜下观察并拍照,可检测到呈蓝色的细胞核。激发波长Ex=350 nm;发射波长Em=460 nm。
1.2.6 透射电镜下观察紧密连接(tight junction,TJ):Caco-2细胞于2.5%戊二醛固定后,按常规病理学方法固定、脱水、包埋、切片后,醋酸铀、柠檬酸铅双染,透射电镜下观察上皮细胞间紧密连接的变化。
1.3 统计学分析
所有实验均重复3次以上,结果用x±s表示,统计由SPSS13.0软件完成。采用One-Way ANOVA法比较组间差异,P<0.05为差异有统计学意义。
2 结果
2.1 利用Caco-2细胞建立肠上皮细胞屏障
Caco-2细胞随着培养时间的延长,逐渐融合成片,成单层生长,光镜下呈多角形、不规则多边形或鹅卵石样,相邻细胞连接紧密,可见致密的反光带(图1A)。至21 d左右,细胞形成紧密单层,TEER值达到300~400Ω/cm2,对荧光黄透过量很小。电镜下发现细胞呈高分化,细胞间形成紧密连接,呈致密的带状结构,绒毛整齐,极性形成,成单层排列(图1B)。体外肠上皮细胞屏障建立。

图1 C aco-2单层上皮细胞Fig.1 C aco-2 epithelialcellmonolayer
2.2 PAF对Caco-2单层细胞TEER的影响
不同浓度PAF作用24 h后,TEER值下降,以100 nmol/L组下降最为明显,与对照组比较,差异有统计学意义(P<0.01),提示PAF可以降低Caco-2细胞的TEER,但PAF浓度继续增加(200 nmol/L)TEER并没有继续降低,与对照组比较,差异有统计学意义(P<0.05)(图 2)。
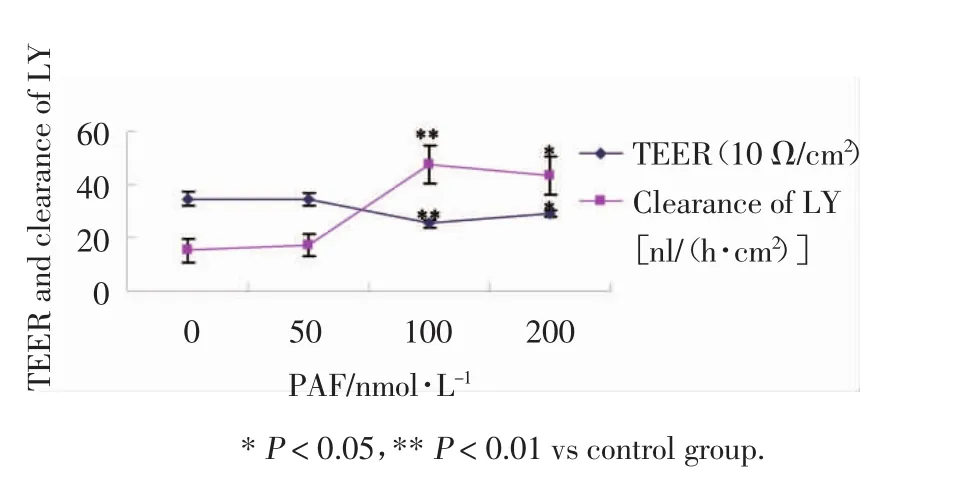
图2 不同浓度P A F对C aco-2单层上皮细胞T EE R和荧光黄透过量的影响Fig.2 Effect of different concentrations of P A F on T EE R and lucifer yellow flux in C aco-2 epithelialcellmonolayer
2.3 PAF作用Caco-2单层细胞后对荧光黄透过量的影响
正常Caco-2细胞对荧光黄的透过量很低,加入PAF后,从50 nmol/L开始,荧光黄的透过量即增加,但与正常对照组比较差异无统计学意义,PAF 100 nmol/L组荧光黄的透过量明显增加,与对照组比较差异有统计学意义(P<0.01)。随PAF的浓度继续增加(200 nmol/L),荧光黄的透过量并未继续增加(P<0.05)(图 2)。
2.4 PAF对细胞凋亡的影响

图3 A nnexin V-E G FP检测细胞凋亡的发生Fig.3 A poptosis detected by A nnexin V-E G FP

图4 H oechst细胞凋亡染色×400Fig.4 A poptosis detected by H oechst staining×400
应用Annexin V和Hoechst染色试剂盒,应用荧光显微镜和流式细胞仪检测,均未发现给予PAF后出现明显的细胞凋亡增加(图3,4)。
2.5 PAF破坏肠上皮细胞间的紧密连接
在正常Caco-2细胞,紧密连接位于细胞膜外侧面的顶端,呈致密的带状结构,相邻细胞膜之间贴和紧密,没有缝隙(图5A)。加入PAF 100 nmol/L作用24 h后,紧密连接结构破坏、断裂,细胞间隙增宽,并可见细胞表面微绒毛脱落、稀疏(图5B)。这些现象提示PAF可以破坏Caco-2细胞间的紧密连接,影响细胞极性。

图5 透射电镜下C aco-2细胞超微结构改变(箭头所指为紧密连接,×4 000)Fig.5 U ltrastructural changes in C aco-2 cells(arrows show the tight j unction,×4 000)
3 讨论
PAF是一种内源性脂性介质,具有广泛的生物学特性。研究认为PAF在诸多参与胃肠黏膜损害的炎性介质中可能起到“中心放大”的介导作用。动物实验证实PAF可引起肠黏膜通透性的增高[9]。用PAF和LPS引起的坏死性小肠结肠炎的改变相似,用PAF受体拮抗剂可明显减轻LSP所致的肠坏死。也有实验认为PAF对内毒素性休克有保护作用[10]。但PAF是否可以直接引起肠上皮细胞屏障通透性增高尚不清楚。
本实验利用Caco-2细胞建立体外肠上皮细胞屏障模型,应用TEER和特异性经细胞旁转运的物质荧光黄作为标志物,联合检测了PAF对肠上皮细胞屏障通透性的影响。结果表明PAF50 nmol/L即可引起TEER的下降和荧光黄透过率的增加,PAF100 nmol/L达到高峰,但PAF浓度继续增大(200 nmol/L)却并未引起损伤的进一步加重。表明一定浓度的PAF确实可以直接引起肠上皮细胞屏障通透性增高。
肠上皮细胞屏障主要由两部分组成,即肠黏膜上皮细胞及其周围的紧密连接。物质通过肠上皮细胞有两种途径:一种为跨细胞途径,另一种为旁细胞途径。上皮细胞的凋亡增加势必损害肠黏膜结构的完整性,而旁细胞途径的通透性高低则与细胞连接的状态有关。
细胞凋亡早期的一个特征性变化是细胞膜的不对称性丧失。在正常细胞中,磷脂酰丝氨酸(phosphatidylserine,PS)只分布在细胞膜脂质双层的内侧,而在细胞凋亡早期,细胞膜中的PS由脂膜内侧翻向外侧。Annexin V是一种分子量为35~36 kDa的Ca2+依赖性磷脂结合蛋白,与PS有高度亲和力,与凋亡早期细胞的胞膜结合,因此,Annexin V被作为检测细胞早期凋亡的灵敏指标之一,是目前最为理想的凋亡定量检测方法[11]。另外,细胞发生凋亡时,染色质会固缩,用Hoechst染色时,细胞核会呈致密浓染,或呈碎块状致密浓染,是一种快速简便的检测细胞凋亡的方法。通过细胞膜和细胞核染色联合检测细胞凋亡的发生,发现即使大剂量的PAF也未出现明显的细胞凋亡增加。故本结果倾向于PAF引起的细胞屏障通透性增加是凋亡非依赖性的,其作用位点在旁细胞途径。
透射电镜观察PAF对Caco-2细胞TJ形态学的影响,发现TJ在电镜下表现为细胞膜表面不连续的吻合点。正常Caco-2细胞在细胞接触面顶端可见完整的紧密连接,加入PAF100 nmol/L作用24 h后,TJ发生断裂,并可见细胞表面微绒毛脱落、稀疏,细胞内吞饮小泡增多。这些现象说明:PAF可以破坏Caco-2细胞间的紧密连接,影响细胞极性。
总之,本研究结果显示PAF可直接引起肠上皮细胞屏障通透性增加,该作用是凋亡非依赖性的,作用位点在旁细胞途径,为进一步的机制研究提供了有力依据。
[1]Liu Z,Li N,Neu J.Tight junctions,leaky intestines,and pediatric diseases[J].Acta Padiatrica,2005,94(4):386-393.
[2]McGuckin MA,Eri R,Simms LA,et al.Intestinal barrier dysfunction in inflammatory bowel diseases [J].Inflamm Bowel Dis,2009,15(1):100-113.
[3]Tsujimoto H,Onso S,Mochizuki H.Role of translocaion of pathogen associated molecular patterns in sepsis[J].Dig Surg,2009,26(2):100-109.
[4]崔巍,马力,闻颖,等.暴发性肝衰竭时肠上皮细胞间紧密连接蛋白 Occludin 表达下降 [J].世界华人消化杂志,2006,14(31):3008-3012.
[5]Watts T,Berti I,Sapone A,et al.Role of theintestinal tight junction modulator zonulin in the pathogenesis of type I diabetes in BB diabetic-prone rats[J].Proc Natl Acad Sci USA,2005,102(8):2916-2921.
[6]Hudry-Clergeon H,Stengel D,Ninio E,et al.Platelet-activating factor increases VE-cadherin tyrosine phosphorylation in mouse endothelial cells and its association with the PtdIns3'-kinase[J].FASEBJ,2005,19(6):512-520.
[7]Liu SX,Tian R,Baskind H,et al.Platelet-activating factor induces theprocessingof nuclear factor-kappa B p105 into p50,which mediates acutebowel injury in mice [J].Am JPhysiol Gastrointest Liver Physiol,2009,297(1):G76-G81.
[8]Schmitz H,Fromm M,Bentzel CJ,et al.Tumor necrosis factor-alpha(TNF)regulates the epithelial barrier in the human intestinal cell line HT-29/B6[J].JCell Sci,1999,112(Pt1):137-146.
[9]Tan XD,Chang H.Platelet-activating factor increases mucosal permeability in rat intestine via tyrosine phosphorylation of E-cadherin[J].Br JPharmacol,2000,129(7):1522-1529.
[10]Jeong YI,Jung ID,Lee CM,et al.The novel role of platelet-activatingfactor in protectingmiceagainst lipopolysaccharide-induced endotoxic shock[J].PLoSOne,2009,4(8):e6503.
[11]Liang F,Gao E,Tao L,et al.Critical timingof L-arginine treatment in post ischemic myocardial apoptosis role of NOS isoforms[J].Cardiovasc Res,2004,62(3):568-577.
