Occludin蛋白在重症急性胰腺炎小鼠肠上皮细胞的表达
2011-05-25吴善斌王学清郭鸿飞王孟春
吴善斌,王学清,郭鸿飞,王孟春
(中国医科大学附属盛京医院消化内科,沈阳 110004)
重症急性胰腺炎(severe acute pancreatitis,SAP)是一种常见的临床急腹症,常常并发胰腺组织细菌感染和与感染相关的全身炎性反应综合征和多器官功能障碍综合征,其病情凶险,病因复杂,预后不良,有报道死亡率高达20%~30%[1]。患者往往死于继发感染和多脏器功能衰竭。
已有研究表明,多数的胰腺和胰周组织感染是由移位的肠道细菌及内毒素所致的肠源性感染,肠道是引发感染细菌的主要来源[2]。SAP时肠屏障功能损伤,通透性增加,可能是导致肠道细菌及内毒素发生移位的主要原因[3,4]。occludin蛋白是肠屏障的重要组成部分,目前已有occludin蛋白与暴发性肝功能衰竭相关肠屏障功能障碍、烧伤相关肠屏障损伤方面的研究[5,6]。本实验拟观察小鼠SAP肠上皮损伤时occludin蛋白的表达情况,探讨SAP时肠黏膜屏障功能改变。
1 材料与方法
1.1 实验动物及试剂
雄性昆明种小鼠40只,体质量20~25 g,购自中国医科大学实验动物部。兔抗小鼠occludin抗体(sc-5562,Santa Cruz公司),SP 免疫组化试剂盒、DAB试剂盒(北京中杉金桥公司),L-精氨酸(Sigma公司)。
1.2 方法
1.2.1 SAP小鼠模型制备:小鼠随机分为对照组(n=8)和实验组(n=32)。所有小鼠在实验前禁食12 h,自由饮水。实验组小鼠分2次腹腔注射20%精氨酸(每次剂量2.5 g/kg),注射间隔为1 h。对照组腹腔注射等体积的无菌生理盐水。
1.2.2 取材和固定:实验组小鼠在末次注射后3、6、12和24 h随机各取8只予10%水合氯醛麻醉致死,迅速取出胰腺组织、回盲部3 cm回肠组织,胰腺组织放入10%中性甲醛溶液中固定,光镜下HE染色观察组织形态。部分肠组织放入2.5%戊二醛溶液中4℃固定,部分肠组织放入10%中性甲醛溶液固定。对照组小鼠在末次注射后立即予10%水合氯醛麻醉致死,同样方法取出胰腺及肠组织。
1.2.3 胰腺病理学检查:标本固定于10%中性甲醛溶液,石蜡包埋、切片,进行常规HE染色,光镜观察组织学变化。
1.2.4 电镜观察肠上皮细胞超微结构:将小鼠处死后,立即取回肠,过程在2 min内完成。将回肠用0.1 mol/L磷酸缓冲液洗净,立即浸入2.5%戊二醛液中4℃固定2 h以上。0.1 mol磷酸缓冲液反复清洗3次,每次10~20 min。1%四氧化锇固定液4℃固定2.5 h。0.1 mol/L磷酸缓冲液反复清洗3次,每次5 min。用50%、70%、80%、90%、100%梯度乙醇、丙酮脱水。用纯环氧树脂(Epon)812包埋液,在1∶1、1∶2、1∶3 的丙酮中分别浸泡 3、4、5 h。取出样品,放置包埋模具中,放入60℃烤箱中聚合2 d。取出制成半薄切片(500 nm),甲基蓝染色,光镜下定位,制成超薄切片(50 nm),醋酸双氧铀-柠檬酸铅双重染色,透射电镜观察。
1.2.5 免疫组织化学方法检测肠组织中occludin蛋白的表达:采用免疫组织化学SP法,严格按照说明书进行,进行蛋白表达的半定量分析。每个时间点每组随机抽取不同的切片8张,每张切片于光镜下(×400)随机选取5个视野,固定窗口面积,利用美国Universal Imaging Corporation图像分析系统,应用MetaMorph软件分析平均光密度值。
1.3 统计学分析
数据以x±s表示,应用SPSS13.0软件进行数据分析,组间比较采用LSD方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 胰腺大体及组织学改变
对照组胰腺大体未见明显异常;实验组3 h无明显变化,6 h可见胰腺轻度充血,12 h可见微量腹水,24 h时腹腔可见较多腹水,并见胰腺体积增大、水肿明显,肠道部分充血、扩张(图1)。对照组小鼠的胰腺组织结构清晰,细胞形态正常,无出血坏死;实验组3 h无明显变化,6 h呈现水肿、胰腺炎改变,小叶间隙增宽、炎细胞侵润,但小叶结构完好,腺泡细胞无坏死,12和24 h胰腺小叶结构紊乱,明显充血,腺泡细胞坏死,坏死区周围炎细胞侵润(图2)。

图1 小鼠胰腺大体形态变化Fig.1 G ross changes in mouse pancreas

图2 胰腺病理学变化 ×400Fig.2 Pathological changes in mouse pancreas×400
2.2 电镜下肠上皮细胞超微结构改变
对照组肠黏膜上皮细胞表面微绒毛排列整齐,柱状上皮细胞结构完整,细胞质内细胞器丰富,结构未见异常,细胞间连接紧密;实验组3 h无明显变化,其余各时间点可见微绒毛稀疏、排列不整,部分断裂、脱落,线粒体肿胀,嵴减少,胞质内粗面内质网和高尔基复合体扩张呈空泡变性,内质网扩张,核糖体脱落,胞核形状不规则,核内异染色质浓缩且边集明显,细胞连接增宽,24 h时改变最明显(图3)。
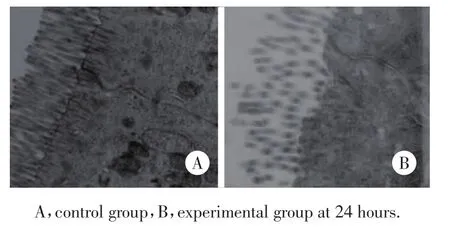
图3 电镜下肠上皮细胞超微结构改变 ×8 000Fig.3 U ltrastructural changes in intestinal epithelial cells observed under electron microscope×8 000
2.3 肠组织中occludin蛋白的表达
对照组occludin蛋白均匀一致地分布于肠上皮细胞连接处的顶端,呈表达很强的棕褐色信号;实验组occludin蛋白表达颜色变淡,分布不均,表达逐渐减弱(图4)。对照组与实验组3、6、12和 24 h occludin蛋白表达的平均光密度值分别为0.344 8±0.002 8,0.343 1±0.002 0,0.342 3±0.001 9,0.339 4±0.001 5,0.309 5±0.002 7,实验组与对照组比较,3 h时差异无统计学意义(P>0.05),6、12和24 h时有统计学差异(P<0.05)。

图4 occludin蛋白在肠组织的表达 ×400Fig.4 Expression of occludin protein in intestinal tissues×400
3 讨论
研究表明SAP时多数的胰腺和胰周组织感染是由移位的肠道细菌及内毒素所致的肠源性感染,肠道是引发感染细菌的主要来源,而肠屏障功能的损伤,可能是导致肠道细菌移位的主要原因。大分子物质包括细菌穿过肠黏膜上皮细胞,一是通过上皮细胞的胞饮作用,另一种是通过细胞旁间隙[7],后者依赖于细胞间连接完整性的破坏。肠上皮细胞间连接由紧密连接、黏附连接、缝隙连接等构成。构成肠上皮细胞间连接的蛋白主要有occludin、claudin、ZO-1 等[8]。occludin 蛋白是紧密连接中重要的结构蛋白,能通过外环以拉链式结合进而产生严密的细胞间连接[9]。有研究表明,缺乏occludin蛋白的成纤维细胞不能形成典型的紧密连接结构[10],occludin蛋白作为构成紧密连接的主要蛋白之一,在维持紧密连接结构方面具有重要作用。目前对烧伤和暴发肝功能衰竭动物模型的研究显示有肠屏障损伤,occludin 蛋白的表达降低[5,6],但有关SAP时肠上皮occludin蛋白表达情况的研究较少。
本研究显示,电镜下观察SAP小鼠肠上皮超微结构,微绒毛稀疏、排列不整,部分断裂、脱落,细胞连接增宽,24 h时改变最明显,表明SAP可导致小鼠肠黏膜屏障损伤。免疫组化显示,对照组occludin蛋白均匀一致地分布于肠上皮细胞连接处的顶端,呈表达很强的棕褐色信号。而实验组3、6、12、24 h时occludin蛋白表达逐渐减弱,颜色变淡,分布不均。免疫组化平均光密度值示实验组与对照组比较3 h时差别无统计学意义,6、12、24 h时有统计学差异。在SAP小鼠模型中,肠上皮occludin蛋白表达降低,24 h时最明显,与肠上皮超微结构改变一致,因而推测肠上皮occludin蛋白表达下调可能导致紧密连接的完整性受到破坏,导致细胞间隙增宽,进而为细菌的穿透提供了可能,引起胰腺和胰周组织感染。SAP时occludin蛋白表达降低可能主要与下列因素有关:(1)炎性介质及细胞因子的释放,研究已发现肿瘤坏死因子α、γ干扰素等炎性因子有协同作用,下调 occludin 蛋白启动子的表达[11];(2)肠道微循环障碍,已有研究发现,停循环低温后家兔脑血管内皮细胞 occludin 表达减少[12];(3)肠道营养障碍,胰腺炎由于禁食及高代谢,导致合成occludin蛋白的营养物质缺乏。但SAP时occuldin蛋白表达降低的确切机制有待于进一步相关实验研究。
[1]Bhatia M,Wong FL,CaoY,et al.Pathophysiology of acute pancreatitis[J].Pancreatology,2005,5(2-3):132-144.
[2]Gerlach H.Risk management in patientswith severe acute pancreatitis[J].Crit Care,2004,8(6):430.
[3]Nettelbladt CG,Katouli M,Bark T,et al.Evidence of bacterial translocation in fatal hemorrhagic pancreatitis[J].Trauma,2000,8(2):314-316.
[4]Juvonen PO,Alhuva EM,Tnkala JA.Gut permeability in patients with acute panereatitis. [J].Scand JGastroenterol,2000,35(12):1314-1318.
[5]Cui W,Wang Y,Ma L,et al.The impact of tumor necrosis factor alpha on expression of intestinal epithelial tight junction protein occludin in fulminant hepatic failuremicemodel[J].Zhonghua Nei Ke Za Zhi,2007,46(6):478-481.
[6]Shao L,Huang Q,He M,et al.Changesof occludin expression in in-testinal mucosaafter burn in rats[J].Burns,2005,31(7):838-844.
[7]Nusrat A,Turner,JR,Madara JL.Molecular physiology and pathophysiology of tight junctionsⅣ Regulation of tight junctions by extracellular stimuli:nutrients,cytokines,and immune cells[J].Am J Physiol Gastrointest Liver Physiol,2000,279(5):G851-G857.
[8]Mazzon E,Sturniolo GC,Puzzolo D,et a1.Effect of stress on the paracellular barrier in therat ileum[J].Gut,2002,51(4):507-513.
[9]Nusrat A,Chen JA,Foly CS,et a1.The coiled-coil domain of occludin can act to organize structural and functioneal elements of the epithelial tight junction[J].JBiol Chem,2000,275(38):29816-29822.
[10]Saitou M,Fujimoto K,Doi Y,et a1.Occludin-deficient embryonic stem cells can differentiate into polarized epithelial cells bearing tight junctions[J].JCell Biol,1998,141(2):397-408.
[11]Mankertz J,Tavalali S,Schmitz H,et al.Expression from the human occluding promoter is affected by tumor necrosis factor alpha and interferon gamma[J].JCell Sci,2000,113(Pt 11):2085-2090.
[12]黄海波,田川,柳磊,等.深低温停循环后家兔脑血管内皮细胞紧密连接蛋白occludin表达变化的实验研究[J].中国分子心脏病学杂志,2009,9(3):155-157.
