紫杉醇对 TRAIL诱导胃癌 SGC7901细胞凋亡的影响
2011-05-23刘言厚刘云鹏曲秀娟汤华丽侯科佐
刘言厚,徐 玲,刘云鹏*,曲秀娟,汤华丽,张 晔,侯科佐
(1庄河市中心医院,辽宁庄河 116400;2中国医科大学附属第一医院)
肿瘤坏死因子相关凋亡诱导配体(TRAIL)能激活细胞膜表面的死亡受体 5(DR5),从而启动内源性、外源性凋亡通路并活化下游的天冬氨酸特异性半胱氨酸蛋白酶,最终诱导细胞凋亡[1]。有研究报道,紫杉醇能改变 DR5的蛋白表达,从而增强前列腺癌细胞对 TRAIL的敏感性[2,3],能否改变胃癌SGC7901细胞对 TRAIL的敏感性鲜见报道。2010年 3~10月,我们观察了紫杉醇对 TRAIL诱导的胃癌 SGC7901细胞凋亡的影响。现报告如下。
1 材料与方法
1.1 材料 胃癌 SGC7901细胞来源来自中国科学院细胞库。重组人 TRAIL购于美国 Cytolab/Peprotech Asia公司,RPMI 1640培养基购于 Gibco公司,胎牛血清购于天津血液病研究所,甲基偶氮唑蓝(MTT)、碘化丙啶(PI)购于 Sigma公司,核糖核酸酶A(RNase A)购于 AMRESCO公司,DR5、Actin抗体购于 Santa Cruz公司,辣根过氧化物酶标记的二抗购于北京中杉金桥生物技术有限公司,ECL显色发光试剂盒购于 PIERCE公司。
1.2 方法
1.2.1 细胞传代培养 将胃癌 SGC7901细胞培养在含有 10%胎牛血清、12 U/ml庆大霉素的 RPMI 1640培养液中,于 37℃、5%CO2饱和湿度的培养箱内培养,0.25%胰酶消化液消化传代。取对数生长期的细胞用于实验。
1.2.2 细胞活力检测 采用 MTT法。将胃癌SGC7901细胞接种于 96孔板内,之后加入 0.10~50.00μg/ml的紫杉醇,或分别加入 TRAIL(100 ng/ml)和紫杉醇(7.19μg/ml)。空白对照组和阴性对照组加入等量的培养液。培养箱内培养 20 h后,每孔加入 5 mg/ml MTT 25μl,孵育 4 h后吸去上清,每孔加入 200μl二甲亚砜,振荡摇匀。用酶标仪于570 nm波长条件下测定吸光度值。按下列公式计算细胞增殖抑制率:增殖抑制率(%)=[1-(处理组平均吸光度值 -空白对照组平均吸光度值)/(阴性对照组平均吸光度值 -空白对照组平均吸光度值)]×100%。
1.2.3 细胞凋亡检测 采用流式细胞仪分析法。将胃癌 SGC7901细胞接种于 6孔板内,之后分别加入 TRAIL(100 ng/ml)和紫杉醇(7.19μg/ml)。24 h后分别收集对照组及处理组细胞,70%乙醇固定过夜 ,加入 20μg/ml RNase A,37 ℃孵育 30 min,再加入 20μg/ml PI避光孵育 15 min,用 FACScan流式细胞仪进行细胞凋亡率和细胞周期分布的检测。
1.2.4 Western blot法检测 DR5蛋白 将收集的对照组和处理组细胞裂解于 200μl含有蛋白酶抑制剂(100μg/ml苯甲基磺酰氟 ,2 μg/ml Aprotitin)的细胞组织快速裂解液中[0.1%SDS,1%Triton-100,150 mmol/L NaCl,1 mmol/L EDTA(pH 8.0),10 mmol/L Tris-HCl(pH 7.5)],4℃裂解 40 min,15 000 r/min离心 20 min,取上清,Lowry法进行蛋白定量。与 3倍样品缓冲液混合后,煮沸 5 min。将50μg/L的样品在 10%的 SDS-聚丙烯凝胶中进行电泳 3 h,然后转印至硝酸纤维素膜上(电压:2 mV/cm2,时间:40 min)。用 5%脱脂牛奶封闭 2 h后,按预染 Marker标记的分子量剪裁转印膜,加入 DR5、Actin抗体,4℃过夜。含吐温的三羟甲基氨基甲烷缓冲盐水洗 4次后加入二抗室温作用 30 min,ECL法显色,GIS凝胶图像分析系统照相并分析处理。
1.3 统计学方法 采用 SPSS13.0统计软件,结果以±s表示。计量资料比较采用t检验。P≤0.05为差异有统计学意义。
2 结果
2.1 紫杉醇对 TRAIL诱导胃癌 SGC7901细胞的增殖抑制作用 MTT结果显示,0.10~50.00μg/ml的紫杉醇处理胃癌 SGC7901细胞 24 h,紫杉醇以剂量依赖性方式抑制胃癌 SGC7901细胞增殖,24 h抑制细胞增殖 50%的药物浓度(IC50)是(7.19±1.13)μg/ml。100 ng/ml的 TRAIL作用胃癌 SGC7901细胞24 h,对细胞的增殖抑制率为(6.27±2.14)%;紫杉醇(7.19 μg/ml,24 h的 IC50剂量)单药作用胃癌SGC7901细胞,对细胞的增殖抑制率为(48.05±4.65)%。与单药紫杉醇相比,紫杉醇联合 TRAIL对细胞的增殖抑制作用明显增加,抑制率达到(69.24±5.33)%(P<0.05)。
2.2 紫杉醇对 TRAIL诱导胃癌 SGC7901细胞凋亡作用 流式细胞仪显示,100 ng/ml的 TRAIL作用胃癌 SGC7901细胞 24 h,细胞凋亡率只有(3.76±1.46)%;紫杉醇(7.19μg/ml)作用胃癌 SGC7901细胞 24 h,主要诱导细胞发生 G2~M期阻滞,周期阻滞率达到(32.90±4.89)%。紫杉醇(7.19μg/ml)联合 TRAIL(100 ng/ml)作用胃癌 SGC7901细胞 24 h,发生 G2~M期阻滞的细胞减少,但凋亡细胞明显增多,细胞凋亡率达到(35.17±4.31)%(P<0.05)。
2.3 紫杉醇对 TRAIL诱导胃癌 SGC7901细胞 DR5蛋白表达的影响 100 ng/ml的 TRAIL作用SGC7901细胞 24 h,对 DR5的蛋白表达没有影响。见图1B。7.19μg/ml紫杉醇作用于胃癌 SGC7901细胞 8 h,DR5的蛋白表达轻度上调;将作用时间延长至 24 h,DR5的蛋白表达进一步提高。见图1A。与单药紫杉醇相比,7.19μg/ml紫杉醇和 100 ng/ml TRAIL联合作用 SGC7901细胞 24 h,DR5的蛋白表达同样明显上调(P<0.05)。见图1B。
3 讨论
TRAIL作为生物制剂能诱导多种肿瘤细胞发生凋亡,但研究显示 ,胃癌SGC7901细胞对TRAIL耐药,其耐药机制不明[4]。因此,提高胃癌细胞对TRAIL的敏感性十分必要。有研究显示,顺铂、表柔比星等化疗药与 TRAIL联合应用,可明显提高肿瘤细胞对 TRAIL的敏感性[5,6],其机制尚未完全清楚。DR5作为 TRAIL的膜受体,与 TRAIL结合后能募集下游凋亡相关信号分子,从而启动凋亡通路。因此,DR5是 TRAIL启动凋亡的关键因子。
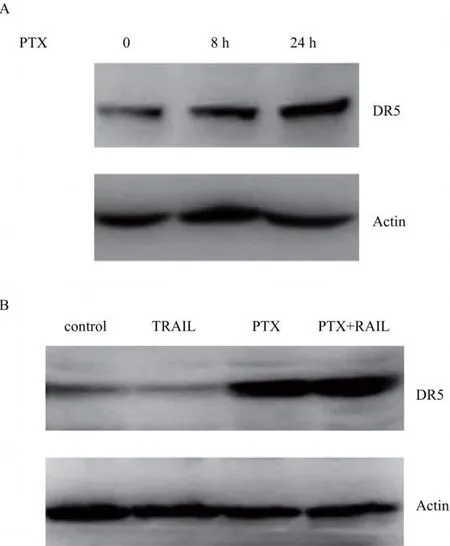
图1 紫杉醇和 TRAIL对SGC7901细胞中 DR5蛋白表达的影响
紫杉醇作为一种高活性的抗肿瘤药物,在胃癌的临床治疗中取得了很好的疗效,在恶性胶质瘤、乳腺癌和结肠癌细胞中,紫杉醇和 TRAIL有协同杀伤肿瘤细胞的效应[7~9]。Gong等报道,紫杉醇通过上调 DR5的表达,从而提高了结肠癌细胞对 TRAIL的敏感性[10]。Nguyen的研究显示,紫杉醇提高了胸部肿瘤细胞对 TRAIL的敏感性,但紫杉醇并没有改变细胞中 DR5的水平[11]。因此,在不同的肿瘤细胞中,紫杉醇对 DR5表达的影响并不一致。本研究结果显示,紫杉醇能通过上调 DR5的蛋白表达,从而增强了胃癌 SGC7901细胞对 TRAIL的敏感性。本文结果还表明,紫杉醇明显增强了 TRAIL对胃癌SGC7901细胞的增殖抑制作用。尽管紫杉醇对细胞凋亡没有明显影响,但紫杉醇使胃癌 SGC7901细胞发生了 G2~M期阻滞。紫杉醇和 TRAIL联合作用SGC7901细胞,细胞凋亡率明显提高,提示紫杉醇和TRAIL联合对胃癌 SGC7901细胞的杀伤作用增强。
总之,紫杉醇很可能通过上调 DR5蛋白的表达,从而增强 TRAIL对胃癌 SGC7901细胞的杀伤作用。紫杉醇和 TRAIL的联合应用能够逆转胃癌细胞对 TRAIL的耐药。
[1]Koornstra JJ,Jalving M,Rijcken FE,et al.Expression of tumour necrosis factor-related apoptosis-inducing ligand death receptors in sporadic and hereditary colorectal tumours:potential targets for apoptosis induction[J].Eur J Cancer,2005,41(8):1195-1202.
[2]Shankar S,Chen X,Srivastava RK.Effects of sequential treatments with chemotherapeutic drugs followed by TRAIL on prostate cancer in vitro and in vivo[J].Prostate,2005,62(2):165-186.
[3]Nimmanapalli R,Perkins CL,Orlando M,et al.Pretreatment with paclitaxel enhances apo-2 ligand/tumor necrosis factor-related apoptosis-inducing ligand-induced apoptosis of prostate cancer cells by inducing death receptors 4 and 5 protein levels[J].Cancer Res,2001,61(2):759-763.
[4]Xu L,Qu X,Zhang Y,et al.Oxaliplatin enhances TRAIL-induced apoptosis in gastric cancer cellsby CBL-regulated death receptor redistribution in lipid rafts[J].FEBS Lett,2009,583(5):943-948.
[5]Woods DC,Alvarez C,Johnson AL.Cisplatin-mediated sensitivity to TRAIL-induced cell death in human granulosa tumor cells[J].Gynecol Oncol,2008,108(3):632-640.
[6]Aroui S,Brahim S,Hamelin J,et al.Conjugation of doxorubicin to cell penetrating peptides sensitizes human breast MDA-MB 231 cancer cells to endogenous TRAIL-induced apoptosis[J].Apoptosis,2009,14(11):1352-1365.
[7]Dorsey JF,Mintz A,Tian X,et al.Tumor necrosis factor-related apoptosis-inducing ligand(TRAIL)and paclitaxel have cooperative in vivo effects against glioblastoma multiforme cells[J].Mol Cancer Ther,2009,8(12):3285-3295.
[8]Yoshida T,Zhang Y,Rivera Rosado LA,et al.Repeated treatment with subtoxic doses of TRAIL induces resistanceto apoptosis through its death receptors in MDA-MB-231 breast cancer cells[J].Mol Cancer Res,2009,7(11):1835-1844.
[9]Connolly K,Mitter R,Muir M,et al.Stable XIAP knockdown clones of HCT116 colon cancer cells are more sensitive to TRAIL,taxanes and irradiation in vitro[J].Cancer Chemother Pharmacol,2009,64(2):307-316.
[10]Gong J,Yang D,Kohanim S,et al.Novel in vivo imaging shows up-regulation of death receptors by paclitaxel and correlates with enhanced antitumor effects of receptor agonist antibodies[J].Mol Cancer Ther,2006,5(12):2991-3000.
[11]Nguyen DM,Yeow WS,Ziauddin MF,etal.The essential role of the mitochondria-dependent death-signaling cascade in chemotherapy-induced potentiation of Apo2L/TRAIL cytotoxicity in cultured thoracic cancer cells:amplified caspase 8 is indispensable for combination-mediated massive cell death[J].Cancer J,2006,12(4):257-273.
