弯齿琵甲含药血清对宫颈癌 HeLa细胞增殖的影响
2011-05-23周艳芬田景贤倪志华张瑞英任国栋
周艳芬 ,田景贤 ,倪志华,2,靳 祎,张瑞英,任国栋
(1河北大学生命科学院,河北保定 071002;2河北省生物工程技术研究中心)
弯齿琵甲是我国华北北部和西北东部的优势昆虫,研究表明[1~4],该昆虫的防御性分泌物含有 16种游离氨基酸和 16种蛋白氨基酸,有些氨基酸具有免疫调节及抗肿瘤作用,但有关弯齿琵甲的抗肿瘤作用鲜见报道。2009年,本实验观察了弯齿琵甲含药血清对宫颈癌 HeLa细胞增殖的影响。现报告如下。
1 材料与方法
1.1 材料 弯齿琵甲采自河北省张北县,在河北大学生物化学实验室饲养;健康家兔 12只,体质量1.8~2.0 kg;宫颈癌 HeLa细胞购自河北省肿瘤医院科研中心。主要仪器及试剂:四甲基偶氮唑盐(MTT)购自 Sigma公司;二甲基亚砜(DMSO)购自 GIBCO公司;RPMI 1640培养基,GIBCO公司产品;新生牛血清,中国杭州四季青生物工程材料有限公司产品;Wright's-Giemsa染液购自 GIBCO公司;吖啶橙(AO)购自惠泽生物公司;溴化乙锭(EB)购自华美生物工程公司;CO2培养箱,日本 Sanyo公司;超净工作台,苏州净化集团安泰公司制造;倒置显微镜,日本 Olympus公司;Bio-Rad Model m680酶标仪,美国 Gene公司。
1.2 方法
1.2.1 弯齿琵甲含药血清的制备 取干燥的弯齿琵甲 15 g,研磨成粉,溶于 300 ml生理盐水,8 000 r/min离心 10 min,取上清,分别进行 3、9倍稀释,浓度依次划分为 3组:原液组(高剂量组)、3倍稀释溶液组(中剂量组)、9倍稀释溶液组(低剂量组)。将12只健康家兔随机分为 4组,每组 3只。按灌胃给药浓度不同分为高剂量药物组、中剂量药物组、低剂量药物组、空白组。各组家兔每日早、晚各灌胃给药1次 ,每次 15 ml,连续 3 d;末次给药 1 h后乙醚麻醉,取颈动脉血 10 ml,注入无菌管中,4℃冰箱静置6 h,吸出上清液,2 000 r/min离心 10 min,取上清液置 56℃水浴中灭活 30 min,0.22μm的微孔滤膜过滤,即为含药血清。
1.2.2 细胞培养 宫颈癌 HeLa细胞培养于含10%新生牛血清、100 mg/L青霉素、100 mg/L链霉素的 RPMI 1640培养液、5%CO2、37℃细胞培养箱中常规培养,取对数生长期的细胞用于实验。
1.2.3 宫颈癌 HeLa细胞增殖抑制率的检测 采用 MTT法。取对数生长期细胞消化,调整细胞密度至 2.5×104/ml,接种于 96孔板,培养基量为 1.8×10-4L/孔 (细胞量约 3 ×104/孔 ),5%CO2、37 ℃细胞培养箱过夜培养,待细胞贴壁后,吸出旧的培养基,将高、中、低 3个剂量的含药血清分别配制成含血清量 10%、20%的培养基,加入 96孔板,阴性对照组用等体积的空白组血清培养基,每个浓度设 5个平行孔,分别继续培养 24、48 h。培养结束后,每孔分别加入 2×10-5L MTT(终浓度为 0.5 g/L),孵育 4 h,弃上清 ,加入 DMSO 1.5×10-4L,震荡器轻微震荡 10 min,于酶标仪 570 nm处测定各孔的吸光度(OD570值),计算细胞增殖抑制率。细胞增殖抑制率 =(1-实验组 OD570/对照组 OD570)×100%。
1.2.4 宫颈癌 HeLa细胞形态学观察 ①Wright's-Giemsa染色:在 24孔板中加入 5×10-4L细胞悬液(1×105/孔),待细胞在 24孔培养板中贴壁后,吸弃培养基,加入 5×10-4L弯齿琵甲含药血清培养基,阴性对照加入空白组血清培养基,继续培养至48 h,弃上清,用 PBS洗涤 3次,95%的乙醇进行固定 10 min,按试剂盒操作 Wright's-Giemsa染色 20 min,PBS冲洗 3次,倒置显微镜下观察并拍照。②AO-EB染色:细胞处理同上,加入 8×10-6L AO-EB染色液(0.2 g/L的吖啶橙和 0.2 g/L溴化乙啶各 4×10-6L)染色 10 min,弃去染液 ,PBS冲洗 3次,加入封片剂(甘油∶PBS=1∶1),荧光显微镜下观察并拍照。
1.2.5 凋亡细胞生化特征检测 取对数生长期的肿瘤细胞用 0.25%胰蛋白酶消化,制成细胞悬液,调整细胞密度为 1×108/L,接种于 25 cm2的培养瓶中,置于 5%CO2、37℃的恒温培养箱中培养至细胞贴壁后吸弃培养液,实验组分别加入 20%不同剂量弯齿琵甲含药血清培养基(高剂量、中剂量和低剂量),培养 48 h后,按动物细胞 DNA提取试剂盒操作提取其 DNA,并进行 1.5%琼脂糖凝胶电泳,75 mA恒流 1.5~2.0 h。电泳完毕,在凝胶成像分析仪内扫描、观察、拍照。
1.3 统计学方法 采用 SPSS13.0统计软件,结果以±s表示,数据处理采用方差分析。P≤0.05为差异有统计学意义。
2 结果
2.1 弯齿琵甲含药血清对宫颈癌 HeLa细胞的抑制作用 见表1。
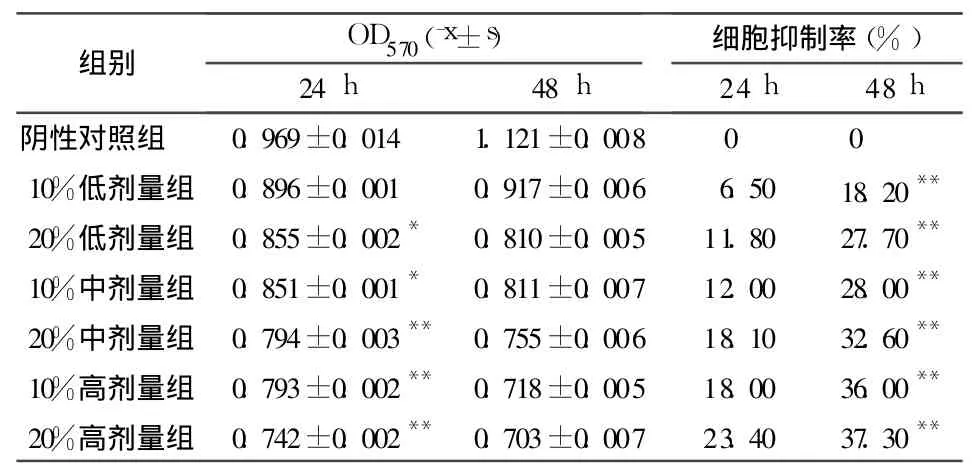
表1 弯齿琵甲含药血清对宫颈癌HeLa细胞增殖的影响
2.2 弯齿琵甲含药血清对 HeLa细胞形态学的影响 弯齿琵甲含药血清处理宫颈癌 HeLa细胞 48 h后,Wright's-Giemsa染色法在倒置显微镜下显示,宫颈癌 HeLa细胞部分出现细胞膜皱缩,细胞核固缩,核染色质边缘化,核膜裂解,细胞膜周围或细胞外出现凋亡小体,并随着剂量的增加细胞凋亡数量也增加,表明弯齿琵甲含药血清能够诱导 HeLa细胞凋亡;阴性对照组 HeLa细胞的细胞膜完整,核仁及染色质分布在细胞核中。AO-EB染色荧光显微镜下显示,正常活细胞核染色质呈均匀绿色,细胞形态正常,早期凋亡的细胞呈黄绿色球状,晚期凋亡细胞呈橙红色球状,进一步表明弯齿琵甲含药血清能够诱导宫颈癌 HeLa细胞凋亡。
2.3 凋亡细胞 DNA片段的检测 琼脂糖凝胶电泳显示,3、4、5泳道均可见 DNA梯形状,说明弯齿琵甲含药血清是通过诱导细胞凋亡来抑制 HeLa细胞的增殖作用。见图1。
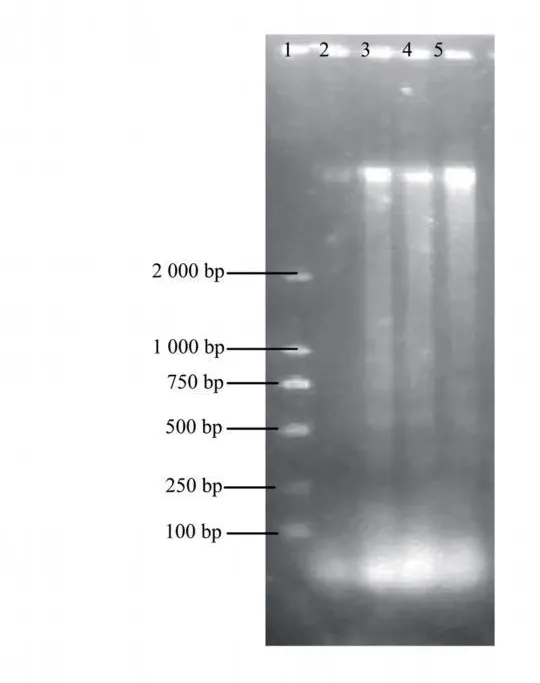
图3 HeLa细胞经不同剂量琵甲含药血清作用后DNA片段分析
3 讨论
血清药理学是日本学者 Hiroko Iwama于 1984年在第一届和汉医药学会上首次提出的[5],是指将中药或中药复方经口给动物灌服一定时间后采集动物血液,分离血清,用含有药物成分的血清进行体外实验的一种研究方法。该研究法被广泛用于中药的药理及药效学的研究中,能较为客观真实地阐明中药的药效和作用机制[6]。弯齿琵甲的匀浆液含有蛋白质、脂肪、多糖、微量元素、防御液等多种成分,如果将其粗制品直接加入体外培养细胞系中,往往由于粗制品中含有较多的杂质、p H值、渗透压等影响实验结果,而且该粗制品多数通过口服经体内代谢发挥直接或间接的治疗效果,与体外实验结果常常不一致。因此,本实验采用含药血清用于体外实验更能反映粗制品的体内效应,客观地模拟了药物与机体相互作用的过程,所获实验结果与体内实验有较好的一致性,为从细胞、亚细胞和基因水平研究中药的抗癌机制提供了一个更加科学、客观的研究手段。
为了探讨弯齿琵甲抗肿瘤的作用机制,本实验首先将制备的含药血清按 10%、20%的浓度添加到无血清培养基中,采用 MTT法检测不同剂量的弯齿琵甲含药血清作用于 HeLa细胞 24、48 h后,抑制作用明显,且呈量效、时效关系。Wright's-Giemsa染色可以清晰地看到凋亡细胞的形态变化,细胞变圆,晚期凋亡细胞出现凋亡小体。荧光显微镜下观察AO-EB染色,可以看到早期凋亡细胞呈黄绿色球状,晚期凋亡细胞呈橙红色。这些结果初步表明弯齿琵甲含药血清通过诱导细胞凋亡作用发挥抗肿瘤作用。
细胞凋亡是细胞在特定信号诱导下的主动程序性死亡,凋亡过程会发生多种生化特征的改变,如蛋白降解、蛋白偶联、DNA裂解以及吞噬细胞识别,凋亡晚期的主要生化特征是染色质发生浓缩,染色质DNA被 Ca2+和 Mg2+依赖的核酸内切酶降解成 180~200 bp的寡核苷酸片段[7,8],在凝胶电泳上表现为 DNA梯形状。本实验选用 20%高、中、低剂量弯齿琵甲含药血清培养基分别作用于 HeLa细胞 48 h后,细胞不同程度地出现了梯状条带,进一步说明弯齿琵甲含药血清能够诱导 HeLa细胞的凋亡作用。
综上所述,我们认为弯齿琵甲含药血清对宫颈癌 HeLa细胞的增殖具有抑制作用,且呈量效和时效关系,为宫颈癌的治疗提供了新的药源,为弯齿琵甲的进一步开发利用奠定了理论基础,但具体发挥作用的中药成分及其是否影响相关基因的表达,以及对其他癌细胞是否有相同功效还有待于进一步研究。
致谢:感谢河北农业大学朱宝成教授在实验过程中提供的帮助。
[1]郭志峰,任国栋,安秋荣.齿琵甲防御腺分泌物的分析[J].河北大学学报(自然科学版),2000,20(S1):122-124.
[2]刘勇,罗氚芸,李蕾,等.云南琵琶甲防御性分泌物抗菌活性及GC-MS分析[J].云南大学学报(自然科学版),2000,22(3):217-219.
[3]罗氚芸,刘勇,李蕾,等.南民间药用琵琶甲无机元素及氨基酸分析[J].氨基酸和生物资源,1999,21(3):38-40.
[4]唐斌,杜曦,胡昕.一剂抗癌偏方成药及其主料的紫外光谱研究和微量元素分析[J].现代预防医学,2009,36(21):4153-4155.
[5]王本祥.现代中药药理与临床[M].天津:天津科技翻译出版公司,2004:14-29.
[6]王国佐,葛金文.血清药理学方法在中药研究中的进展[J].湖南中医药大学学报,2007,27(3):78-80.
[7]Sohn D,Totzke G,Essmann F,et al.The proteasome is required for rapid initiation of death receptor-induced apoptosis[J].Mol Cell Biol,2006,26(5):1967-1978.
[8]Elmore S.Apoptosis:A review of programmed cell death[J].Toxicol Pathol,2007,35(4):495-516.
