中国西部健康人群口服替诺福韦富马酸酯片的药动学研究Δ
2011-05-23谭瑞杨俊卿颜波尚京川黄爱龙重庆医科大学药理学教研室重庆市400016重庆医科大学药物分析教研室重庆市400016重庆医科大学感染性疾病分子生物学教育部重点实验室重庆市400016
谭瑞,杨俊卿,颜波,尚京川,黄爱龙(1.重庆医科大学药理学教研室,重庆市 400016;.重庆医科大学药物分析教研室,重庆市 400016;.重庆医科大学感染性疾病分子生物学教育部重点实验室,重庆市 400016)
替诺福韦富马酸酯(Tenofovir disoproxil fumarate,TDF)是由美国吉利德公司研究开发的一种新型的核苷类逆转录酶抑制剂,2001年首次在美国上市,临床主要用于治疗人类免疫缺陷病毒(HIV)感染[1],并与另一个抗逆转录病毒药物恩曲他滨(Emtricitabine,FTC)作为治疗HIV感染的一线药物[2]。TDF还具有很好的抗乙型肝炎病毒(HBV)活性,美国食品与药物管理局(FDA)已经批准其用于治疗成人慢性乙型肝炎[3,4]。TDF已在国内上市,FTC已在国内生产,均作为抗艾滋病的二线药物。并且目前国内、外正在进行TDF、TDF联用FTC作为HIV暴露前预防用药减少新发HIV感染的研究[5~7]中。国外已有关于TDF的药动学特征的报道[5],而在中国人群,仅有1项健康人群TDF单独给药的药动学研究[8]。本文对TDF在中国西部健康人群中的药动学特征进行了研究,并观察高脂饮食以及合用FTC对TDF药动学参数的影响。
1 材料
1.1 仪器
1100型高效液相系统,包括G1311A型四元输液泵、G1328B型自动进样器、G1314A紫外检测仪、G1316A型柱温箱和G1322A型脱气机(美国Agilent公司);BS210S电子天平(德国赛多利斯公司);Bond Elut C18固相萃取柱(200 mg/3 mL,美国瓦力安公司)。
1.2 试药
TDF片(美国吉利德公司,规格:每片300 mg,批号:A708846);FTC胶囊(河北医科大学制药厂生产,规格:200 mg,批号:100101);替诺福韦标准品(含量:100%)、拉米夫定标准品(内标,含量:100%)均为杭州英谱科技技术发展有限公司提供;FTC标准品(四川百利制药有限公司,含量:100%);甲醇为色谱纯,磷酸二氢钾、醋酸铵、磷酸、氢氧化钠、三氯乙酸均为国产分析纯。
2 方法与结果
2.1 色谱条件
色谱柱:Phecda C18(250 mm×4.6 mm,5 μm);保护柱:Phenomenex®C18(4.0 mm×3.0 mm,5 μm);流动相:采用梯度洗脱,其中流动相A为含0.08%三乙胺的20 mmol·L-1磷酸二氢钾水溶液(稀磷酸调节pH值至3.5),流动相B为甲醇(流动相梯度洗脱程序见表1);内标:拉米夫定;检测波长:270 nm;柱温:35 ℃;流速:1 mL·min-1;进样量:100 μL;分析时间:30 min。

表1 流动相梯度洗脱程序Tab 1 Gradient elution process of mobile phase
2.2 试验溶液的制备
2.2.1 替诺福韦标准溶液:准确称取替诺福韦标准品10.0 mg,加水溶解,得浓度为1.0 mg·mL-1的标准品贮备液,置于4℃冰箱中保存。试验前加水依次稀释为系列标准溶液。
2.2.2 内标溶液:准确称取拉米夫定标准品15.0 mg,用流动相溶解后定容于500 mL容量瓶中,制备成浓度为30.0 μg·mL-1的内标溶液,置于4℃冰箱中保存。
2.3 血浆样品处理
精密量取血浆300 μL,加入内标溶液(30 μg·mL-1拉米夫定)20 μL,混匀后加入10%三氯乙酸180 μL,涡旋混匀30 s后于12000 r·min-1离心10 min,吸取上清液,加入1%氢氧化钠水溶液240 μL中和、混匀,待固相萃取。Bond Elut C18固相萃取柱分别用甲醇3 mL、150 mmol·L-1醋酸铵(pH 5.0)3 mL活化平衡,然后将预处理后的血浆样品注入固相萃取柱中,常压下用100 mmol·L-1醋酸铵(pH 7.0)3 mL洗脱水溶性杂质,抽干萃取柱,用甲醇500 μL洗脱并收集洗脱液,氮气吹干,流动相120 μL复溶,混匀,取100 μL供进样分析。
2.4 专属性考察
按选定的色谱条件测得的替诺福韦、内标和血浆中的内源性杂质有很好的分离,特异性良好,其中替诺福韦、内标的保留时间分别为6.54、7.74 min。高效液相色谱图见图1。

图1 高效液相色谱图A.空白血浆;B.空白血浆+2000 ng·mL-1替诺福韦标准溶液+内标(200 ng·mL-1拉米夫定)溶液;C.受试者口服TDF片后血浆样品;1.替诺福韦;2.拉米夫定Fig 1 HPLC chromatogramsA.blank plasma;B.blank plasma+2000 ng·mL-1tenofovir standard substance+internal standard(200 ng·mL-1lamivudine);C.plasma sample of objects after oral dose of tenofovir disoproxil fumarate;1.tenofovir;2.lamivudine
2.5 标准曲线的制备
精密吸取空白血浆1800 μL,分别加入系列标准溶液各200 μL,再加入内标溶液,混匀,制备成含替诺福韦10.0、20.0、50.0、100.0、200.0、500.0、1000.0、2000.0、5000.0 ng·mL-1的血浆样品,再按“2.3”项下方法处理,进样测定,记录色谱。以替诺福韦与拉米夫定的峰面积比(Y)为纵坐标,替诺福韦浓度(X)为横坐标,采用加权最小二乘法进行线性回归,得回归方程为:Y=0.0027X-0.0362(r=0.9994)。结果表明,替诺福韦血药浓度在10.0~5000.0 ng·mL-1范围内线性关系良好,最低定量限为10.0 ng·mL-1。
2.6 精密度及回收率试验
制备20.0、200.0、2000.0 ng·mL-13种浓度的标准血浆样品各5份,按“2.3”项下方法进行操作、测定,连续5 d,根据随行标准曲线计算样品浓度,计算得到血浆中替诺福韦的日内、日间精密度及方法回收率;另以血浆样品中替诺福韦峰面积与其对照品峰面积比值计算平均提取回收率,结果见表2。
表2 回收率及精密度试验结果(±s ,n=5)Tab 2 Results of recovery and precision tests(±s ,n=5)

表2 回收率及精密度试验结果(±s ,n=5)Tab 2 Results of recovery and precision tests(±s ,n=5)
理论值/ng·mL-1 20.0200.02000.0方法回收率/%119.3±10.2105.4±3.6106.1±2.6日内RSD/%9.63.82.4日间RSD/%9.36.35.4提取回收率/%95.5±6.072.8±3.273.5±2.6
2.7 稳定性试验
制备20.0、200.0、2000.0 ng·mL-13种浓度的标准血浆样品,分别按下述方法进行处理,即-20℃反复冻融3次、-20℃存放50 d、常温下放置24 h后,取样测定,记录峰面积。结果,3种浓度标准血浆样品的RSD均<5%,表明待测样品在上述条件下稳定。
2.8 受试者的选择
中国西部男性健康志愿受试者24名,年龄22~27岁,身高168~176 cm,体重指数均在正常值(19~24)范围内。全面体格检查结果良好,受试者无既往病史和药物过敏史,精神状态良好,血、尿常规,肝、肾功能及心电、心律、血压均在正常范围内,试验前2周及试验期间未服用其他任何药物,所有受试者均签署知情同意书,试验方案经重庆医科大学医学伦理委员会审批同意。
2.9 给药方案与采血时间点
24名健康男性志愿受试者随机分3组,每组8人,分别给予TDF片300 mg、FTC胶囊200 mg+TDF片300 mg、脂肪食物(食物中脂肪比例50%)+TDF片300 mg。受试者于试验当日早晨埋置静脉留置针,早晨8时给药,分别于服药前0 h和服药后0.5、0.75、1、1.5、2、3、4、6、8、12、24、36、48、72 h时取静脉血2 mL,分离血浆,置于-20℃冰箱中冷冻,待测。
2.10 数据处理
以DAS(Ver2.1.1)软件计算药动学参数;运用SPSS统计分析软件,进行药动学参数组间差异性统计(P<0.05表示差异有统计学意义)。
2.11 药动学参数考察
24名健康男性志愿受试者分别口服TDF片、FTC胶囊+TDF片、脂肪食物+TDF后测得替诺福韦的药-时曲线见图2。

图2 健康志愿受试者口服TDF片后的药-时曲线(±s,n=8)Fig 2 Plasma concentration-time curves of tenofovi(r±s,n=8)
DAS(Ver 2.1.1)软件拟合结果显示,TDF组、FTC+TDF组、脂肪食物+TDF组中FTC的药-时数据均符合二室开放性药动学模型。拟合所有数据,得出药动学参数,其中cmax、tmax以实测值计算,受试者的主要药动学参数见表3。
表3 健康志愿受试者口服TDF片后的主要药动学参数(±s ,n=8)Tab 3 Main pharmacokinetic parameters of TDF in healthy volunteers after oral dose of TDF tablets(±s ,n=8)
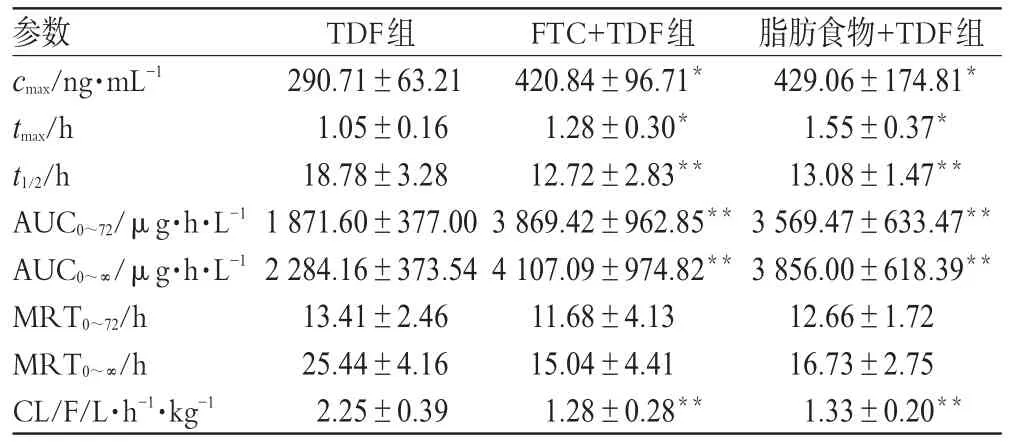
表3 健康志愿受试者口服TDF片后的主要药动学参数(±s ,n=8)Tab 3 Main pharmacokinetic parameters of TDF in healthy volunteers after oral dose of TDF tablets(±s ,n=8)
与TDF组比较:*P<0.05,**P<0.01vs.TDF group:*P<0.05,**P<0.01
参数cmax/ng·mL-1 tmax/h t1/2/h AUC0~72/μg·h·L-1 AUC0~∞/μg·h·L-1 MRT0~72/h MRT0~∞/h CL/F/L·h-1·kg-1脂肪食物+TDF组429.06±174.81*1.55±0.37*13.08±1.47**3569.47±633.47**3856.00±618.39**12.66±1.7216.73±2.751.33±0.20**TDF组290.71±63.211.05±0.1618.78±3.281871.60±377.002284.16±373.5413.41±2.4625.44±4.162.25±0.39 FTC+TDF组420.84±96.71*1.28±0.30*12.72±2.83**3869.42±962.85**4107.09±974.82**11.68±4.1315.04±4.411.28±0.28**
利用SPSS统计分析软件,分别将FTC+TDF组、脂肪食物+TDF组的主要药动学参数与TDF组经两组间配对t检验。FTC+TDF组、脂肪食物+TDF组分别与TDF组比较,除MRT差异无统计学意义外,其余参数差异均具有统计学意义。
3 讨论
研究发现,中国西部健康人群口服TDF片,tmax(1.05±0.16)h,t1/2(18.78±3.28)h,cmax为(290.71±63.21)ng·mL-1,AUC0~72与 AUC0~∞分别为(1871.60±377.00)、(2284.16±373.54)μg·h·L-1,与文爱东等[8]报道的研究结果相似。国外研究报道TDF口服给药的主要药动学参数也与本研究结果相似。这些研究结果表明,中国西部健康人群单独给予TDF的药动学特征与国、内外人群均相似。
中国西部健康人群联合给予FTC与TDF,其药动学参数与单独给药组相比,MRT 无明显差异,cmax、AUC0~72、AUC0~∞、tmax值明显增加,而t1/2值降低。与我们的研究结果不同,国外研究报道与FTC合用,对替诺福韦的药动学参数无明显影响[9]。我们的研究还发现,与TDF单独给药相比,给予脂肪饮食,替诺福韦达峰时间明显延迟(tmax增加),生物利用度增加(cmax、AUC0~72和AUC0~∞值增加),代谢加快(t1/2β缩短)。与我们的研究结果相似的是,国外有研究报道替诺福韦单独给药时生物利用度约25%,而脂肪食物可使其提高到39%,且达峰时间延后约0.75 h,cmax提高约15%,AUC提高约35%[9]。研究结果提示中国西部健康人群可能与欧洲人群存在差异,合用FTC后,TDF在中国人群体内的生物利用度提高,代谢速度也加快。
总之,这些研究结果提示,TDF单独给予在中国西部健康人群的药动学特征与国外人群相似,而脂肪食物以及合用FTC可能明显改变替诺福韦的药动学特征。这些研究结果对TDF及TDF联合FTC用于中国人群HIV的治疗,以及用于HIV高危人群暴露前预防,可提供重要的参考依据。
[1]崔 岚,安富荣,王晓珉.核苷酸逆转录酶抑制剂替诺福韦DF[J].中国新药杂志,2004,13(11):1054.
[2]龙亚秋.艾滋病治疗药物的研究进展[J].药学服务与研究,2007,7(6):401.
[3]Quan DJ,Peters MG.Tenofovir disoproxil fumarate for the treatment of hepatitis B virus infection:pharmacokinetics and clinical efficacy[J].Therapy,2007,4(2):141.
[4]Peters MG,Andersen J,Lynch P,et al.Randomized controlled study of tenofovir and adefovir in chronic hepatitis B virus and HIV infection:ACTG A5127[J].Hepatology,2006,44(5):1110.
[5]Kearney BP,Flaherty JF,Shah J.Tenofovir disoproxil fumarate:clinical pharmacology and pharmacokinetics[J].Clin Pharmacokinet,2004,43(9):595.
[6]Anonymous.CDC trials of pre-exposure prophylaxis for HIV prevention[EB/OL].http://www.cdc.gov/hiv/resources/Factsheets/PDF/prep.pdf.2009-01-26.
[7]Clauson KA,Polen HH,Joseph SA,et al.Role of the pharmacist in pre-exposure chemoprophylaxis(PrEP)therapy for HIV prevention[J].Pharm Pract,2009,7(1):11.
[8]文爱东,王志睿,杨志福.富马酸替诺福韦酯胶囊在健康人体内的药动学研究[J].药学服务与研究,2007,7(3):191.
[9]FDA.Document of TRUVADA®(emtricitabine and tenofovir disoproxil fumarate)[EB/OL].http://www.accessdata.fda.gov/drugsatfda_docs/label/2008/021752s017lbl.pdf.2009-07-12.
