注射用头孢尼西钠与果糖注射液的配伍稳定性考察
2011-11-17惠慧韩强徐州医学院附属医院药剂科徐州市221002
惠慧,韩强(徐州医学院附属医院药剂科,徐州市221002)
注射用头孢尼西钠与果糖注射液的配伍稳定性考察
惠慧*,韩强#(徐州医学院附属医院药剂科,徐州市221002)
目的:考察注射用头孢尼西钠在室温(25±1)℃下与果糖注射液配伍的稳定性。方法:模拟临床用药浓度,将注射用头孢尼西钠1.0 g加入到10 mL果糖注射液中,混合均匀后,在室温(25±1)℃下考察6 h内配伍液的外观和pH值变化,并采用高效液相色谱法测定头孢尼西的含量,同时考察有无新物质生成。结果:在室温(25±1)℃下,0~6 h配伍液的外观、pH值、头孢尼西的含量均无明显变化。结论:注射用头孢尼西钠与果糖注射液配伍,在室温(25±1)℃下6 h内配伍稳定。
注射用头孢尼西钠;果糖注射液;配伍;稳定性;高效液相色谱法
头孢尼西钠为第2代头孢菌素类,通过抑制细菌细胞壁合成产生抗菌活性。对革兰阳性和阴性菌以及一些厌氧菌均有抗菌作用,临床上多用于下呼道感染、尿路感染、败血症、皮肤软组织感染、骨和关节感染等的治疗,也可用于手术预防感染。果糖注射液具有直接供给热能、补充体液及营养全身的功效[1],在提供能量同时可有效降低血糖波动,是糖尿病患者治疗时的首选输液。另有临床研究表明患者在大中型手术等应激状态下输注果糖注射液可稳定其血糖水平,减轻患者的代谢负担[2]。因此,笔者考察了注射用头孢尼西钠在果糖注射液中的稳定性,为糖尿病患者或手术患者在抗感染治疗时的输液配伍方面提供参考。
1 材料
1.1 仪器
高效液相色谱仪,包括1525型分离系统(含二元梯度洗脱系统、柱温箱等)、717自动进样器、2487双波长紫外检测器、Empower色谱数据工作站(美国Waters公司);UV-2401PC紫外分光光度计(日本岛津公司);pHS-3B型pH计及FA1004B电子天平(均为上海精密科学仪器有限公司产品)。
1.2 试药
注射用头孢尼西钠(深圳信立泰药业股份有限公司,规格:1.0 g,批号:20100501);头孢尼西钠对照品(深圳信立泰药业股份有限公司,含量:85.3%,批号:20090402);果糖注射液(江苏正大丰海制药有限公司,规格:250 mL,批号:1002091);甲醇为色谱纯,磷酸氢二钾及磷酸试剂均为分析纯,水为本院制剂室自制双重蒸馏水。
2 方法与结果
2.1 色谱条件
色谱柱:Xterra®RP18(250 mm×4.6 mm,5 μm);流动相:甲醇-0.01 mol·L-1磷酸二氢钾溶液(以磷酸调节pH值至3.5)(25∶75);流速:1.0 mL·min-1;柱温:30 ℃;检测波长:265 nm;灵敏度:AUFS2.0;进样量:20 μL。色谱图见图1。
2.2 头孢尼西钠对照品贮备液的制备
准确称取干燥至恒重的头孢尼西钠对照品50 mg,置于100 mL容量瓶中,加双重蒸馏水溶解并稀释至刻度,配成浓度为500 µg·mL-1的对照品贮备液。
2.3 标准曲线的制备
精密量取“2.2”项下头孢尼西钠对照品贮备液,稀释成含头孢尼西钠浓度为20.0、30.0、40.0、50.0、60.0、70.0 µg·mL-1的系列溶液,按“2.1”项下色谱条件进样测定,记录色谱。以浓度(c)为横坐标、相应峰面积(A)为纵坐标进行线性回归,得回归方程为:A=2.182 1×104c+1.984×103(r=0.999 9,n=7)。结果表明,头孢尼西钠检测浓度在20.0~70.0µg·mL-1范围内线性关系良好。
2.4 精密度试验
取“2.3”项下浓度为40.0 µg·mL-1的头孢尼西钠对照品溶液进样20μL,重复5次,记录色谱。结果,峰面积RSD为0.42%(n=5)。
2.5 回收率试验
精密吸取头孢尼西钠对照品贮备液适量,分别按比例加入果糖注射液,用蒸馏水稀释成含头孢尼西钠浓度为20.0、40.0、60.0 µg·mL-1的溶液,在265 nm 波长处分别测定峰面积(A)值,并代入标准曲线方程计算浓度,并计算回收率,结果见表1。
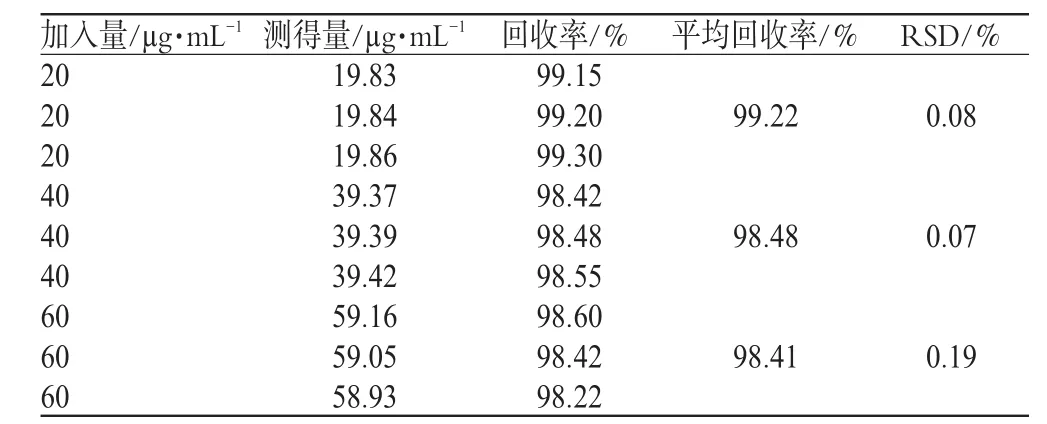
表1 回收率试验结果(x±s, n=9)Tab 1Results of recovery test(sx±s ,n=9)
2.6 配伍试验
模拟临床用药浓度,称量注射用头孢尼西钠1.0 g,置于10 mL容量瓶中,用果糖注射液溶解并稀释至刻度,取供试液置于(25±1)℃、不避光的条件下放置,于0、1、2、4、6 h时观察配伍液的外观,并测定pH值,同时取样测定含量并观察色谱图有无新物质峰出现。
2.7 外观及pH值变化
用纳氏比色管观察配伍液0、1、2、4、6 h时均为无色透明液体,未见气泡生成,6 h内无颜色变化,无混浊及沉淀生成。另测定配伍液各时间点的pH值,结果见表2。
表2 配伍液中头孢尼西钠含量及pH值测定结果(x±s, n=3)Tab 2 Content of cefonicid sodium in mixture and pH value(±s, n=3)
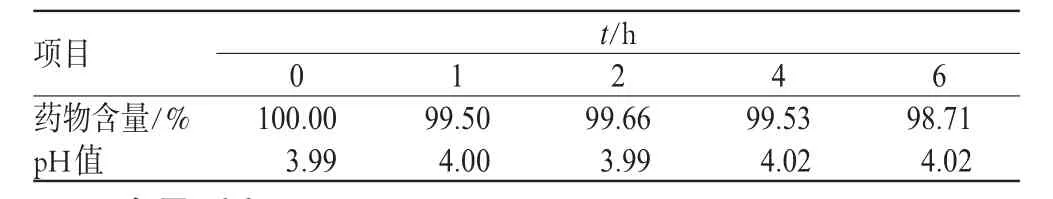
表2 配伍液中头孢尼西钠含量及pH值测定结果(x±s, n=3)Tab 2 Content of cefonicid sodium in mixture and pH value(±s, n=3)
t/h 项目药物含量/%p H值1 2 4 6 0 1 0 0.0 0 3.9 9 9 9.5 0 4.0 0 9 9.6 6 3.9 9 9 9.5 3 4.0 2 9 8.7 1 4.0 2
2.8 含量测定
配伍液于不同时刻取样后按“2.1”项下色谱条件进样测定,计算头孢尼西钠的含量,以配伍液0 h含量为100%,计算各相应时间药物的相对含量,结果见表2。
3 讨论
用高效液相色谱法测定注射用头孢尼西钠与果糖注射液配伍后的药物含量,在(25±1)℃及不避光的条件下6 h内的含量变化不大,均在98%以上,外观及pH值无显著变化。比较配伍前、后高效液相色谱图谱峰形、保留时间,均未见明显变化,且无其他色谱峰产生。提示该配伍是可行的,但为了确保用药安全,建议配伍液最好在4 h内用完。
本试验仅从理化性质角度对注射用头孢尼西钠与果糖注射液的配伍稳定性进行考察,其药理及生化方面配伍因素的考察试验有待进一步研究。
[1] 陈新谦,金有豫,汤 光主编.新编药物学[M].第17版.北京:人民卫生出版社,2010:795.
[2] 郑水莲,俞 佳,寿张轩.美洛西林钠在果糖注射液和转化糖注射液中的稳定性考察[J].中国现代应用药学杂志,2008,25(2):160.
Compatible Stability of Cefonicid Sodium for Injection with Fructose Injection
HUI Hui,HANG Qiang
(Dept.of Pharmacy,The Affiliated Hospital of Xuzhou Medical College,Xuzhou 221002,China)
OBJECTIVE:To investigate the compatible stability of Cefonicid sodium for injection with Fructose injection at room temperature(25±1)℃.METHODS:At room temperature(25±1)℃,Cefonicid sodium for injection 1.0 g was added into 10 mL Fructose injection.The appearance and pH value of mixture in 6 h were observed.The content of cefonicid was determined by HPLC,and whether new matter generated was investigated.RESULTS:At room temperature(25±1)℃,there were no changes in appearance,pH value and cefonicid sodium concentration of mixture within 0~6 h.CONCLUSION:At room temperature(25±1)℃,the compatibility of Cefonicid sodium for injection combined with Fructose injection is stable within 6h.
Cefonicid sodium for injection;Fructose injection;Compatibility;Stability;HPLC
R978.1+1;R969.2
A
1001-0408(2011)22-2061-02
*副主任药师。研究方向:医院药学。电话:0516-85802060。E-mail:jiangfuchang69@163.com
#通讯作者:副主任药师。研究方向:临床药学、药物配伍稳定性。电话:0516-85802195。E-mail:hanqiang1144@163.com
2010-11-26
2011-04-11)
*副主任药师。研究方向:临床药学。电话:0579-85209666
